Interprétation de la formule sanguine au microscope
Auteur:
Dr méd. Kornelius D. Arn
Leitender Arzt Hämatologie
Leiter Hämatologie-Labor
Luzerner Kantonsspital, Luzern
E-mail: kornelius.arn@luks.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’interprétation des frottis sanguins manuels ou observés au microscope demeure un instrument diagnostique important, même à l’ère de la numérisation, mais son utilisation n’a de sens que si elle est alliée à l’analyse de la formule sanguine automatisée et à une problématique spécifique. La plupart du temps, c’est la présence de résultats anormaux sur le plan quantitatif ou qualitatif (messages d’avertissement, «flags») dans l’analyse de la formule sanguine automatisée qui, à titre d’analyse réflexe, suggère la nécessité d’un contrôle manuel de la formule sanguine périphérique.
Keypoints
-
En présence d’anémies hémolytiques (associées ou non à une thrombocytopénie), le frottis sanguin permet de diagnostiquer ou d’exclure rapidement des causes dangereuses, telles qu’une microangiopathie thrombotique.
-
En cas de cytopénies ou de «cytoses» d’origine non élucidée, le frottis sanguin fournit dans de nombreux cas des informations décisives servant souvent d’indicateur pour le diagnostic différentiel et les investigations ultérieures.
-
Examen indispensable, le frottis sanguin est la pierre angulaire du diagnostic de protozoaires parasites associés à une infestation sanguine.
L’examen d’un frottis sanguin fournit des informations importantes dans de nombreuses situations cliniques; cet examen nécessitant seulement un dispositif simple et permettant un résultat rapidement disponible peut contribuer en tant qu’élément essentiel à l’évaluation diagnostique intégrative. Afin de garantir des résultats fiables, il convient de tenir compte de facteurs pré-analytiques qui peuvent influer sur la qualité du frottis sanguin: notamment utilisation de l’anticoagulant adéquat (acideéthylènediaminetétraacétique, EDTA), rapport sang/anticoagulant correct et traitement rapide après le prélèvement sanguin, si possible dans un délai de 2 à 4 heures. Si la préparation d’un frottis sanguin est retardée, les éléments cellulaires du sang subissent des modifications dégénératives. La confection du frottis est réalisée par du personnel formé, le frottis séché étant fixé au méthanol ou à l’alcool éthylique et coloré à la coloration de Pappenheim (May-Grünwald Giemsa). Lors de l’évaluation au microscope, outre la différenciation manuelle de 100 à 200 leucocytes, les résultats morphologiques anormaux sont indiqués de différentes manières: 1. sous forme de description simple, 2. en utilisant des termes tels que présence de ou absence de, 3. sous forme de détermination semi-quantitative: léger (+), modéré (++), prononcé (+++), ou 4. sous forme de pourcentage quantitatif des anomalies morphologiques: normal (<5%), léger (5–25%), modéré (25–50%), prononcé (>50%) – certaines anomalies morphologiques, p.ex. les schizocytes ayant déjà une plus grande importance pour des pourcentages faibles.
Évaluation des érythrocytes
L’analyse de la formule sanguine automatisée fournit le nombre exact et précis d’érythrocytes et les indices érythrocytaires donnent des informations sur la répartition de la population érythrocytaire, sa taille et sa teneur en hémoglobine. Sur un frottis sanguin coloré, les érythrocytes normaux ont un diamètre moyen de 7,5µm; ils sont de forme ronde ou légèrement ovale et présentent un éclaircissement central qui occupe environ le tiers central de la cellule. L’examen au microscope des érythrocytes permet d’identifier les anomalies de taille, de forme et de coloration et la présence d’inclusions (Fig. 1).
Fig. 1: Anomalies des érythrocytes en termes de taille, de forme et de coloration et présence d’inclusions (adapté d’après Jones KW, 2009)
Taille des érythrocytes
L’anisocytose désigne une variabilité accrue de la taille des érythrocytes. Elle n’est pas spécifique et se reflète par une largeur de la courbe de distribution du volume des érythrocytes élevée («indice de distribution des globules rouges», IDR). Les microcytes désignent des érythrocytes de petite taille, d’un diamètre inférieur à 7µm (VGM <80fl); ils peuvent être associés à une diminution de la teneur en hémoglobine (hypochromie). Les macrocytes sont des érythrocytes hypertrophiés d’un diamètre supérieur à 8,5µm, (VGM >100fl) qui se présentent sous une forme ronde ou ovale. La taille du noyau d’un lymphocyte de petite taille d’environ 8µm de diamètre sert de référence interne pour évaluer la taille des érythrocytes lors de l’analyse de la formule sanguine au microscope. Le degré de microcytose ou de macrocytose peut être évalué plus précisément à l’aide de la valeur du VGM et est une aide décisive lors du diagnostic différentiel des anémies. Les causes typiques d’une microcytose érythrocytaire associée ou non à une anémie sont la carence en fer, l’anémie en présence d’une maladie chronique, mais aussi les thalassémies et les hémoglobinopathies. Une macrocytose érythrocytaire est observée en cas d’érythropoïèse mégaloblastique (p.ex. carence en vitamine B12 ou en acide folique) ou macroblastique (notamment alcoolisme, hépatopathies, syndrome myélodysplasique, hypothyroïdie).
Forme des érythrocytes
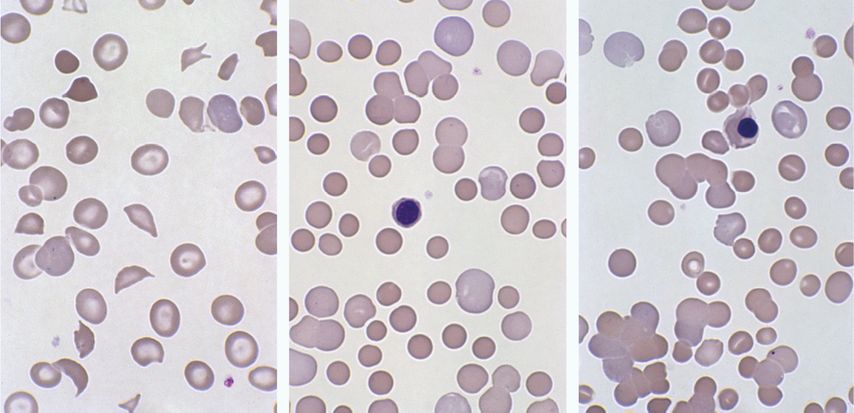
La poïkilocytose désigne des érythrocytes de forme anormale et est l’expression de défauts de la membrane et/ou du cytosquelette ou la conséquence de la précipitation, de la cristallisation ou de la polymérisation de l’hémoglobine. Il existe des variantes de formes avérées très diverses selon la pathologie sous-jacente qui ne sont pas traitées ici de manière exhaustive (Tab.1). Une évaluation au microscope minutieuse de la formule érythrocytaire est particulièrement utile pour le diagnostic différentiel des anémies hémolytiques (Fig. 2). Ainsi, la mise en évidence de schizocytes peut fournir des indices importants suggérant une anémie hémolytique microangiopathique (purpura thrombotique thrombocytopénique ou syndrome hémolytique et urémique). En présence d’anémie hémolytique auto-immune, on trouve des microsphérocytes qui résultent d’une perte de matériel membranaire due à la phagocytose. En cas de membranopathies congénitales (sphérocytose héréditaire, elliptocytose héréditaire), les sphérocytes ou les elliptocytes sont dus à des mutations dans les protéines membranaires qui entraînent une altération de la déformabilité des érythrocytes et une augmentation de leur dégradation dans la rate. En cas de suspicion de thalassémie ou d’hémoglobinopathie, la mise en évidence, p.ex. de cellules cibles ou de cellules falciformes, peut être un élément diagnostic, bien que des examens complémentaires par électrophorèse de l’hémoglobine (CLHP) ou par génétique moléculaire soient, dans ce cas, nécessaires pour confirmer le diagnostic.
Fig. 2: Diagnostic différentiel de l’anémie hémolytique. À gauche: purpura thrombotique thrombocytopénique (PTT) avec plusieurs schizocytes. Au milieu: anémie hémolytique auto-immune à anticorps chauds associée à de nombreux microsphérocytes, une polychromasie et un érythroblaste. À droite: anémie hémolytique auto-immune à anticorps froids associée à une agglutination des érythrocytes
Inclusions érythrocytaires
Les inclusions érythrocytaires sont généralement la conséquence d’une altération de la maturation des érythrocytes, d’une lésion oxydative des cellules ou d’infections. Les corps de Howell-Jolly sont des résidus nucléaires qui apparaissent chez les patients après une splénectomie et en cas d’asplénie anatomique ou fonctionnelle. Les ponctuations basophiles, à savoir des fragments d’ARN dénaturés dispersés dans le cytoplasme, sont associées à des hémoglobinopathies (thalassémies), à des intoxications au plomb ou à l’arsenic et à une érythropoïèse accrue ou une dysérythropoïèse. Des granules sidérotiques ou des corps de Pappenheimer sont observés en cas de troubles de l’utilisation du fer, tels que les anémies sidéroblastiques, et doivent être confirmés par coloration du fer. Les causes infectieuses sont des parasites intracellulaires tels que les plasmodiums ou les babesias. Certaines inclusions érythrocytaires ne peuvent être détectées que par coloration supravitale (coloration des réticulocytes), notamment les corps de Heinz (hémoglobine dénaturée en cas de lésions oxydatives, déficit en G6PD) ou les inclusions d’hémoglobine H.
Disposition des érythrocytes
Enfin, la disposition des érythrocytes peut également donner des indices suggérant une maladie sous-jacente – la formation de rouleaux peut indiquer une paraprotéinémie/dyscrasie des plasmocytes, une agglutination des érythrocytes est typiquement observée en présence de maladie des agglutinines froides.
Évaluation de la formule leucocytaire
La différenciation des leucocytes comprend la classification sur la base de la taille, de la forme du noyau, du modèle de chromatine, mais aussi de l’aspect et du contenu cytoplasmiques. L’analyseur d’hématologie moderne fournit dans la grande majorité des cas une numération leucocytaire précise et une différenciation correcte des 5 principaux types de cellules: lymphocytes, monocytes, neutrophiles, éosinophiles et granulocytes basophiles. En présence de populations leucocytaires pathologiques, le comptage ou la différenciation automatique peuvent toutefois être erronés; dans ces cas, l’appareil affiche souvent un message d’avertissement («flag»). Un exemple typique est p.ex. celui des cellules ciliées en présence de leucémie à tricholeucocytes, qui peuvent être comptabilisées parmi les monocytes.
Précurseurs leucocytaires
Les neutrophiles matures ont un noyau segmenté comportant 2 à 5 lobes qui sont reliés par un mince filament nucléaire. Les formes moins matures comprennent, dans l’ordre, les neutrophiles à noyau en bâtonnet, les métamyélocytes, les myélocytes, les promyélocytes et les myéloblastes. La présence de granulocytes immatures ou de précurseurs myéloïdes dans le sang périphérique est indiquée et parfois même quantifiée par certains analyseurs, mais sans distinction des différents stades de maturation. Ce déplacement vers la gauche est considéré comme réactif dans le cadre d’infections graves ou après l’administration de G-CSF («granulocyte-colony stimulating factor») ou pathologique, p.ex. dans le cas de la leucémie myéloïde chronique, le grand nombre de précurseurs myéloïdes et une éosinophilie/basophilie généralement concomitante plaidant en faveur de cette dernière. Une détection de blastes dans le sang périphérique sans signe de déplacement vers la gauche fait suspecter soit un syndrome myélodysplasique associé à une prolifération de blastes soit une leucémie aiguë. La présence de bâtonnets d’Auer est la preuve d’une néoplasie myéloïde.
Granulocytes neutrophiles
Les granulocytes neutrophiles sont évalués en fonction de leur configuration nucléaire (segmentation) et de la nature de leur cytoplasme, en particulier de leur granulation. Sont considérées comme des altérations toxiques, la granulation grossière, la vacuolisation cytoplasmique et la mise en évidence d’inclusions bleu pâle, les corps de Döhle. L’hyposegmentation (souvent sous forme de cellules pseudo-Pelger) ou l’hypersegmentation des noyaux des neutrophiles, mais aussi l’hypogranularité sont considérées comme des dysplasies et sont observées p.ex. en présence d’un syndrome myélodysplasique, l’hypersegmentation étant relativement typique en cas d’anémie mégaloblastique (carence en vitamine B12).
Lymphocytes
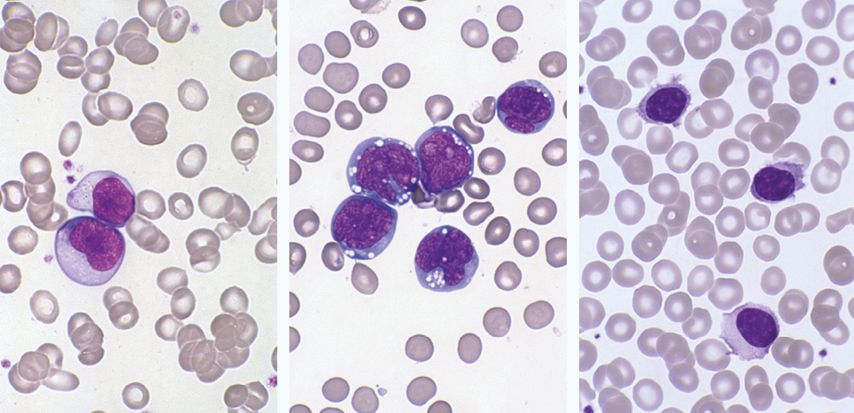
La terminologie des lymphocytes n’est pas réglementée de manière uniforme et prête parfois à confusion, étant donné que de nombreux termes différents sont utilisés, p.ex. lymphocytes variants, réactifs, anormaux, activés et atypiques. Plusieurs sociétés spécialisées ont émis des recommandations sur la classification des lymphocytes, comme l’European LeukemiaNet (ELN) ou le groupe de travail Laboratoire de la Société allemande d’hématologie et d’oncologie médicale (DGHO). Ce groupe de travail distingue les lymphocytes typiques des lymphocytes atypiques, ces derniers étant à leur tour subdivisés en «lymphocytes atypiques probablement réactifs» et en «lymphocytes atypiques probablement néoplasiques». Un groupe de travail de plusieurs grands laboratoires de Suisse alémanique s’est également penché sur cette thématique et a adopté la plupart des recommandations de la DGHO (présentées lors du congrès Swiss MedLab 2016). Les lymphocytes de grande taille comportant des granules cytoplasmiques, appelés LGL («large granular lymphocytes»), sont comptabilisés parmi les lymphocytes typiques et correspondent aux lymphocytes T cytotoxiques ou aux cellules NK; ils représentent normalement moins de 10% des lymphocytes. Dans le cadre d’infections (généralement) virales, on observe des lymphocytes réactifs, dont la morphologie diffère de celle des lymphocytes typiques. Par ailleurs, il existe des maladies lymphoprolifératives malignes très diverses affectant les lymphocytes B et T ou les cellules tueuses naturelles (cellules NK) caractérisées par la prolifération leucémique de cellules lymphatiques morphologiquement atypiques, associée ou non à une lymphocytose (Fig. 3), une immunophénotypisation ou des examens histologiques étant nécessaires pour confirmer définitivement le diagnostic. Les cellules lymphatiques anormales qui peuvent être classifiées comme un certain type de cellules néoplasiques, p.ex. les cellules ciliées ou les cellules de Sézary, doivent être décrites comme telles. Les ombres nucléaires ou les cellules lésées qui apparaissent lors de la préparation du frottis peuvent être visibles aussi bien en cas d’infections qu’en présence de lymphomes (souvent en grand nombre dans le cas de la leucémie lymphoïde chronique); le terme «ombres de Gumprecht» n’est utilisé qu’en cas de LLC confirmée.
Fig. 3: Lymphocytes atypiques. À gauche: lymphocytes réactifs fortement altérés en cas de mononucléose infectieuse (EBV). Au milieu: lymphome de Burkitt, lymphocytes de grande taille à cytoplasme profondément basophile et vacuolisation grossière. À droite: lymphocytes comportant des extensions cytoplasmiques villositaires en présence de lymphome splénique de la zone marginale
Évaluation des thrombocytes
Les thrombocytes sont de petits «éléments cellulaires» sans noyau qui, à l’état inactif, ont une forme discoïde et un diamètre d’environ 1 à 3µm; le cytoplasme présente de fines granules azurophiles. Le nombre de thrombocytes et la présence de thrombocytes de petite taille, de grande taille et/ou géants (définition de thrombocyte géant: de plus grande taille qu’un érythrocyte) sont commentés sur le frottis sanguin, de même que la présence de thrombocytes hypogranulaires. Les thrombocytes de grande taille ou géants sont observés en présence des (très rares) thrombocytopénies/thrombopathies congénitales ou, le plus souvent, en cas de thrombocytose associée des néoplasies myéloprolifératives. En cas de pseudo-thrombocytopénie (le plus souvent en cas d’utilisation d’EDTA comme anticoagulant, plus rarement avec le citrate ou l’héparine), on observe sur le frottis sanguin des agrégats de thrombocytes ou plus rarement une adhérence des thrombocytes aux granulocytes ou aux monocytes (satellitisme).
Littérature:
● Bain B: N Engl J Med 2005; 353: 498-507 ● Baurmann H: J Lab Med 2011; 35: 261-70 ● Chabot-Richards DS et al.: Int J Lab Hem 2017; 39 (Suppl. 1): 23-30 ● Gulati G et al.: Ann Lab Med 2013; 33: 1-7 ● Jones KW: Evaluation of cell morphology and introduction to platelet and white blood cell morphology. In: Harmening D (ed.). Clinical hematology and fundamentals of hemostasis. Philadelphia: F.A. Davis Co., 2009. 93-116 ● Palmer L et al.: Int J Lab Hem 2015; 37: 287-303 ● Swiss MedLab: Workshop «Lymphozytenmorphologie» du 16.06.2016. www.sulm.ch/PDF/SML/Donnerstag_16-06-2016/16-06-2016_Morphologie-WS_SwissMedLab2016.pdf ● Zini G et al.: Br J Haematol 2010; 151: 359-64
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...