Checkpoint-Inhibitoren: Bei wem, wie lange und was kommt danach?
Autor:innen:
Dr. med. Lorenz Frehner
PD Dr. med. Sabine Schmid
Klinik für medizinische Onkologie,
Inselspital Bern
Korrespondenz:
E-Mail: lorenz.frehner@insel.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Einführung von Immuncheckpoint-Inhibitoren stellt einen Durchbruch in der Behandlung von Patient:innen mit nichtkleinzelligem Lungenkarzinom dar und hat zu einer signifikanten Verbesserung der Prognose geführt. In Abwesenheit eines direkten Vergleichs der verschiedenen zur Verfügung stehenden Therapieschemata stehen wir vor der Herausforderung, die optimale Erstlinientherapie für Patient:innen anhand von Biomarkern und klinischen Faktoren zu wählen. Zudem stellt sich vor dem Hintergrund einer zunehmenden Anzahl von Langzeitüberlebenden die Frage nach der notwendigen Dauer der Therapie sowie nach Therapiemöglichkeiten nach Progression unter Immuntherapie.
Keypoints
-
Verschiedene IO-Regime (IO/Chemo-IO/IO-IO/Chemo-IO-IO) führen im Vergleich zu alleiniger Chemotherapie zu einem verlängerten Überleben.
-
Retrospektive Daten implizieren keinen OS-Vorteil einer Fortführung einer IO-Erhaltungstherapie über die Dauer von zwei Jahren hinaus.
-
Ein Taxan+/– Anti-VEGF-Antikörper ist weiterhin der Standard in der Zweitlinientherapie.
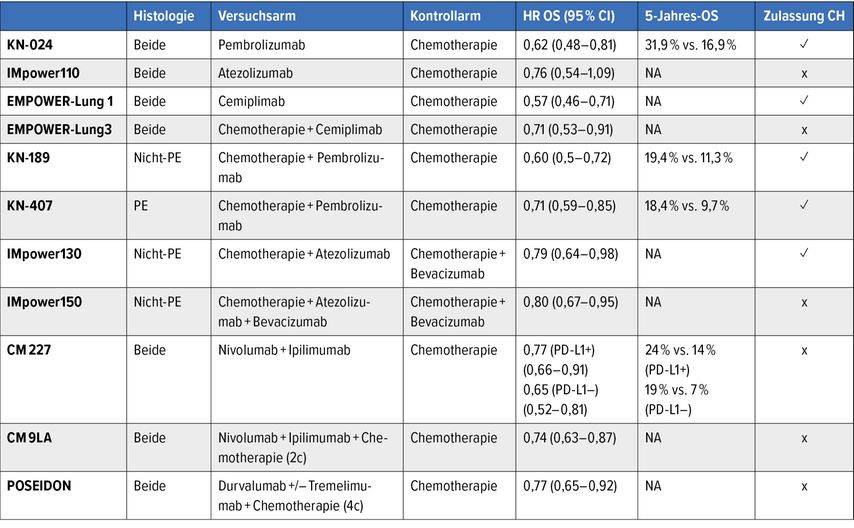
Der Einsatz von Immuncheckpoint-Inhibitoren ist Standard in der Erstlinientherapie von Patient:innen mit metastasiertem nichtkleinzelligem Lungenkarzinom (NSCLC) ohne Erstlinientherapie-relevante Treibermutationen.1 Multiple Therapieschemata zeigten sich in Phase-III-Studien einer alleinigen platinbasierten Chemotherapie in der Erstlinienbehandlung von Patient:innen mit metastasiertem NSCLC mit EGFR/ALK-Wildtyp überlegen. Eine Übersicht über die Resultate der Zulassungsstudien bietet die Tab. 1.
Studienlage und Zulassungen
Monotherapien
Für Patient:innen mit NSCLC mit hoher PD-L1-Expression (≥50%) konnte in der Studie KEYNOTE-024 ein anhaltender Überlebensvorteil mit einer Pembrolizumab-Monotherapie gegenüber einer platinbasierten Chemotherapie gezeigt werden, mit einer 5-Jahres-Überlebensrate von 31,9% vs. 16,3% (Gesamtüberleben [OS]: HR: 0,62; 95% CI: 0,48–0,81).2 Neben Pembrolizumab ist in der Schweiz Cemiplimab als Monotherapie für NSCLC mit einer hohen PD-L1-Expression zugelassen (OS: HR: 0,57; 95% CI: 0,46–0,71).3
Nie-Raucher waren von der Studie EMPOWER-Lung1 ausgeschlossen und entsprechend lautet die Limitation auf der Spezialitätenliste (keine Vergütung für Nie-Raucher). Nicht zugelassen in der Schweiz trotz positiver Phase-III-Daten ist die Monotherapie mit Atezolizumab (IMpower110: PD-L1 ≥50%; OS: HR: 0,76; 95% CI: 0,54–1,09).4
PD-1/PD-L1/Chemotherapie-Kombinationen
Die Studien KEYNOTE-189 und KEYNOTE-407 belegen einen Überlebensvorteil von Pembrolizumab in Kombination mit einer platinbasierten Chemotherapie gegenüber einer alleinigen Chemotherapie für Adeno- bzw. Plattenepithelkarzinome unabhängig von der PD-L1-Expression. Die 5-Jahres-Überlebensrate betrug 19,4% vs. 11,3% (OS: HR: 0,60; 95% CI: 0,50–0,72)5 bzw. 18,4% vs. 9,7% (OS: HR: 0,71; 95% CI: 0,59–0,83).6
Vergleichbare Resultate konnten in der Studie IMpower130 bei nicht plattenepithelial-differenzierten NSCLC für die Kombination aus Atezolizumab, Carboplatin und nab-Paclitaxel gegenüber Chemotherapie gezeigt werden (OS: HR: 0,79; 95% CI: 0,64–0,98).7 Atezolizumab und Pembrolizumab sind in der Schweiz in Kombination mit Chemotherapie für die Erstlinienbehandlung des NSCLC unabhängig von der PD-L1-Expression zugelassen.
PD-L1/CTLA-4-Kombinationstherapien
Die Studie CheckMate227 untersuchte die Kombination von Ipilimumab und Nivolumab. Im Vergleich zur Chemotherapie führte die kombinierte Immuntherapie zu einer Verlängerung des medianen Überlebens unabhängig von der PD-L1-Expression (PD-L1 ≥1%: HR: 0,77; 95% CI: 0,66–0,91, PD-L1 <1%: HR: 0,65; 95% CI: 0,52–0,81) mit einer 5-Jahres-Überlebensrate von 24% vs. 14% (PD-L1 ≥1) und 19% vs. 7% (PD-L1 <1%).8
Die Hinzunahme von zwei Zyklen Chemotherapie zur kombinierten Immuntherapie wirkte sich in der Studie CheckMate9LA im Vergleich zur alleinigen Chemotherapie positiv aus und führte zu einer 4-Jahres-Überlebensrate von 21% vs. 16% (OS: HR: 0,74; 95% CI: 0,63–0,87).9 In Abwesenheit eines direkten Vergleichs von Ipilimumab/Nivolumab und Ipilimumab/Nivolumab+Chemotherapie implizieren die Resultate im studienübergreifenden Vergleich eine ähnliche Wirksamkeit der beiden Therapiestrategien bei höherer Toxizität der Kombination aus Ipilimumab, Nivolumab und Chemotherapie.8,9 Inwieweit die zusätzliche Chemotherapie zu einer Verringerung der Anzahl an Patient:innen mit einer Frühprogression beiträgt, bleibt ebenfalls unklar.
Vergleichbare Resultate fanden sich in der mehrarmigen POSEIDON-Studie mit einem Überlebensvorteil für die Kombination aus Durvalumab und Tremelimumab mit vier Zyklen Chemotherapie gegenüber einer alleinigen Chemotherapie (mOS: HR: 0,77; 95% CI: 0,65–0,92).10 Die Kombination aus PD-1/PD-L1- und CTLA-4-gerichteter Therapie ist in der Schweiz nicht zugelassen und die Vergütung durch die Krankenkasse erfolgt im Einzelfall auf Grundlage des Artikels 71.
Prädiktive Faktoren – spezielle Patient:innengruppen
In Abwesenheit eines direkten Vergleichs der verschiedenen Therapieschemata gibt es aktuell keinen «Gewinner» und oft bestimmen Verfügbarkeit und Zulassungsstatus den Therapieentscheid. In derFolge möchten wir den Fokus auf Tumor- und Patient:innencharakteristika legen,die in die Entscheidung miteinfliessen können.
PD-L1-Expression ≥50%
Die 5-Jahres-Überlebensraten mit Chemoimmuntherapie (exemplarisch KEYNOTE-189) und Checkpoint-Inhibitor-Monotherapie bei Patient:innen mit PD-L1-hohen NSCLC (KEYNOTE-024) waren vergleichbar (29,6% vs. 31,9%).2,5
In einer gepoolten Analyse aus zwölf randomisierten Studien mit Pembrolizumab+/–Chemotherapie zeigte sich insgesamt kein signifikanter Unterschied im Gesamtüberleben zwischen den beiden Strategien, sodass für die Mehrheit der Patient:innen mit NSCLC und einer hohen PD-L1-Expression eine Checkpoint-Inhibitor-Monotherapie den Behandlungsstandard darstellt. In der Subgruppe der Nie-Raucher fand sich jedoch ein Vorteil einer Chemoimmuntherapie im Vergleich zu einer alleinigen Immuntherapie (HR: 0,39; 95% CI: 0,15–0,98).11
Ein möglicher «confounding bias» besteht in der höheren Prävalenz von Treibermutationen in der Patient:innengruppe der Nie-Raucher, die mit einem schlechteren Ansprechen auf eine Immuntherapie assoziiert sind.12 Auf der anderen Seite wog der potenziell zusätzliche Nutzen einer Chemotherapie deren Nebenwirkungen bei Patient:innen ≥75 Jahre nicht auf und implizierte im Vergleich zu einer alleinigen Immuntherapie ein verkürztes Überleben (HR: 1,68; 95% CI: 0,69–4,06).11
PD-L1-Expression <1%
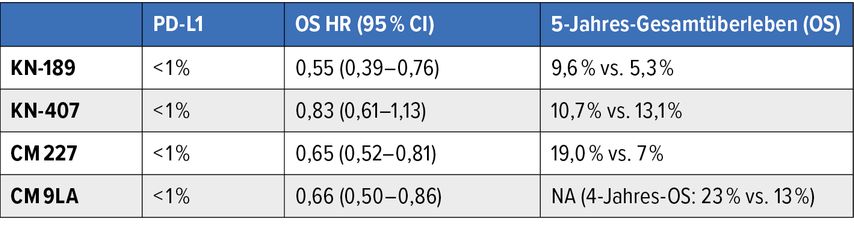
Die Langzeitdaten der beiden Chemoimmun-Kombinationsstudien mit Pembrolizumab (KEYNOTE-189 und KEYNOTE-407) zeigen eine deutliche Korrelation des Benefits dieser Therapien in Abhängigkeit vom PD-L1-Status. Bei Patient:innen mit einer PD-L1-Expression ≥50% liegt der prozentuale Anteil der Patient:innen ohne Progression nach fünf Jahren bei 12,8% und 15% mit einer korrespondierenden 5-Jahres-Überlebensrate von 29,6% und 23,3%.5,6 Im Gegensatz dazu lagen das progressionsfreie Überleben (PFS) über fünf Jahre sowie das 5-Jahres-OS bei Patient:innen mit einer PD-L1-Expression <1% exemplarisch in der KEYNOTE-189-Studie bei 2,4% und 9,6%.5
Konträr hierzu findet sich auch im langfristigen Verlauf sowohl der Studie CheckMate227 als auch der Studie CheckMate9LA kaum eine Abhängigkeit des Therapieeffekts der kombinierten PD-1/CTLA-4-Blockade von der PD-L1-Expression.8,9 Insbesondere Patient:innen mit PD-L1-negativem NSCLC profitierten in den Studien in ähnlichem Ausmass von einer kombinierten Immuntherapie wie Patient:innen mit PD-L1-exprimierenden NSCLC (Tab. 2).
Aufgrund der verschiedenen Designs der Zulassungsstudien, unterschiedlichen Testmethoden zur Bestimmung des PD-L1- Status und unterschiedlichen Cut-offs zur Stratifizierung ergibt sich hieraus keine klare Therapieempfehlung (dies auch bei in der Schweiz fehlender Swissmedic-Zulassung für diese Kombinationstherapien). Bei fehlenden Kontraindikationen ist bei PD-L1-negativen NSCLC eine kombinierte Immuntherapie als Erstlinientherapie auch bei fehlender Zulassung in Hinblick auf die positiven Langzeitüberlebensdaten in Betracht zu ziehen.1,13
ECOG PS ≥2
Patient:innen mit einem ECOG PS ≥2 bilden eine Subgruppe mit schlechter Prognose und waren von den oben zitierten Zulassungsstudien ausgeschlossen. Somit gibt es letztendlich keine randomisierte Evidenz bezüglich des Einsatzes von Immuncheckpoint-Kombinationstherapien bei diesen Patient:innen.
Die einzige randomisierte Phase-III-Studie, die unter anderem explizit Patient:innen mit einem ECOG PS ≥2 eingeschlossen hat, war die letztes Jahr publizierte IPSOS-Studie. In dieser Studie wurden Patient:innen mit einem ECOG PS ≥2 sowie Patient:innen mit einem ECOG PS 1, die nicht für eine platinhaltige Kombinationschemotherapie qualifizierten, randomisiert mit Atezolizumab oder einer Monochemotherapie (Gemcitabin oder Vinorelbin) behandelt.
Atezolizumab führte in dieser Patient:innengruppe zu einer statistisch signifikanten, aber numerisch insgesamt diskreten Verlängerung des mittleren Überlebens (mOS: 10,3 vs. 9,2 Monate; HR: 0,78; 95% CI: 0,63–0,97).14 Ein Kritikpunkt an der Studie war insbesondere der für eine Vielzahl an Patient:innen als inadäquat eingestufte Kontrollarm, da gute Daten den Einsatz einer platinbasierten Kombinationschemotherapie (ohne Immuntherapie) bei Patient:innen mit einem ECOG PS von 2 belegen.15,16
Bezüglich des Einsatzes von PD-1/CTLA-4-gerichteten Kombinationstherapien gibt es prospektive, nichtrandomisierte Evidenz. In der Phase-IIIb-MultikohortenStudie CheckMate817 wurden in der Kohorte A1 Patient:innen mit einem ECOG PS 2 mit Ipilimumab und Nivolumab behandelt, mit einem medianen Überleben von neun Monaten und einer 3-Jahres-Überlebensrate von 18,7%.17
Konträre Resultate hierzu zeigten sich in der Studie eNErgy, die den Einsatz von Ipilimumab und Nivolumab vs. eine platinhaltige Chemotherapie bei älteren Patient:innen (≥70 Jahre) sowie bei Patient:innen mit einem ECOG PS von 2 untersuchte. In der geplanten Interimsanalyse für «futility» zeigte sich in den Subgruppen der Patient:innen mit einem ECOG PS von 2 ein kürzeres Überleben unter kombinierter Immuntherapie verglichen zur platinbasierten Chemotherapie (mOS: 2,9 vs. 6,1 Monate; p=0,22), was schliesslich zum frühzeitigen Studienabbruch führte.18
Die ESMO-Guidelines empfehlen für Patient:innen mit einem ECOG PS ≥2 und einem PD-L1 <50% die Durchführung einer platinhaltigen Kombinationschemotherapie oder einer Mono-Chemotherapie. Für Patient:innen mit einer PD-L1-Expression ≥50% kann eine Checkpoint-Inhibitor-Monotherapie erfolgen, analog zu den Studien für Patient:innen mit einem ECOG PS 0–1.1 Im klinischen Alltag erfolgt häufig trotz Absenz diesbezüglicher Daten auch bei Patient:innen mit einem PS von 2 der Einsatz einer kombinierten Chemo-Immuntherapie.
Hirnmetastasen
Patient:innen mit Hirnmetastasen waren von den obigen Zulassungsstudien entweder ausgeschlossen oder die Hirnmetastasen mussten asymptomatisch und zumeist vorbehandelt sein.2–10 Aufgrund der knappen Datenlage kann für dieses Patient:innenkollektiv keine Therapieempfehlung erfolgen.
Das in gepoolten Analysen bzw. Subgruppen ausgewiesene mediane Überleben unter Pembrolizumab+/–Chemotherapie bzw. Ipilimumab+Nivolumab+/–Chemotherapie betrug zwischen 17,4 und 19,7 Monaten und war dem Ergebnis bei einer alleinigen Chemotherapie deutlich überlegen.19–22 In einer 2023 publizierten Metaanalyse konnte kein klarer Benefit für ein bestimmtes Kombinationsregime in dieser Patient:innenpopulation identifiziert werden.23
Unklar ist ebenfalls, ob asymptomatische Hirnmetastasen «upfront» bestrahlt werden müssen. In der Phase-II-Studie Atezo-Brain führte der Einsatz von Atezolizumab und Chemotherapie bei Patient:innen mit NSCLC mit unbehandelten asymptomatischen Hirnmetastasen zu einem Ansprechen im ZNS bei 43% der Patient:innen und einem medianen zentralen PFS von 6,9 Monaten.24 Diese Daten unterstützen bei selektionierten Patient:innen mit asymptomatischen zerebralen Metastasen eine initiale alleinige Systemtherapie unter Durchführung engmaschiger bildgebender Kontrollen. Die Therapiestrategie bei diesen Patient:innen sollte unbedingt in einem interdisziplinären Tumorboard festgelegt werden.
Dauer der Therapie
Mit Ausnahme von Atezolizumab in den IMpower-Studien (Erhaltungstherapie mit Atezolizumab zeitlich nicht limitiert) erfolgte die Therapie mit Checkpoint-Inhibitoren in den Zulassungsstudien bis zur Progression oder Beendigung einer zweijährigen Erhaltungstherapie. 5-Jahres-Updates (KEYNOTE-024, KEYNOTE-189, KEYNOTE-407, CheckMate227) belegen, dass ca. 50% der Patient:innen nach komplettierter zweijähriger Therapie im Verlauf eine Progression erleiden.2,5,6,8
Eine retrospektive Studie, die das Outcome von Patient:innen, bei denen die Immuntherapie über die Dauer von zwei Jahren fortgesetzt wurde, mit dem Outcome von Patient:innen, bei denen die Therapie planmässig nach zwei Jahren beendet wurde, verglich, konnte keinen Überlebensvorteil für eine fortgeführte Therapie aufzeigen.25
Hingegen führte der Abbruch der Therapie mit Nivolumab (mind. eine Vortherapie) nach einem Jahr in der Studie CheckMate153 im Vergleich zu einer zeitlich unbegrenzten Erhaltungstherapie zu einer deutlichen Verschlechterung des progressionsfreien Überlebens (24,7 vs. 9,4 Monate; HR: 0,56; 95% CI: 0,37–0,84) sowie des Gesamtüberlebens («not reached» vs. 32,5 Monate; HR: 0,61; 95% CI: 0,37–0,99).26
In der Studie DICIPLE wurden Patient:innen, die nach 6-monatiger Therapie mit Ipilimumab und Nivolumab eine stabile Erkrankungssituation aufwiesen, randomisiert weiterbehandelt oder die Therapie wurde beendet und bei einer Progression wiederaufgenommen («stop and go»). Die Studie zeigte vielversprechende erste Resultate ohne Zeichen einer Unterlegenheit der «Stop and go»-Strategie. Aufgrund der fehlenden Zulassung für die Kombinationstherapie in Europa wurde die Studie vom Sponsor frühzeitig beendet.27
Die DIAL-Studie untersucht aktuell eine «Stop and go»-Strategie für den Einsatz von Pembrolizumab und Pemetrexed für Patient:innen mit dokumentierter Krankheitskontrolle nach sechsmonatiger Therapie (NCT05255302).
Therapie nach Progression
Bei Fehlen einer therapeutisch angehbaren Treibermutation in der zweiten Therapielinie (KRASG12C, Exon-20-Insertionsmutation, HER-2) besteht die Standardtherapie in der Zweitlinie nach Progression nach einer platinhaltigen Chemoimmuntherapie weiterhin in der Durchführung einer Chemotherapie mit einem Taxan+/– VEGF-Inhibitor.1,28
Im Falle einer vorangegangenen guten Wirksamkeit kann auch eine Reexposition mit einer platinhaltigen Chemotherapie erwogen werden. Für Patient:innen, die nach Abschluss einer zweijährigen Immunerhaltungstherapie einen Progress erleiden, belegen retrospektive Daten eine Antitumoraktivität einer Rechallengemit Immuntherapie und erlauben, dies somit ebenfalls als therapeutische Option zu evaluieren.29
Zahlreiche Onkologika befinden sich aktuell in Testung für den Einsatz nach Progression unter Immuntherapie, insbesondere diverse Antikörper-Wirkstoff-Konjugate (ADC). Datopotamab-Deruxtecan war Docetaxel bei Einsatz nach Progression unter vorangegangener platinhaltiger Chemo-Immuntherapie (sowie zusätzlich einer zielgerichteten Therapie bei Vorliegen einer Treibermutation) in der Studie TROPION-Lung01 leicht überlegen mit einem PFS von 4,4 Monaten vs. 3,7 Monate (HR: 0,62; 95% CI: 0,62–0,91). Der Unterschied beruht primär auf der besseren Wirksamkeit bei nicht plattenepithelialdifferenzierten Tumoren (PFS: 5,6 vs. 3,7 Monate; HR: 0,63; 95% CI: 0,51–0,78).30
Gemäss kürzlich erschienenen Pressemitteilungen fielen die Phase-III-Studien EVOKE-01 zum Einsatz von Sacituzumab-Govitecan vs. Docetaxel in der zweiten Therapielinie (primärer Endpunkt: OS) sowie CARMEN-LC03 zum Einsatz von Tusamitamab Ravtansine negativ aus (primärer Endpunkt: PFS).31,32
Neben ADC werden auch diverse neuere Immunkombinationen in aktuell noch frühen Phase-I/II-Studien untersucht.33
Literatur:
1 Hendriks LE et al.: Non-oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(4): 358-76 2 Reck M et al.: Five-year outcomes with pembrolizumab vs. chemotherapy for metastatic non-small-cell lung cancer with PD-L1 tumor proportion score ≥ 50. J Clin Oncol 2021; 39(21): 2339-49 3 Özgüroğlu M et al.: First-line cemiplimab monotherapy and continued cemiplimab beyond progression plus chemotherapy for advanced non-small-cell lung cancer with PD-L1 50% or more (EMPOWER-Lung 1): 35-month follow-up from a mutlicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2023; 24(9): 989-10014 Jassem J et al.: Updated overall survival analysis from IMpower110: atezolizumab vs. platinum-based chemotherapy in treatment-naive programmed death-ligand 1-selected NSCLC. J Thorac Oncol 2021; 16(11): 1872-82 5 Garassino MC et al.: Pembrolizumab plus pemetrexed and platinum in nonsquamous non-small-cell lung cancer: 5-year outcomes from the phase 3 KEYNOTE-189 study. J Clin Oncol 2023; 41(11): 1992-8 6 Novello S et al.: Pembrolizumab plus chemotherapy in squamous non-small-cell lung cancer: 5-year update of the phase III KEYNOTE-407 study. JClin Oncol 2023; 41(11): 1999-2006 7 West H et al.: Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpower130): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; 20(7): 924-37 8 Brahmer JR et al.: Five-year survival outcomes with nivolumab plus ipilimumab vs. chemotherapy as first-line treatment for metastatic non-small-cell lung cancer in CheckMate 227. J Clin Oncol 2023; 41(6): 1200-12 9 Carbone DP et al.: First-line (1L) nivolumab (N) + ipilimumab (I) + chemotherapy (C) vs C alone in patients (pts) with metastatic NSCLC (mNSCLC) from CheckMate 9LA: 4-y clinical update and outcomes by tumor histologic subtype (THS). J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA9023 10 Johnson ML et al.: Durvalumab with or without tremelimumab in combination with chemotherapy as first-line therapy for metastatic non-small-cell lung cancer: the phase III POSEIDON study. J Clin Oncol 2023; 41(6): 1213-27 11 Akinboro O et al.: Outcomes of anti–PD-(L)1 therapy with or without chemotherapy (chemo) for first-line (1L) treatment of advanced non–small cell lung cancer (NSCLC) with PD-L1 score ≥ 50%: FDA pooled analysis. J Clin Oncol 2022; 40(Suppl. 16): 9000 12 De Alencar V et al.: Lung cancer in never smokers: tumor immunology and challenges for immunotherapy. Front Immunol 2022; 24(13): 984349 13 Gridelli C et al.: Face to face among different chemo-immunotherapy combinations in the first line treatment of patients with advanced non-small cell lung cancer: results of an international expert panel meeting by the italian association of thoracic oncology (AIOT). Lung Cancer 2024; 187: 107441 14 Lee SM et al.: First-line atezolizumab monotherapy vs. single-agent chemotherapy in patients with non-small-cell lung cancer ineligible for treatment with a platinum-containing regimen (IPSOS): a phase 3, global, multicentre, open-label. Lancet 2023; 402(10400): 451-63 15 Zukin M et al.: Randomized phase III trial of single-agent pemetrexed vs. carboplatin and pemetrexed in patients with advanced non-small-cell lung cancer and Eastern Cooperative Oncology Group performance status of 2. J Clin Oncol 2013; 31(23): 2849-53 16 Quoix E et al.: Carboplatin and weekly paclitaxel doublet chemotherapy compared with monotherapy in elderly patients with advanced non-small-cell lung cancer: IFCT-0501 randomised, phase 3 trial. Lancet 2011; 378(9796): 1079-88 17 Ready NE et al.: First-line nivolumab plus ipilimumab for metastatic non-small cell lung cancer, including patients with ECOG performance status 2 and other special populations: CheckMate 817. J Immunother Cancer 2023; 11(2): e006127 18 Lena H et al.: Randomized phase III study of nivolumab and ipilimumab vs. carboplatin-based doublet in first-line treatment of PS 2 or elderly (≥ 70 years) patients with advanced non–small cell lung cancer (Energy-GFPC 06-2015 study). J Clin Oncol 2022; 40(Suppl. 16): 9011 19 Powell SF et al.: Outcomes with pembrolizumab plus platinum-based chemotherapy for patients with NSCLC and stable brain metastases: pooled analysis of KEYNOTE-021, -189, and -407. JThorac Oncol 2021; 16(11): 1883-92 20 Mansfield AS et al.: Outcomes with pembrolizumab monotherapy in patients with programmed death-ligand 1-positive NSCLC with brain metastases: pooled analysis of KEYNOTE-001, 010, 024, and 042. JTO Clin Res Rep 2021; 2(8): 100205 21 Reck M et al.: Systemic and intracranial outcomes with first-line nivolumab plus ipilimumab in patients with metastatic non-small cell lung cancer and baseline brain metastases from CheckMate 227 Part 1. J Thorac Oncol 2023; 18(8): 1055-69 22 Paz-Ares LG et al.: First-line nivolumab plus ipilimumab with chemotherapy vs. chemotherapy alone for metastatic NSCLC in CheckMate 9LA: 3-year clinical update and outcomes in patients with brain metastases or select somatic mutations. J Thorac Oncol 2023; 18(2): 204-22 23 Yu S et al.: Organ-specific immune checkpoint inhibitor treatment in lung cancer: a systematic review and meta-analysis. BMJ Open 2023; 13(3): e059457 24 Nadal E et al.: Phase II trial of atezolizumab combined with carboplatin and pemetrexed for patients with advanced nonsquamous non–small-cell lung cancer with untreated brain metastases (Atezo-Brain, GECP17/05). J Clin Oncol 2023; 41(28): 4478-85 25 Sun L et al.: Association between duration of immunotherapy and overall survival in advanced non-small cell lung cancer. JAMA Oncol 2023; 9(8): 1075-82 26 Waterhouse DM et al.: Continuous vs. 1-year fixed-duration nivolumab in previously treated advanced non-small-cell lung cancer: CheckMate 153. J Clin Oncol 2020; 38(33): 3863-73 27 Zalcman G et al.: 972O – Nivolumab (Nivo) plus ipilimumab (Ipi) 6-months treatment vs. continuation in patients with advanced non-small cell lung cancer (aNSCLC): results of the randomized IFCT-1701 phase III trial. Ann Oncol 2022; 33(Suppl. 7): S448-554 28 Cortot AB et al.: Weekly paclitaxel plus bevacizumab vs. docetaxel as second- or third-line treatment in advanced non-squamous non-small-cell lung cancer: results of the IFCT-1103 ULTIMATE study. Eur J Cancer 2020; 131: 27-36 29 Rodriguez-Abreu D et al.: Pooled analysis of outcomes with second-course pembrolizumab across 5 phase 3 studies of non-small-cell lung cancer. J Thorac Oncol 2022; 17(9): S42-43 30 Lisberg A et al.: LBA12 – Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): results of the randomized phase III study TROPION-Lung01. Ann Oncol 2023; 34(Suppl. 2): S1254-335 31 Gilead provides update on phase 3 EVOKE-01 study. Online unter https://www.gilead.com/news-and-press/press-room/press-releases/2024/1/gilead-provides-update-on-phase-3-evoke01-study . Abgerufen am 21.2.2024 32 Sanofi announces end of program evaluating tusamitamab ravtansine after a 2L NSCLC Phase 3 trial did not meet a primary endpoint. Online unter https://www.sanofi.com/en/media-room/press-releases/2023/2023-12-21-06-30-00-2799759. Abgerufen am 21.2.2024 33 Desai A et al.: Immunotherapy-based combinations in metastatic NSCLC. Cancer Treat Rev 2023; 116: 102545
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...