Développement d’un support de cybersanté pour le changement de comportement
Auteur·es:
Dre méd. Janette Ribaut, Ph.D.1
Dre méd. Sabine Valenta, Ph.D.1,2
Dre méd. Lynn Leppla, Ph.D.1,3
Prof. Dre Ing. Alexandra Teynor4
Prof. Dre méd. Sabina De Geest, Ph.D.1,5
1Pflegewissenschaft, Department Public Health, Universität Basel, Schweiz
2Abteilung Praxisentwicklung und Forschung, Medizinische Direktion, Universitätsspital Basel, Schweiz
3Department für Hämatologie, Onkologie und Stammzelltransplantation, Klinik für Innere Medizin, Universitätsklinikum Freiburg, Deutschland
4Fakultät für Informatik, Hochschule Augsburg, Deutschland
5Academic Centre for Nursing and Midwifery, Department of Public Health and Primary Care, KU Leuven, Belgien
Correspondance:
E-mail: janette.ribaut@unibas.ch
Le manque d’observance du traitement médicamenteux concerne 30 à 50% des patient·es, avec des risques particulièrement élevés après une allogreffe de cellules souches. Des modèles de soins innovants, incluant également des mesures visant à modifier le comportement, peuvent aider les personnes touchées à améliorer leur observance. Cet article décrit précisément comment de telles interventions visant à changer les comportements peuvent être développées pour favoriser l’observance médicamenteuse à l’aide de la roue du changement de comportement (RCC).
Keypoints
-
La non-observance médicamenteuse concerne environ 50% des personnes atteintes de maladies chroniques et est influencée par différents facteurs, comme les coûts pour les patient·es ou le manque de soutien. Cette situation a des répercussions à tous les niveaux du système de santé et se traduit par une diminution de l’efficacité et de la qualité de vie, des décès prématurés et des coûts de santé élevés.
-
L’observance médicamenteuse peut être favorisée par des modèles de soins intégrés, éventuellement soutenus par les technologies de cybersanté. Ces modèles devraient inclure des interventions multiniveaux et des mesures de modification du comportement.
-
En utilisant la roue du changement de comportement, qui sert de guide pour le développement d’interventions visant à modifier le comportement, de telles interventions multiniveaux visant à modifier le comportement peuvent être développées progressivement en tenant compte du contexte, des données probantes et du retour des personnes touchées. Qui plus est, la prise en compte de réglementations de niveau plus global favorise une mise en œuvre réussie et à long terme.
L’observance du traitement médicamenteux: un comportement de santé complexe
L’observance médicamenteuse, définie comme «le processus par lequel les patient·es prennent leurs médicaments comme prescrit», est un comportement de santé complexe,1 qui est divisé en trois phases:
-
Début du traitement: utilisation de la première dose prescrite,
-
Mise en œuvre du traitement: conformité de l’utilisation réelle des médicaments avec l’ordonnance,
-
Arrêt du traitement: Fin du traitement. La persistance est le temps écoulé entre la première et la dernière dose.1,2
Bien que les trois quarts des personnes atteintes de maladies chroniques commencent leur traitement comme prescrit, 30 à 50% ne le font pas correctement. De plus, plus de 50% d’entre elles abandonnent le traitement dans un délai de deux ans.3 En Europe, la non-observance du traitement médicamenteux entraîne chaque année 200000décès prématurés,3 une perte d’efficacité,4 une qualité de vie inférieure4 et des coûts de santé évitables de plus de 125milliards d’euros.3
Cette non-observance médicamenteuse, qu’elle soit intentionnelle (p.ex. arrêt du traitement en raison d’effets secondaires) ou non (p.ex. oubli de doses), est influencée par des facteurs à tous les niveaux du système de santé. Ainsi, des coûts à charge des patient·es plus élevés au niveau du système de santé, l’absence d’offres de soutien dans les établissements de santé ou le manque de communication avec les patient·es de la part des professionnels de la santé sont associés à une moins bonne observance médicamenteuse. Au niveau du/de la patient·e, la non-observance est souvent liée à des effets secondaires ou à un manque de connaissances ou d’efficacité personnelle.3
Un modèle de soins intégrés basé sur la cybersanté pour la greffe allogénique de cellules souches: SMILe
L’observance médicamenteuse est essentielle pour les patient·es ayant subi une allogreffe de cellules souches (GCS allogénique). Afin de favoriser l’observance médicamenteuse, dans le cadre du projet SMILe ( https://smile.nursing.unibas.ch/ ), un module correspondant faisant partie d’un modèle de soins intégrés basé sur la cybersanté a été développé pour un contexte allemand,5,6 adapté à une situation en Suisse7,8 et mis en œuvre puis évalué.6,9 Outre l’observance médicamenteuse, d’autres modules ont été développés pour la surveillance des symptômes, la prévention des infections et l’activité physique.
Le modèle de soins comprend une composante technique – l’application SMILeApp pour la saisie des symptômes, des signes vitaux et de l’observance médicamenteuse avec un outil de surveillance en ligne pour les professionnels de la santé – ainsi qu’un volet humain, des «Advanced Practice Nurses» (APN, ou infirmières de pratique avancée), qui proposent des modules d’intervention sur une année, surveillent les valeurs de l’application SMILe et interviennent si nécessaire.6,8 Le développement du module d’observance médicamenteuse est décrit ci-dessous.5
Développement d’interventions visant à modifier le comportement
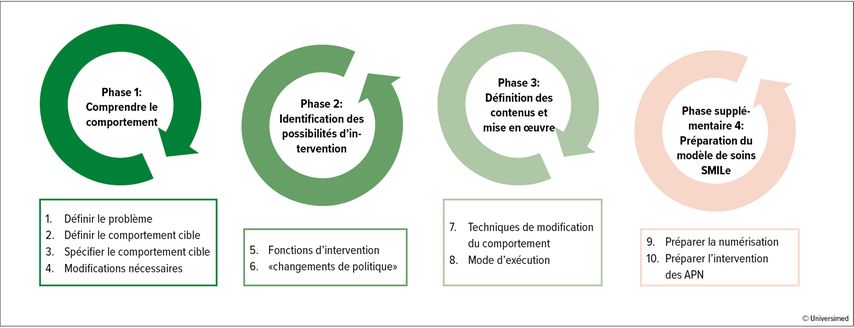
Le développement du module d’observance médicamenteuse était basé sur la roue du changement de comportement (RCC).10 La RCC est un guide utile pour le développement d’interventions visant à modifier le comportement. Elle comprend trois phases de huit étapes (Fig. 1). Les étapes ont été traitées à l’aide de données tirées de deux analyses de contexte,8,11 de données probantes scientifiques ainsi que de retours réguliers de la part des patient·es et de leurs proches. À la fin de la RCC, nous avons ajouté une quatrième phase avec deux étapes supplémentaires en appui à la numérisation et aux visites des APN.
Fig.1: Le module d’observance médicamenteuse a été développé sur la base de la roue du changement de comportement (modifié d’après Michie S etal.)10
Phase 1: comprendre le comportement
Étape1: définir le problème
Le schéma médicamenteux post-GCS allogénique, en particulier la prise d’immunosuppresseurs, est très complexe. Ces médicaments doivent être pris de manière fiable et ponctuelle afin de prévenir ou de traiter la maladie greffon contre hôte (GVH).12 C’est pourquoi nous nous sommes concentrés sur les immunosuppresseurs.
Le traitement est généralement instauré à l’hôpital et le début du traitement ne pose donc pas de problème. Par contre, de nombreuses personnes touchées ont des difficultés dans la mise en œuvre du traitement au quotidien: selon une enquête, au cours des quatre semaines précédant l’enquête, 33 à 67% des patient·es ont omis une dose, 61% ont pris la dose au mauvais moment et 4% ont modifié la dose. Les interruptions de traitement sont plus rares, elles ont été constatées chez 3% des participants.13
Étape2: définir le comportement cible
Comme nous l’avons décrit, l’observance médicamenteuse est un comportement complexe qui comporte de nombreuses composantes, notamment la prise et le moment de la prise corrects, le suivi des recommandations alimentaires ou le dosage correct. Les deux premiers aspects (la prise et le moment de la prise corrects) sont particulièrement importants pour les immunosuppresseurs, nous les avons définis comme comportement cible.
Étape3: spécifier le comportement cible
Les deux comportements cibles ont été décrits plus précisément en fonction de plusieurs composantes:
-
QUI les manifeste (adultes, patient·es ayant reçu une GCS allogénique)
-
QUE contient précisément le comportement cible (prise d’immunosuppresseurs 1–2fois/jour comme prescrit)
-
QUAND sont-ils mis en œuvre (en général à 9h et 21h, avec une variation maximale de 2heures)
-
OÙ ils sont mis en œuvre (où se trouvent les patient·es, p.ex. à domicile, à l’hôpital, au travail)
-
... et COMMENT les mettre en œuvre (avaler des comprimés avec du liquide)
Étape 4: modifications nécessaires
Les changements nécessaires pour favoriser l’observance du traitement médicamenteux ont été identifiés à l’aide du modèle pour le changement de comportement COM-B (Capability Opportunity Motivation Behaviour). Selon ce modèle, un comportement (behaviour) est influencé par la capacité (capability), l’opportunité (opportunity) et la motivation. Pour ce qui est de la capacité, les oublis, par exemple, ont une influence négative sur l’observance médicamenteuse; pour l’opportunité, il s’agit d’interruptions dans la routine ou d’un manque de soutien social, tandis que pour la motivation, ce sont des effets secondaires ou la détresse.11,14
Phase 2: identification des possibilités d’intervention
Étape5: fonctions d’intervention
Parmi les neuf fonctions d’intervention (moyens/instruments de changement de comportement) de la RCC, celles qui influencent positivement les obstacles identifiés selon le modèle COM-B ont été sélectionnées. Il s’agit notamment de l’éducation (transmission de connaissances), de la persuasion (promotion de sentiments positifs et de l’efficacité personnelle), de l’entraînement (s’exercer à la préparation des médicaments), de la modélisation (apprentissage par les pairs) et de la responsabilisation (permettre de surmonter les obstacles).
Étape6: «changements de politique»
Nous avons sélectionné des stratégies de mise en œuvre des fonctions d’intervention choisies parmi sept «policy categories» (catégories de politique). La réglementation (directives/lignes directrices locales) et la prestation de services (établissement d’un modèle de soins intégrés) étaient les plus utiles et les plus réalisables dans notre situation.
Phase 3: définition des contenus etmise en œuvre
Étape 7: techniques de modification du comportement
Les techniques de modification du comportement décrivent les composantes actives des interventions de modification du comportement. Elles peuvent être utilisées seules ou en combinaison avec d’autres techniques. Pour notre intervention, nous avons sélectionné 24techniques, par exemple le soutien social, l’acquisition d’habitudes, la modification de l’environnement, la planification d’actions ou l’élaboration de stratégies de résolution de problèmes.
Étape8: mode d’exécution
Cette étape a permis de déterminer la forme optimale de mise en œuvre pour les techniques de modification du comportement. Il a été établi que l’intervention devait être communiquée lors de visites personnelles des APN (p.ex. planification d’actions) et en partie via l’application SMILe (p.ex. autosurveillance de la prise du médicament).
Phase supplémentaire 4: préparation du modèle de soins SMILe
Étape9: Préparer la numérisation
Pour développer les fonctionnalités dans SMILeApp, des cas d’utilisateur ont été formulés: il s’agit de courtes descriptions de fonctions du point de vue de l’utilisateur·trice final·e (patient·e, APN) et servent à communiquer les exigences à l’équipe de développement du logiciel de manière compréhensible. Cela a permis, par exemple, de développer un composant d’autosurveillance pour l’application SMILeApp.
Étape10: préparer l’intervention desAPN
Un protocole d’intervention complet a été établi pour les visites personnelles des APN. Ce protocole décrit, pour chaque visite, ce qui doit être fait (quelles techniques de modification du comportement, p.ex. information et instruction, soutien social, planification d’actions) et quand (lors de quelle visite, dans quel ordre).
Mise en œuvre et évaluation
Le modèle de soins SMILe a été mis en œuvre et évalué avec tous ses modules aux hôpitaux universitaires de Fribourg et de Bâle dans le cadre d’une étude hybride randomisée et contrôlée. Pour soutenir la mise en œuvre, des stratégies spécifiques ont été appliquées, notamment une évaluation des besoins locaux, des échanges réguliers avec les intervenants, la formation de nouvelles équipes cliniques, le développement/l’adaptation de matériel éducatif et le soutien technique.
L’évaluation portait non seulement sur l’efficacité (p.ex. l’observance du traitement médicamenteux, le taux de réhospitalisation, les coûts de santé), mais aussi sur la mise en œuvre (p.ex. la faisabilité, l’acceptation). Les résultats sont en cours d’analyse et seront publiés prochainement dans une revue scientifique.
Littérature:
1 Haag M et al.: The ABC taxonomy for medication adherence translated into French and German. Br J Clin Pharm 2020; 86(4): 734-44 2 Vrijens B et al.: A new taxonomy for describing and defining adherence to medications. Br J Clin Pharm 2012; 73(5): 691-705 3 Khan R, Socha-Dietrich K: Investing in medication adherence improves health outcomes and health system efficiency: adherence to medicines for diabetes, hypertension, and hyperlipidaemia. OECD Health Working Papers 2018 4 Sabaté E: Adherence to long-term therapies: evidence for action: World Health Organization 2003 5 Ribaut J et al.: Theory-driven development of an eHealth powered intervention to support medication adherence in allogeneic stem cell transplantation as part of the SMILe implementation science project. BMC Health Serv Res 2020; 20(1): 827 6 Leppla L et al.: Development of an integrated model of care for allogeneic stem cell transplantation facilitated by eHealth—the SMILe study. Supportive Care in Cancer 2021; 29: 8045-57 7 Ribaut J et al.: Exploring stem cell transplanted patients’ perspectives on medication self-management and electronic monitoring devices measuring medication adherence: a qualitative sub-study of the Swiss SMILe implementation science project. Patient Prefer Adherence 2022; 16: 11-22 8 Valenta S et al.: Context-specific adaptation of an eHealth-facilitated, integrated care model and tailoring its implementation strategies—a mixed-methods study as a part of the SMILe implementation science project. Front Health Serv 2023; 2: 977564 9 De Geest S et al.: The SMILe integrated care model in allogeneic SteM cell TransplantatIon faciLitated by eHealth: a protocol for a hybrid effectiveness-implementation randomised controlled trial. BMC Health Serv Res 2022; 22(1): 1067 10 Michie S et al.: The behaviour change wheel: a new method for characterising and designing behaviour change interventions. Implement Sci 2011; 6(1): 42 11 Leppla L et al.: Clinicians and patients perspectives on follow-up care and eHealth support after allogeneic hematopoietic stem cell transplantation: a mixed-methods contextual analysis as part of the SMILe study. Eur J Oncol Nurs 2020; 45: 101723 12 Tomblyn M et al.: Guidelines for preventing infectious complications among hematopoietic cell transplant recipients: a global perspective. Biol Blood Marrow Transplant 2009; 44(8): 453-5 13 Kirsch M et al.: Differences in health behaviour between recipients of allogeneic haematopoietic SCT and the general population: a matched control study. Biol Blood Marrow Transplant 2014; 49(9): 1223-30 14 Rebafka A: Medication adherence after renal transplantation—a review of the literature. J Ren Care 2016; 42(4): 239-56 15 Leppla L et al.: Implementation science meets software development to create eHealth components for an integrated care model for allogeneic stem cell transplantation facilitated by eHealth: the SMILe study as an example. J Nurs Scholarsh 2021; 53(1): 35-45
Das könnte Sie auch interessieren:
La sélection est essentielle dans le traitement des tumeurs gastro-intestinales
La différenciation moléculaire au sein des entités tumorales a conduit à de nouvelles options thérapeutiques, en particulier en ce qui concerne les stratégies thérapeutiques ciblées. L’ ...
Déséquilibre du cortisol cliniquement pertinent chez les patients atteints de cirrhose
La gravité croissante de la maladie entraîne une dysfonction de l’axe hypophyso-surrénalien chez les patients atteints de cirrhose. Un faible taux de cortisol sérique est un prédicteur ...
Ostéoporose: Vue d’ensemble du diagnostic et du traitement
L’incidence des fractures de fragilité liées à l’ostéoporose en Suisse est élevée: 1 femme sur 2 et 1 homme sur 5 subissent au moins une fracture de fragilité après l’âge de 50 ans. ...