Können Biomarker bei der Diagnose helfen?
Unsere Gesprächspartner:
Dr. med. Alexander Ritter
Klinik für Nephrologie und Transplantationsmedizin, Kantonsspital St. Gallen
PD Dr. med. Harald Seeger
Chefarzt Nephrologie, Kantonsspital Baden
Das Interview führte Dr. med. Felicitas Witte
Medizinjournalistin
Die Lupusnephritis ist ein häufiger und folgenschwerer Organschadeneines systemischen Lupus erythematodes (SLE). Der Schaden der Podozyten wird als einer der essenziellen Faktoren angesehen. Biomarker im Urin, die den Schaden frühzeitig anzeigen, könnten eine neue, nichtinvasive Methode sein, um die Diagnose früh zu stellen und rechtzeitig zu intervenieren, wie Forscher aus China in einer kürzlich publizierten Übersichtsarbeit zeigen (siehe Kasten).1
Was halten Sie von Urin-Biomarkern?
A. Ritter: Ich finde es grundsätzlich richtig, nach neuen Biomarkern zu suchen, da die bisherigen Biomarker wie Proteinurie, Albuminurie, Autoantikörper und Komplementfaktoren zur Beurteilung von Krankheitsaktivität und -chronizität defizitär sind. Die Resultate der meisten in der Übersichtsarbeit vorgestellten Marker sind allerdings zum Teil sehr präliminär und aus meiner Sicht sind die Autoren zum jetzigen Zeitpunkt etwas zu euphorisch. Ein idealer Marker wäre sehr sensitiv und spezifisch, zudem würde er etwas über die Krankheitsaktivität/-chronizität und das Therapieansprechen verraten. Darüber hinaus ist er einfach zu gewinnen, stabil in der Analyse, günstig und einfach verfügbar.
H. Seeger: Vermutlich sind die meisten einzelnen Marker weit entfernt von diesen Ansprüchen, denn sie sind noch im experimentellen Stadium. Hinzu kommt, dass neue Marker sich mit dem Goldstandard der Nierenbiopsie messen müssen und in prospektiven Studien mit longitudinalem Verlauf gezeigt werden muss, dass sie der Biopsie ebenbürtig oder überlegen sind. Da sich die Pathologie in mehreren Kompartimenten und Zellen der Niere abspielt, ist es wahrscheinlich sinnvoll, verschiedene Marker zu berücksichtigen und diese kombiniert anzuwenden. Hier könnte die ReBioLup-Studie2 neue Erkenntnisse bringen. In dieser Studie werden sequenzielle Biopsien sowie Serum- und Urinproben von Patienten mit Lupusnephritis entnommen und asserviert. Anhand der Serum- und Urinsamples können alte und neue Urin- und Blutbiomarker mit histologischen und klinischen Outcomes korreliert werden.
Wie beurteilen Sie den Nutzen der podozytären Marker?
A. Ritter: Ein Problem ist, dass diese unter anderem von der Podozytenmasse abhängig sind. Weist eine Niere bereits eine relevante chronische glomeruläre Schädigung auf, kann auch die Podozytenmasse reduziert sein und es können weniger Podozytenantigene im Urin nachgewiesen werden. Das könnte bedeuten, dass trotz einer anhaltenden Podozytenschädigung weniger podozytäre Antigene in den Urin gelangen. Daraus resultiert ein niedriger Wert, der in falscher Sicherheit wiegt.
Wie unterscheidet sich die Lupus-Podozytopathie von einer «normalen» Lupusnephritis?
H. Seeger: Ein geringer Prozentsatz, also weniger als 2%, der Lupuspatienten mit nephrotischer Proteinurie hat eine Lupus-Podozytopathie, eine spezielle Form der Lupusnephritis.3 Diese wird verursacht durch eine Podozytenschädigung, charakterisiert durch eine Verschmelzung der podozytären Fussfortsätze, wie man es von der Minimal-Change-Erkrankung kennt. Hier steht nicht die Ablagerung von Immunkomplexen im Vordergrund. Als Ursachen werden Autoantikörper gegen Proteine der Schlitzmembran und eine Podozytenschädigung durch Zytokine oder T-Zellen diskutiert. Auch die Einnahme nichtsteroidaler Antiphlogistika wird mit der Podozytopathie in Verbindung gebracht.
Meinen Sie, dass Urin-Biomarker Einzug in die Routine halten werden?
A. Ritter: Urin ist einfach und nichtinvasiv zu gewinnen und per se überall verfügbar. Das Problem sind aber die zum Teil aufwendigen Analysemethoden für die Bestimmung der genannten Biomarker. Obwohl Urin eine leicht zugängliche Quelle ist, können längere Lagerzeiten, Sammelzeiten, bakterielle Kontamination und die Notwendigkeit einer Korrektur für die Verdünnung die Qualität der Urinproben einschränken und somit die Biomarkerqualität beeinflussen.
H. Seeger: Einschränkend muss man sagen, dass sich in der Nephrologie bislang nur wenige Urin-Biomarker neben Proteinurie und Albuminurie durchgesetzt haben. Auch in anderen Bereichen, etwa in der Transplantationsmedizin, wurden in diese Richtung viele erfolglose Anstrengungen unternommen. Aber neue Technologien und Analysemethoden entwickeln sich rasch, sodass hier eine berechtigte Hoffnung besteht.
A. Ritter: Ich bin der Meinung, dass Podozytenmarker eine sinnvolle Ergänzung darstellen können, insbesondere in Kombination mit Entzündungs- und Fibrosemarkern. Zudem sollten Marker für die Schädigung anderer Zellen, wie glomerulärer Endothelzellen und Zellen anderer renaler Kompartimente, erfasst werden. Podozytenmarker alleine werden vermutlich nicht den Anforderungen an einen erstklassigen Biomarker gerecht. Forschung bezüglich weiterer Biomarker erfolgt bereits; hierbei kann ich eine sehr gute Übersichtsarbeit von Brad Rovin und Kollegen empfehlen.4
Wie sieht die Zukunft der Frühdiagnose aus?
A. Ritter: Es besteht keine wirkliche Assoziation zwischen dem aktuellen histologischen Klassifikationssystem der International Society of Nephrology/Renal Pathology Society (ISN/RPS) und Genexpressionsmustern. Daher scheint die Histologie nicht gut die Heterogenität von Lupusnephritiden abzubilden. Ich denke, in Zukunft könnten molekulare Untersuchungen des Gewebes aus der Nierenbiopsie eine wichtige Rolle spielen – ergänzt durch konventionelle und neue Urin- und Serum-Biomarker.
H. Seeger: Auf dieser Basis könnte dann eine zielgerichtete Therapie erfolgen, analog zur individualisierten Therapie in der Behandlung von Tumorerkrankungen in der Onkologie.
Werden Biomarker eine Nierenbiopsie ersetzen?
A. Ritter: Nein, da eine molekulare Untersuchung des Gewebes wahrscheinlich differenzierte und gezielte Therapieansätze möglich machen wird. Geeignete Biomarker, die zuverlässig Aufschluss über Krankheitsaktivität und -chronizität beziehungsweise über die Rezidivwahrscheinlichkeit geben, stellen jedoch eine wichtige Ergänzung dar und helfen dann bei der Frühdiagnose und der Therapiesteuerung. Bis dahin wird es allerdings noch einen grossen Forschungsaufwand benötigen. Möglicherweise können wir mit den Biomarkern Verlaufsbiopsien vermeiden.
Werden wir mithilfe von zielgerichteten Medikamenten den Podozytenschaden beheben und damit eine Lupusnephritis heilen können?
H. Seeger: Die Schädigung ist nicht auf die Podozyten begrenzt, sondern betrifft auch Mesangium, Endothelzellen und Basalmembran. Die Podozyten werden meist sekundär geschädigt. Einzig bei der Lupus-Podozytopathie wäre ein solcher Ansatz sinnvoll. Diese bekommt man aber meist mit Steroiden und/oder Calcineurin-Inhibitoren sowie der Therapie der Grunderkrankung – etwa mit Hydroxychloroquin und gegebenenfalls Mycophenolat – gut in den Griff. Eine Podozytentherapie sehe ich vor allem als komplementäre Therapie im Rahmen einer multimodalen Strategie.
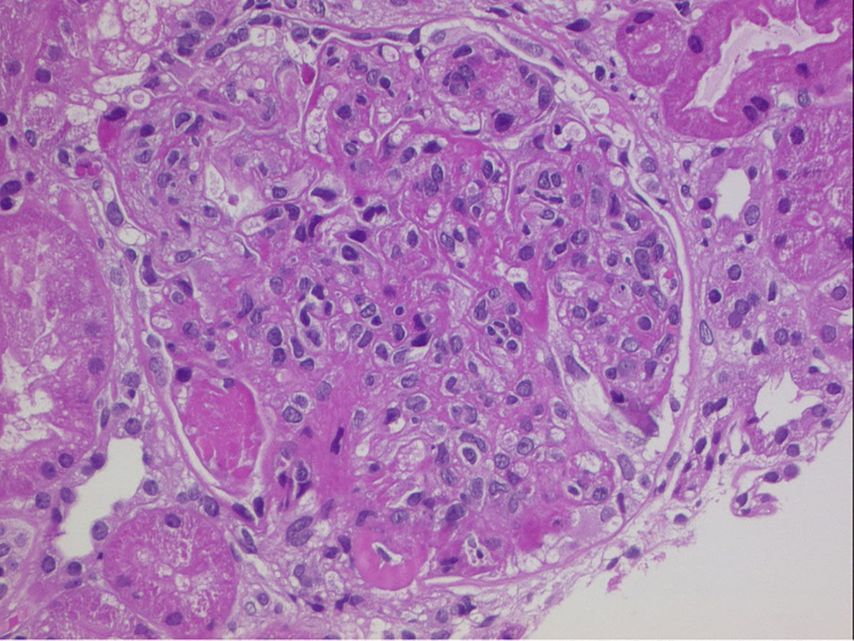
Abb. 1: HE-Färbung: Glomerulum mit typischen Veränderungen einer proliferativen Lupusnephritis (mesangiale und endokapilläre Hyperzellularität, subendotheliale Depots und hyaline Thromben)
Wie gehen Sie in der Praxis vor?
A. Ritter: Der Verdacht auf eine Lupusnephritis besteht bei Nachweis eines aktiven Urinsediments, Proteinurie und/oder einer Abnahme der glomerulären Filtrationsrate. Erhöhte Anti-dsDNA-Antikörpertiter und Komplementverbrauch (C3, C4) weisen auf eine Lupusnephritis hin. Die Sensitivität der Proteinurie für histologische Aktivität ist gut, die der anderen Parameter weniger. Die Spezifität dieser traditionellen Marker ist hingegen weniger gut. Beispielsweise kann die Proteinurie einerseits bei chronischer Schädigung der Nieren ohne aktive Lupusnephritis erhöht sein und andererseits auch bei aktiver Lupusnephritis. Anti-dsDNA-Antikörper und Komplementverbrauch sind mässig gute Marker, um eine Lupusnephritisaktivität zu erfassen. Um zu beurteilen, ob die Patienten auf die Therapie ansprechen und um die Prognose einzuschätzen, sind sie noch weniger geeignet.
H. Seeger: Diese Marker werden dennoch gemeinsam für das Verlaufsmonitoring verwendet. Eine Nierenbiopsie ist wichtig, um die Diagnose zu sichern und die Lupusnephritis-Klasse gemäss ISN/RPS festzulegen, um das Ausmass von Krankheitsaktivität und -chronizität zu bestimmen und um andere Ursachen auszuschliessen. Die alleinige Klinik bildet nicht immer die Krankheitsschwere ab.
Wann ist eine Biopsie indiziert?
A. Ritter: Im Einklang mit den EULAR/ERA-EDTA- und KDIGO-Richtlinien5,6 sollte die Biopsie sicherlich bei Vorliegen einer Proteinurie über 500mg/d, einem aktiven Sediment oder Kreatininanstieg ohne andere Erklärung erfolgen. Vorsicht ist dennoch geboten bei den Patienten mit einer Proteinurie unter 500mg/d, aber ≥200mg/d. Diese sind engmaschig zu beobachten, da gezeigt werden konnte, dass es innerhalb von zwei Jahren bei jedem Zweiten zu einer Progression mit Anstieg der Proteinurie >500mg/d kommt.7 Zudem wurde gezeigt, dass bei einem relevanten Anteil von SLE-Patienten mit Proteinurie <500mg/d eine proliferative Lupusnephritis-Klasse III oder sogar IV vorliegt.4 Deshalb befürworte ich in manchen Fällen die Durchführung einer Biopsie auch bei Patienten mit einer anhaltend erhöhten Proteinurie, welche aber noch unter 500mg/d liegt, selbst wenn die glomeruläre Filtrationsrate normal ist. Dies ist besonders wichtig, da eine frühzeitige Behandlung bei einer Lupusnephritis dazu beiträgt, chronische Schäden zu vermeiden, und auch eine weniger aggressive Therapie erlaubt.
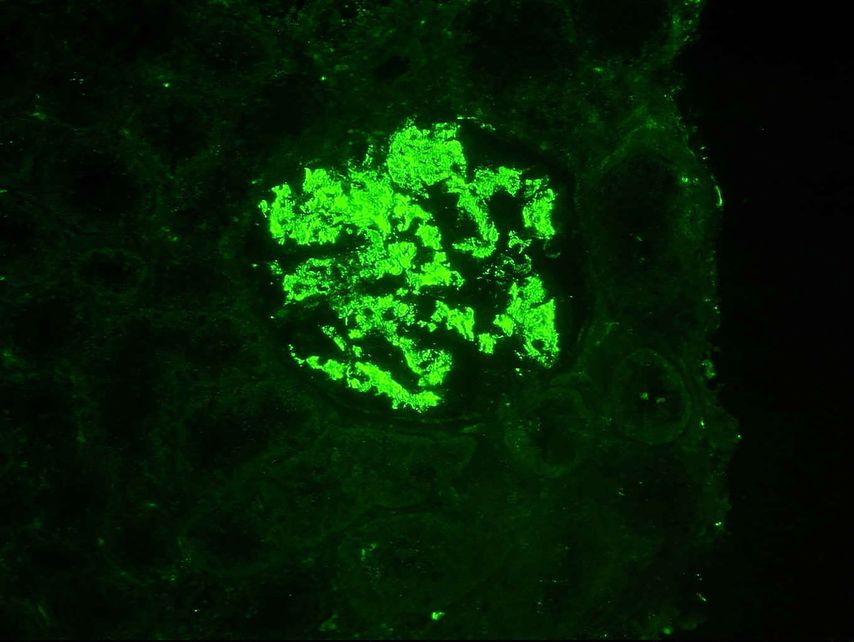
Abb. 2: Immunfluoreszenz für C1q: ausgedehnte glomeruläre Ablagerungen der Komplementkomponente C1q bei einem Patienten mit proliferativer Lupusnephritis
Wie lange sollte man eine Lupusnephritis therapieren?
H. Seeger: Es wird empfohlen, eine proliferative Lupusnephritis (ISN/RPS Klasse III/IV±V) für mindestens drei Jahre zu behandeln inklusive der initialen Induktionstherapie. Führen Sie vor der Entscheidung über einen Therapiestopp grosszügig eine Nierenbiopsie durch, da Klinik und Histologie nicht immer deckungsgleich sind und um insbesondere anhand des Aktivitätsindex der National Institutes of Health (NIH-Aktivitätsindex) das Rezidivrisiko abschätzen zu können,8 auch wenn der Wert dieser Verlaufsbiopsien noch nicht in randomisierten kontrollierten Studien belegt wurde. Nicht vergessen sollte man, sorgfältig die Nebenwirkungen zu monitorisieren. Insbesondere die Steroidtherapie trägt zu Langzeitschäden bei, weshalb die Glukokortikoide wenn möglich in geringer Dosis verabreicht und sobald wie möglich ausgeschlichen werden sollten. Moderne Kombinationstherapien mit Belimumab oder Voclosporin, die heute zur Verfügung stehen, ermöglichen ein steroidreduziertes Vorgehen, ohne dass es zur Zunahme von Nebenwirkungen kommt oder Behandlungseffizienz eingebüsst wird. Vielmehr besteht mit einer Tripeltherapie unter Zugabe von Voclosporin zur Standardtherapie mit Steroiden und Mycophenolat oder Belimumab in Kombination mit Cyclophosphamid oder Mycophenolat sowie Steroiden eine signifikant höhere Chance einer vollständigen oder teilweisen Remission der Lupusnephritis.9,10
Literatur:
1 Guo Z et al.: Urinary biomarkers associated with podocyte injury in lupus nephritis. Front Pharmacol 2024; 15: 1324540 2 https://rebiolup.com 3 Hu W et al.: Clinical-morphological features and outcomes of lupus podocytopathy. Clin J Am Soc Nephrol 2016; 11: 585-92 4 Mejia-Vilet JM et al.: The lupus nephritis management renaissance. Kidney Int 2022; 101: 242-55 5 Fanouriakis A et al.: 2019 Update of the Joint European League Against Rheumatism and European Renal Association-European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis. Ann Rheum Dis 2020; 79: 713-23 6 Kidney Disease: Improving Global Outcomes (KDIGO) Lupus Nephritis Work Group: KDIGO 2024 clinical practice guideline for the management of lupus nephritis. Kidney Int 2024; 105(1S): S1-69 7 Wang S et al.: Short- and long-term progression of kidney involvement in systemic lupus erythematosus patients with low-grade proteinuria. Clin J Am Soc Nephrol 2022; 17: 1150-8 8 De Rosa M et al.: A prospective observational cohort study highlights kidney biopsy findings of lupus nephritis patients in remission who flare following withdrawal of maintenance therapy. Kidney Int 2018; 94: 788-94 9 Furie R et al.: Two-year, randomized, controlled trial of belimumab in lupus nephritis. N Engl J Med 2020; 383: 1117-28 10 Rovin BH et al.: Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): a double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2021; 397: 2070-80 11 Aringer M et al.: 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Arthritis Rheumatol 2019; 71: 1400-12
Das könnte Sie auch interessieren:
Ausgewählte mündliche Mitteilungen
Schweizer Nephrologinnen und Nephrologen gaben an ihrem Jahreskongress 2023 in Lausanne spannende Einblicke in ihre breit gefächerte Forschung. Wir stellen Ihnen hier einige dieser ...
Was wir wirklich wissen und wo der Mythos beginnt
Dass eine chronische Niereninsuffizienz mit dem Vorliegen einer metabolischen Azidose einhergeht, ist längst bekannt. Aber bedingt sie auch ihre Progression? Und kann den Betroffenen mit ...
Prävention von Nierensteinen mit Thiaziden: top oder Flop?
Trotz unklarer Datenlage werden Thiazide und Thiazid-ähnliche Diuretika seit Jahrzehnten zur Prävention von idiopathischen Nierensteinen eingesetzt. Die NOSTONE-Studie, eine vom ...