Thérapie par cellules CAR-T: du traitement de transition à la gestion de la toxicité
Compte-rendu:
Mag. Dre Anita Schreiberhuber
Depuis l’introduction de la thérapie par cellules CAR-T, de plus en plus de facteurs ont été identifiés, qui permettent de tirer des conclusions sur la probabilité des résultats, mais aussi sur le développement d’hématotoxicités et d’infections sévères. Les besoins d’optimisation sont toutefois encore importants, par exemple pour la lymphodéplétion: ils’agit ici d’examiner des schémas définis au moyen d’études spécialement conçues àcet effet, afin de créer une base de données uniformisée.
Traitement de transition: effets sur la thérapie par cellules CAR-T?
Dre Anna Dodero, Fondazione IRCCS Istituto Nazionale dei Tumori, Milan, a déclaré ce qui suit: «la décision de mettre en place un traitement de transition tient compte de divers facteurs tels que les caractéristiques de la tumeur, la charge tumorale, les caractéristiques du·e la patient·e et le·s traitement·s antérieur·s». La mise en place d’un traitement de transition pendant la production des cellules CAR-T, c’est-à-dire dans l’intervalle entre la leucaphérèse et la perfusion, vise également à empêcher la progression de la maladie (PD).1 Plusieurs études du monde réel, telles que l’étude de registre française DESCAR-T, montrent que la plupart des patient·es ont reçu un traitement de transition: sur 729 patient·es atteint·es de lymphome à grandes cellules B (LBCL), 603 ont reçu un traitement de transition.1 Les taux de réponse au traitement de transition, en termes de réponse partielle (PR) ou complète (CR), se situent entre 12 et 26%.1,2
De plus, il a été démontré que l’obtention d’une réponse à un traitement de transition était corrélée à la concentration ainsi qu’à l’expansion des cellules CAR-T,3 et que le type de réponse ou l’absence de réponse (PR/CR par rapport à maladie stable [SD]/PD) est prédictif des résultats après la perfusion de cellules CAR-T: la survie sans progression (PFS) et la survie globale (OS) à 12 mois étaient respectivement de 50 par rapport à 21% et de 63 par rapport à 46% pour l’obtention d’une PR/CR par rapport à SD/PD.4
Besoin urgent d’optimisation des schémas de lymphodéplétion
La lymphodéplétion est la partie du cycle de la thérapie par cellules CAR-T ayant lieu immédiatement avant la perfusion de cellules CAR-T. «Elle est essentielle, mais elle est sous-estimée et pourrait avoir des effets sur l’expansion des lymphocytes T. Il n’existe aucune évaluation systématique de la lymphodéplétion. Les schémas thérapeutiques utilisés reposent sur des données empiriques, de sorte que les besoins d’optimisation sont urgents», a expliqué l’Univ.-Prof. Dr Ulrich Jäger, Université de médecine de Vienne. «Sur 1272 études de cellules CAR-T criblées portant sur l’axicabtagene ciloleucel (Axi-Cel), le tisagenlecleucel (Tisa-Cel) et le lisocabtagene maraleucel (Liso-Cel), des données spécifiques sur la lymphodéplétion sont disponibles pour seulement 0,016% d’entre elles», a ajouté U. Jäger.
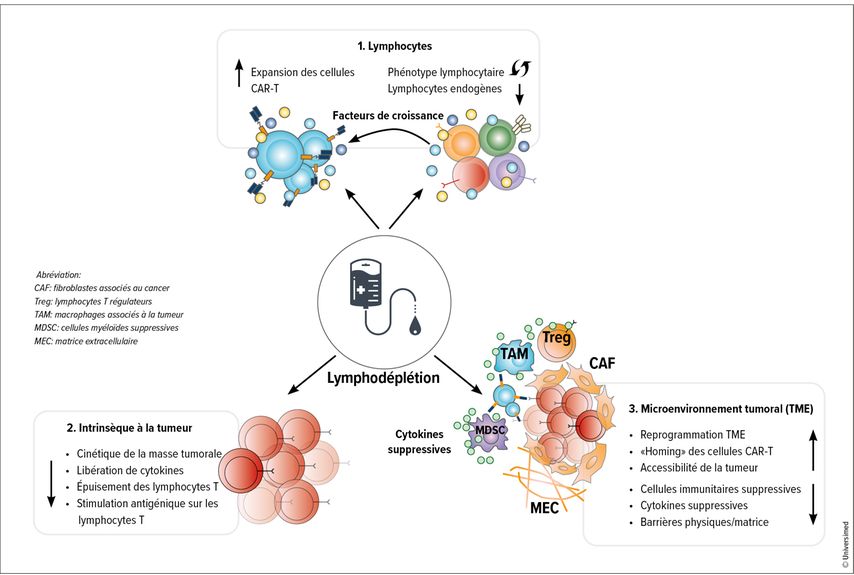
C’est pourquoi les membres du consortium T2EVOLVE, une association d’expert·es européen·nes dont l’objectif principal est d’accélérer le développement de thérapies par cellules CAR-T et d’en faciliter l’accès, ont décidé de rédiger un article de synthèse sur ce sujet. On y trouve non seulement un aperçu des schémas et des doses de lymphodéplétion utilisés dans les études cliniques, mais aussi la définition de questions de recherche pertinentes qui devraient aider à la conception de protocoles de lymphodéplétion pour le développement de schémas de conditionnement optimisés.5 Les objectifs de la lymphodéplétion comprennent la réduction des lymphocytes endogènes afin de préparer la greffe des cellules CAR-T et de soutenir leur activité à long terme, ainsi que la réduction des cellules tumorales et la reprogrammation du microenvironnement afin d’assurer une prise de greffe, un «homing» et une survie à long terme optimaux des cellules CAR-T (Fig. 1).5
Fig. 1: Effets de la lymphodéplétion sur le·a receveur·euse: (1) Nombre et composition des lymphocytes de l’hôte ainsi que production de cytokines. (2) Réduction de la tumeur et modulation de son comportement. (3) Reprogrammation du microenvironnement du·e la receveur·euse pour un meilleur «homing» des cellules CAR-T (modifié selon Lickefett B. et al.)5
En ce qui concerne l’efficacité, il est considéré comme prouvé que de meilleurs effets peuvent être obtenus à des doses plus élevées pour la lymphodéplétion. Une des premières études à ce sujet, portant sur l’association cyclophosphamide/fludarabine, un des schémas de lymphodéplétion les plus utilisés,5 a été publiée en 2019 par Hirayama et al.Les auteur·es ont démontré qu’une dose de cyclophosphamide plus élevée par rapport à moins élevée (60mg/kg par rapport à <1500mg/m2 ou 30mg/kg) est associée à une probabilité plus élevée de profil cytokinique favorable et de meilleure expansion des lymphocytes T.6Une autre étude s’est penchée sur la question de la dose optimale ou du seuil: elle a examiné les résultats d’une thérapie par cellules CAR-T avec Tisa-Cel chez des enfants et des adolescents atteints de leucémie lymphoblastique aiguë à cellules B sur la base de l’exposition à la fludarabine (<14 par rapport à ≥14mg*h/l) dans le sang périphérique et de constater qu’une AUC cumulée («area under the curve»)T0-∞ ≥14 de fludarabine est associée à une survie sans leucémie plus longue et à une meilleure expansion des lymphocytes T. Les résultats cliniques de ces patient·es pourraient être encore améliorés en optimisant l’exposition à la fludarabine dans le cadre du schéma de lymphodéplétion, ce qui soulève la question d’une lymphodéplétion individuelle.7 Une possibilité à cet égard pourrait être un modèle pharmacocinétique basé sur la population, tel que Scordo et al. l’ont développé pour une étude sur des patient·es adultes atteint·es de lymphome: l’AUC de la fludarabine a été calculée à l’aide du modèle pharmacocinétique; une exposition à la fludarabine de 18–20mg*h/l a été identifiée comme l’AUC optimale: elle était associée à la PFS la plus longue et au risque de récidive le plus faible.8
La bendamustine, une alternative à l’association cyclophosphamide/fludarabine?
L’efficacité comparable, mais la toxicité moindre que celle de l’association cyclophosphamide/fludarabine, plaident en faveur de la lymphodéplétion par la bendamustine.5 Cela a notamment été confirmé par une étude comparant ces deux schémas de lymphodéplétion, dans lesquels 90 patient·es atteint·es de LBCL ont été traité·es par cyclophosphamide/fludarabine et 40 par bendamustine avant l’administration de Tisa-Cel. La bendamustine s’est révélée d’une efficacité comparable à celle de l’association cyclophosphamide/fludarabine et a entraîné une augmentation du nombre de neutrophiles et de plaquettes, ainsi qu’une régénération plus rapide de la formule sanguine. En revanche, l’association cyclophosphamide/fludarabine était associée à un taux plus élevé d’effets secondaires hématologiques et de syndrome de libération de cytokines (CRS), ainsi qu’à une plus grande neurotoxicité.9
Cela a également été démontré dans une étude portant sur la lymphodéplétion par la bendamustine avant une thérapie par cellules CAR-T avec Axi-Cel, dont les résultats confirment que la bendamustine constitue une alternative sûre à l’association cyclophosphamide/fludarabine.10
Le défi des mécanismes de résistance
Parmi les causes possibles d’un échec de la thérapie par cellules CAR-T, Assoc. Prof. Dr Marco Ruella, Université de Pennsylvanie, a cité les problèmes pré-perfusion, les facteurs de l’hôte, le dysfonctionnement des cellules CAR-T, les mécanismes intrinsèques à la tumeur, le microenvironnement tumoral et les toxicités, en mettant l’accent sur des sujets spécifiques comme la biologie des tumeurs.11 «Nous sommes très intéressés par l’identification des facteurs génétiques qui peuvent influencer les résultats après la perfusion de cellules CAR-T», a-t-il déclaré.
La survie des cellules de lymphomes dépend de la méthyltransférase EZH2. En se basant sur l’hypothèse que l’inhibition d’EZH2 pourrait renforcer l’effet anti-tumoral des cellules CAR-T et augmenter l’immunogénicité des lymphomes, Porazzi et al. ont comparé une thérapie par cellules CAR-T plus l’inhibiteur d’EZH2 tazémétostat à une thérapie par cellules CAR-T seule sur des lignées de cellules de lymphomes, ce qui a confirmé leurs suppositions. Une étude rétrospective d’une cohorte présentant des lymphomes à cellules B (n=81) a en outre constaté que les patient·es avec mutation activatrice d’EZH par rapport à ceux avec EZH de type sauvage présentaient une réponse réduite aux cellules CAR-T (14,3 par rapport à 42,3%).12 «L’inhibition d’EZH2 peut également entraîner une modulation du microenvironnement ainsi qu’une augmentation de la fonction des lymphocytes», a rapporté M. Ruella concernant ses propres résultats de recherche.
Il a en outre abordé le sujet des lymphomes à cellules T après une thérapie par cellules CAR-T. Cette dernière a été mise en avant par une mise en garde de la FDA publiée en novembre 2023.13 Dès le congrès de l’American Society of Hematology (ASH) qui a suivi, le groupe de travail de M. Ruella a mené une étude rétrospective à ce sujet: sur 449 patient·es, douze ont développé des tumeurs solides et cinq des tumeurs hématologiques malignes après une thérapie par cellules CAR-T. Le délai médian de survenue était de 26,4mois pour les tumeurs solides et de 9,7mois pour les tumeurs hématologiques malignes. Le seul lymphome à cellules T détecté a été diagnostiqué dans la biopsie du ganglion lymphatique d’un patient qui avait développé en même temps un cancer du poumon.14 «Ce nombre de tumeurs malignes secondaires est inférieur à celui que nous observons après une greffe ou une chimiothérapie, et bien sûr, tous·tes ces patient·es avaient reçu plusieurs chimiothérapies auparavant», a déclaré M. Ruella pour modérer la mise en garde de la FDA.
Toxicités associées à la thérapie parcellules CAR-T
Une session spéciale a été consacrée à la gestion de la toxicité, avec une présentation du Dre Bianca Santomasso, Memorial Sloan Kettering Cancer Center, New York, sur l’«immune effector cell-associated neurotoxicity syndrome» (ICANS) et du PD Dr Kai Rejeski, Ludwig-Maximilians-Universität, Munich, sur l’«immune effector cell-associated hematotoxicity» (ICAHT).
ICANS: symptômes neurotoxiques multiples
Contrairement au CRS, pour lequel l’inhibition du récepteur de l’interleukine 6 permet d’obtenir rapidement une régression des symptômes, les inhibiteurs du récepteur de l’interleukine 6 ne sont pas efficaces en cas d’ICANS. Les symptômes neurotoxiques observés dans l’ICANS comprennent la difficulté à trouver ses mots/aphasie, les tremblements, la somnolence, les crises d’épilepsie, la faiblesse motrice, l’œdème cérébral, mais le développement d’une encéphalopathie globale liée à la thérapie par cellules CAR-T (CRES) est également caractéristique. Les symptômes varient d’un·e patient·e à l’autre. En règle générale, la neurotoxicité apparaît pendant ou, le plus souvent, après un CRS et régresse sans laisser de déficits permanents.
L’équipe de B. Santomasso a mis au point un outil de dépistage pour évaluer la sévérité de l’encéphalopathie liée à la thérapie par cellules CAR-T, qui comprend les domaines «orientation», «dénomination», «suivi d’ordres», «écriture» et «attention». Des points sont attribués en fonction de la sévérité, le score comprend une échelle de 1 à 10 et a été intégré dans le Grading Score de l’American Society for Transplantation and Cellular Therapy (ASTCT).15
Hématotoxicité: l’effet secondaire le plus fréquent lié à la thérapie par cellules CAR-T
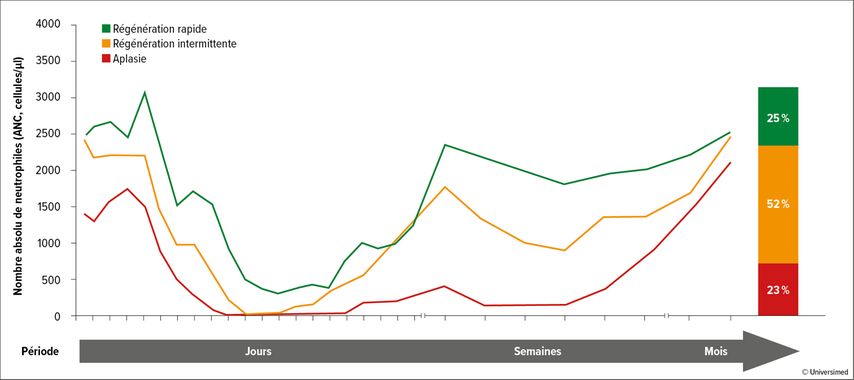
De tous les effets secondaires associés à la thérapie par cellules CAR-T, l’hématotoxicité présente l’incidence cumulative la plus élevée, avec 57,7%. Dans la plupart des cas, elle est classée à un degré ≥3. L’évolution de la neutropénie liée à la thérapie par cellules CAR-T est biphasique, avec une distinction entre trois phénotypes (Fig. 2):17
-
régénération rapide: régénération continue des neutrophiles sans deuxième diminution du nombre absolu de neutrophiles (ANC<1000/µl)
-
régénération intermittente: régénération des neutrophiles (ANC>1500/µl) après le jour 21
-
aplasie: neutropénie sévère continue (ANC<500/µl) pendant ≥14 jours
Le phénotype clinique de la régénération des neutrophiles a un impact significatif sur la durée médiane de la neutropénie sévère. En conséquence, le phénotype aplasique présente le risque le plus élevé de développer des infections sévères.17
Rajeski et al. ont identifié des facteurs de risque pour le développement de ce phénotype et ont découvert que le taux de plaquettes, l’ANC et l’hémoglobine en tant que paramètres hématologiques, mais aussi le statut inflammatoire – protéine C-réactive (CRP) et ferritine à la référence (avant la perfusion des cellules CAR-T) – étaient des paramètres pertinents. Ces facteurs constituent la base du score CAR-HEMATOTOX, un calculateur de risque pour la prédiction des hématotoxicités sévères, qui répartit les patient·es dans un groupe à faible risque et un groupe à haut risque («HTlow»: 0–1/«HThigh»: 2–7). Le score a été validé dans une cohorte européenne et une cohorte américaine. En effet, on a constaté que les patient·es HThigh présentaient plus souvent un phénotype aplasique et une neutropénie sévère prolongée.17 Il a également été confirmé que les neutropénies sévères sont associées à des infections sévères et que les patient·es HThigh présentent en soi un risque plus élevé de développer des neutropénies sévères. Dans la pratique clinique, cela signifie qu’il est également possible de prendre des mesures anti-infectieuses prophylactiques appropriées en déterminant le risque. Chez les patient·es HThigh, une prophylaxie antibactérienne a permis de réduire de manière significative la probabilité d’infections bactériennes sévères. En outre, il a été démontré que les patient·es Hthigh par rapport à ceux·elles HTlow présentaient une PFS (3,4 par rapport à 12,6 mois) et une OS plus courtes (9,1 mois par rapport à non atteinte), et étaient hospitalisé·es plus longtemps (20 par rapport à 16jours).18
La German Lymphoma Alliance (GLA) met à disposition le score CAR-HEMATOTOX sous forme d’outil en ligne, ce qui permet de calculer facilement le groupe de risque des patient·es en saisissant les paramètres correspondants.19
Source:
6th EBMT-EMA CAR-T cell Meeting, 15–17 février 2024, Valence, Espagne (hybride)
Littérature:
1 Bachy E et al.: Nat Med 2023; 28(10): 2145-54 2 Kwon M et al.: Haematologica 2023; 108(1): 110-21 3 Jallouk AP et al.: Haematologica 2023; 108(4): 1163-7 4 Roddie C et al.: Blood Adv 2023; 7(12): 2872-83 5 Lickefett B et al.: Front Immunol 2023; 14: 1303935 6 Hirayama VA et al.: Blood 2019; 133(17): 1876-87 7 Dekker L et al.: Blood Adv 2022; 6: 1969-76 8 Scordo M et al.: Blood Adv 2023; 7(18): 5579-85 9 Ghilardi G et al.: Ann Oncol 2022; 33: 916-28 10 Ghilardi G et al.: Blood Adv 2024; 33(9): 916-28 11 Ghilardi G et al.: Br J Hematol 2021; 193: 449-65 12 Porazzi P et al.: ASH 2023; Abstr. #1018 13 FDA: 28novembre 2023. Online unter https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-investigating-serious-risk-t-cell-malignancy-following-bcma-directed-or-cd19-directed-autologous . Consulté le 2 mars 2024 14 Ghilardi G et al.: Nat Med 2024; online ahead of print 15 Lee DW et al.: Biol Blood Marrow Transplant 2019; 25(4): 625-38 16 Wudhikarn K et al.: Blood Adv 2020; 4(13): 3024-33 17 Rejeski K et al.: Blood 2021; 138(24): 2499-513 18 Rejeski K et al.: J Immunother Cancer 2022; 10(5): e004475 19 German Lymphoma Alliance: 2024. En ligne sur https://www.german-lymphoma-alliance.de/Scores . Consulté le 3 mars 2024
Das könnte Sie auch interessieren:
La sélection est essentielle dans le traitement des tumeurs gastro-intestinales
La différenciation moléculaire au sein des entités tumorales a conduit à de nouvelles options thérapeutiques, en particulier en ce qui concerne les stratégies thérapeutiques ciblées. L’ ...
Déséquilibre du cortisol cliniquement pertinent chez les patients atteints de cirrhose
La gravité croissante de la maladie entraîne une dysfonction de l’axe hypophyso-surrénalien chez les patients atteints de cirrhose. Un faible taux de cortisol sérique est un prédicteur ...
Ostéoporose: Vue d’ensemble du diagnostic et du traitement
L’incidence des fractures de fragilité liées à l’ostéoporose en Suisse est élevée: 1 femme sur 2 et 1 homme sur 5 subissent au moins une fracture de fragilité après l’âge de 50 ans. ...