Neues zur Prophylaxe bei venösen Thromboembolien und Hämophilie
Bericht:
Dr. Andreas Billich
Der ISTH-Kongress ist das wichtigste internationale Meeting auf dem Gebiet von Thrombose und Hämostase. Eine Auswahl herausragender klinischer Forschungs-beiträge ist im Folgenden zusammengestellt.
Gezielte Thromboseprophylaxe bei Immobilisierung der unteren Extremitäten
Viele Patient:innen mit einem Trauma der unteren Extremitäten benötigen eine Immobilisierung. Diese ist jedoch mit einem erhöhten Risiko für venöse Thromboembolien (VTE) verbunden, weshalb diese Patient:innen typischerweise eine Prophylaxe mit niedermolekularem Heparin (NMH) erhalten. Zur Risikostratifizierung kann der TRiP(cast)-Score dienen, der für die Vorhersage des VTE-Risikos bei dieser Patient:innenpopulation validiert wurde.1 Jetzt untersuchte die Studie CASTING die Sicherheit einer Strategie, bei der den Patient:innen mit niedrigem Score eine präventive Antikoagulation vorenthalten wurde.2
In der von Prof. Delphine Douillet (Universitätsklinikum Angers, Frankreich) vorgestellten Studie wurden Patient:innen mit Immobilisierung der unteren Extremitäten einer Interventionsgruppe zugewiesen. In dieser Gruppe erhielten nur Patient:innen mit hohem VTE-Risiko (Score ≥7) eine Antikoagulation mit NMH; die Prophylaxerate betrug 24,5%. Bei Patient:innen einer parallelen Beobachtungsgruppe, welche die Prophylaxe gemäß üblicher ärztlicher Praxis erhielt, war die Rate rund doppelt so hoch (50,4%). Die Drei-Monats-Rate symptomatischer VTE unterschied sich jedoch zwischen den beiden Gruppen nicht signifikant (1,0% vs. 1,1%); die Rate betrug bei Niedrigrisiko-Patient:innen der Interventionsgruppe 0,7%.
Dies bedeutet, dass die gezielte prophylaktische Koagulation bei immobilisierten Traumapatienten, basierend auf dem TRiP(cast)-Score, sicher ist. Durch Anwendung dieser Strategie können unnötige tägliche NMH-Injektionen reduziert werden.
Apixaban in der Sekundärprävention von VTE bei Krebspatienten
Tumorassoziierte VTE sind mit einer hohen Rezidivrate verbunden. Bei einer aktiven Krebserkrankung (d.h. bei Metastasierung, Nichtresektierbarkeit oder lokal fortgeschrittener Erkrankung) ist daher gemäß aktuellen Leitlinien eine andauernde Antikoagulation über sechs Monate hinaus zu erwägen.3 Hierfür können neben NMH bei geeigneten Patient:innen auch direkte orale Antikoagulanzien (DOAK) verwendet werden, darunter auch der Faktor-Xa-Inhibitor Apixaban. Eine Studie stellte nun die Frage nach einer geeigneten Dosis von Apixaban für die Dauertherapie, wie Dr. Robert McBane (Mayo Clinic, Rochester, USA) erläuterte.4
Die randomisierte Phase-III-Studie EVE verglich Apixaban in der Standarddosis von 2,5mg mit einer erhöhten Dosis von 5mg (jeweils 2x tgl.) über einen Zeitraum von 12 Monaten bei 360 Patient:innen mit tumorassoziierten VTE 6–12 Monate nach Beginn der Antikoagulation. Die Häufigkeit von starken bzw. klinisch relevanten Blutungen in den beiden Dosisgruppen war nicht signifikant verschieden (8,9% und 12,2%, p=0,39). VTE oder arterielle Thrombosen traten bei jeweils 5% der Patient:innen beider Dosisgruppen auf; auch die Mortalität jeglicher Ursache war in den beiden Gruppen ähnlich (13,6% vs. 11,7%; p=0,53). Somit scheint niedrig dosiertes Apixaban in der Sekundärprävention von VTE bei aktivem Krebs effektiv und sicher zu sein. Eine größere Studie zur weiteren Abklärung ist unterwegs.
Rivaroxaban vs. NMH bei tumorassoziierten VTE
Drei retrospektive Kohortenstudien in den USA, Großbritannien und Schweden verglichen Rivaroxaban und NMH bei tumorassoziierten VTE. Patient:innen mit Krebstypen, die bekanntermaßen mit hohem Blutungsrisiko unter DOAK-Therapie verbunden sind, wurden ausgeschlossen; dazu gehören Karzinome des Ösophagus und des Magens, unresektierte Kolorektalkarzinome, Blasenkrebs, nichtzerebrale ZNS-Tumoren und Leukämie.
Prof. Craig Coleman (Universität Connecticut, USA) stellte eine Metaanalyse dieser Studien vor, welche 1690 Rivaroxaban- und 9741 NMH-behandelte Patient:innen einschloss.5 Das Risiko für das Wiederauftreten von VTE unter Rivaroxaban-Therapie war nach drei Therapiemonaten verglichen mit NMH-Behandlung um 29% reduziert und nach sechs Monaten um 24%. Nach drei Monaten war das Risiko für starke Blutungen nicht signifikant verschieden, doch nach sechs Monaten war es mit Rivaroxaban um 25% reduziert.
Zusammengenommen scheint Rivaroxaban in der Sekundärprävention von VTE bei Krebspatient:innen das Rezidivrisiko und das Blutungsrisiko gegenüber NMH zu mindern, sofern Patient:innen mit hohem Risiko für Blutungen unter DOAK-Therapie von der Behandlung ausgeschlossen sind.
Hämophilie-Prophylaxe mit Concizumab
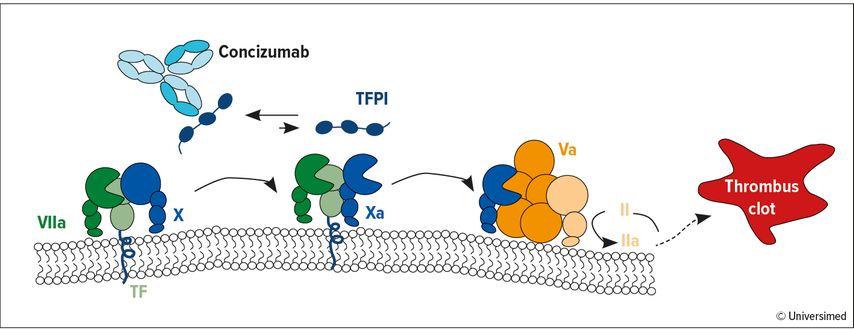
Der„Tissue factor pathway inhibitor“ (TFPI) hemmt den extrinsischen Weg der Blutgerinnung durch Bindung an Faktor Xa (FXa) und Faktor VIIa (FVIIa). Concizumab ist ein gegenTFPI gerichteter Antikörper (Abb. 1), der zur subkutanen Prophylaxe einmal täglich bei allen Subtypen der Hämophilie entwickelt wird.7 Eine erste Zulassung erfolgte kürzlich in Kanada. Prof. Pratima Chowdary (University College London, UK) präsentierte beim ISTH-Kongress die Primäranalyse der Phase-III-Studie explorer8 (NCT04082429) bei Patient:innen mit Hämophilie A und B (HA und HB) ohne Inhibitoren.8
Abb. 1: Wirkmechanismus von Concizumab. TFPI ist der Haupt-Inhibitor des ternären TF/FVIIa/FXa-Komplexes. Concizumab bindet an TFPI und hebt seine inhibitorische Aktivität auf. Dies erlaubt ausreichende Bildung von Thrombin (FIIa), um Blutungen zu verhindern. Modifiziert nach Shapiro AD et al.6
Die Studie mit insgesamt 148 Patient:innen im Alter >12 Jahre bestätigte die Überlegenheit einer Prophylaxe mit Concizumab gegenüber keiner Prophylaxe; die annualisierte Blutungsrate der HA- und HB-Patient:innen wurde um 86% bzw. 79% reduziert (p<0,001). Die Prophylaxe mit Concizumab war sicher und wurde gut toleriert; mit einem angepassten Dosierungsschema traten keine thromboembolischen Ereignisse auf und die Plasmaspiegel des Antikörpers waren über die Zeit stabil.
Gentransfer mit Valoctocogen Roxaparvovec (VR)
Der nichtreplizierende Gentherapie-Vektor VR (AAV5-hFVIII-SQ) überträgt eine für Faktor VIII (FVIII) kodierende Sequenz, welche bei Patient:innen mit schwerer Hämophilie A die endogene Produktion von aktivem FVIII ermöglicht. In der Phase-III-Studie GENEr8-1 (NCT03370913) bei 134 erwachsenen Männern wurde mit VR-Therapie eine FVIII-Aktivität erzielt, die einen verbesserten Schutz vor Blutungen verglichen mit FVIII-Prophylaxe bot.9 Jetzt präsentierte Prof. Johnny Mahlangu (Johannesburg Academic Hospital, Südafrika) ein Update der Studienergebnisse.10
Im dritten Jahr nach dem Gentransfer traten keine neuen Sicherheitssignale auf. Die häufigste Nebenwirkung war weiterhin eine meist milde Transaminase-Erhöhung; es wurden keine neuen Grad 3-Nebenwirkungen und keine Entwicklung von Inhibitoren oder Thromboembolien beobachtet. Die Reduktion behandlungsbedürftiger Blutungen blieb auch nach drei Jahren erhalten und betrug 83% vom Ausgangswert; 75% der Patient:innen hatten nach VR-Therapie gar keine derartigen Blutungen. Die FVIII-Aktivität blieb auch nach bis zu vier Jahren auf einem hämostatischen Niveau. Insgesamt zeigte VR somit robuste Effektivität verglichen mit einer FVIII-Prophylaxe.
Prophylaxe mit Emicizumab bei erworbener Hämophilie A
Die erworbene Hämophilie A (AHA) ist eine Autoimmunerkrankung, charakterisiert durch die Bildung von Autoantikörpern gegen FVIII.11 Bei Diagnose präsentieren sich die betroffenen Patient:innen mit schweren Blutungen. Erstes Ziel der Behandlung ist der Stopp akuter Blutungen (durch Bypasspräparate oder rekombinanten FVIII vom Schwein). Danach soll jedoch durch Verhinderung der Bildung von Autoantikörpern eine langfristige Remission erzielt werden; dies gelingt durch immunsuppressive Therapie (IST). Doch durch die IST steigt das Risiko fataler Infektionen bei den meist älteren und gebrechlichen AHA-Patienten und übertrifft noch das Risiko für tödliche Blutungen. Zudem braucht es meist 3 bis 7 Wochen, bis durch IST eine Remission erreicht wird; während dieser Zeit bleibt das Blutungsrisiko hoch.
Prof. Andreas Tiede (Medizinische Hochschule Hannover) stellte jetzt die Resultate einer offenen Studie (NCT04188639) vor, die bei 47 AHA-Patient:innen die Möglichkeit einer Prophylaxe mit Emicizumab (einem FVIII-Mimetikum) an Stelle der IST untersuchte.12 Emicizumab wurde einmal wöchentlich über 12 Wochen injiziert. Die Studie erreichte das vordefinierte Kriterium einer signifikant reduzierten Blutungsrate (0,04 Blutungen pro Patientenwoche vs. 0,15 in der ersten 12 Wochen IST in einer früheren Studie; p<0,01). Die Inzidenz thromboembolischer Ereignisse war in der Studie ähnlich wie in historischen Registerstudien und das Gesamtüberleben erschien verglichen mit früheren Studien hoch.
Tiede resümierte, dass die IST im Management der AHA weiterhin relevant sein wird, jedoch nicht mehr so früh und aggressiv eingesetzt werden muss. Denn mit Emicizumab können die Patient:innen vor Blutungen geschützt werden und es wird ihnen Zeit gegeben, sich vor Beginn der IST zu erholen.
ADAMTS13 bei kongenitaler TTP
Kongenitale thrombotisch-thrombozytopenische Purpura (cTTP) ist eine seltene, potenziell lebensbedrohliche thrombotische Mikroangiopathie, die durch eine Defizienz der Protease ADAMTS13 ausgelöst wird. Derzeitiger Therapiestandard (SoC) ist die Substitution von ADAMTS13 durch regelmäßige Infusion von Plasmapräparaten (prophylaktisch oder bei Bedarf); dies führt jedoch zu variablen ADAMTS13-Spiegeln, welche die Akutsymptome der Erkrankung nicht ausreichend kontrollieren können. Eine noch laufende Phase-III-Schlüsselstudie (NCT03393975) untersucht die Wirksamkeit und Sicherheit einer Prophylaxe mit rekombinantem ADAMTS13-Protein (rADMATS13) bei dieser Erkrankung.
Prof. Marie Scully (University College London) stellte die Zwischenergebnisse der Studie nach rund 13-monatiger Behandlungsdauer vor.13 Unter 37 jugendlichen bzw. erwachsenen cTTP-Patient:innen trat in der Studie unter rADMATS13-Prophylaxe kein akuter TTP-Vorfall auf und unter 38 Patienten, die mit SoC behandelt wurden, ein akuter Vorfall. Die annualisierte Rate subakuter Ereignisse betrug 0 vs. 0,25 mit rADMATS13 vs. SoC. TTP-Manifestationen (z.B. Thrombozytopenie, mikroangiopathische hämolytische Anämie, neurologische Symptome und Bauchschmerz) waren generell unter rADMATS13-Prophylaxe reduziert. Die Daten wiesen auch auf eine Stabilisierung der Thrombozytenzahl unter der Therapie hin. ADAMTS13 neutralisierende Antikörper traten nicht auf und Symptome einer Hypersensitivität gegen das Protein waren sehr selten. Zusammengenommen erscheint rADMATS13 als aussichtsreiche Therapie für Patient:innen mit cTTP.
Quelle:
2023 Congress of the International Society on Thrombosis and Haemostasis (ISTH). 24.–28. Juni 2023, Montreal, Kanada
Literatur:
1 Nemeth B et al.: Clinical risk assessment model to predict venous thromboembolism risk after immobilization for lower-limb trauma. EClinicalMedicine 2020; 20: 100270 2 Douillet D et al.: Targeted thromboprophylaxis in patients with lower limb trauma requiring immobilization: stepped wedge randomized trial. ISTH-Kongress 2023, Vortrag LB 02.3 3 Falanga A et al.: Venous thromboembolism in cancer patients: ESMO Clinical Practice Guideline. Ann Oncol 2023; 34(5): 452-67 4 McBane R et al.: Extending venous thromboembolism secondary prevention with apixaban in cancer patients. The EVE Trial. ISTH-Kongress 2023; Vortrag LB 02.1 5 Coleman CI et al.: Effectiveness and safety of rivaroxaban and low molecular-weight heparin in cancer-associated venous thromboembolism: A meta-analysis of OSCAR programme findings. ISTH-Kongress 2023; Vortrag OC 54.1 6 Shapiro AD et al.: Subcutaneous concizumab prophylaxis in hemophilia A and hemophilia A/B with inhibitors: phase 2 trial results. Blood 2019; 134(22): 1973-82 7 Pasca S: Concizumab as a subcutaneous prophylactic treatment option for patients with hemophilia A or B: A review of the evidence and patient‘s perspectives. J Blood Med 2022; 13: 191-9 8 Chowdary P et al.: Concizumab prophylaxis in patients with haemophilia A or B without inhibitors: Efficacy and safety results from the primary analysis of the phase 3 explorer8 study. ISTH-Kongress 2023; Vortrag OC 59.1 9 Mahlangu J et al.: Two-year outcomes of valoctocogene toxaparvovec therapy for hemophilia A. N Engl J Med 2023; 388(8): 694-705 10 Mahlangu J et al.: Bleeding, FVIII activity, and safety 3 years after gene transfer with valoctocogene roxaparvovec: Results from GENEr8-1. ISTH-Kongress 2023; Vortrag OC 20.1 11 Kruse-Jarres R et al.: Acquired hemophilia A: Updated review of evidence and treatment guidance. Am J Hematol 2017; 92(7): 695-705 12 Tiede A et al.: Emicizumab prophylaxis instead of immunosuppressive therapy in patients with acquired hemophilia A (AHA). ISTH-Kongress 2023; Vortrag LB 01.2 13 Scully M et al.: Phase 3 prospective, randomized, controlled, open-label, multicenter, crossover study of recombinant ADAMTS13 in patients with congenital thrombotic thrombocytopenic purpura. ISTH-Kongress 2023; Vortrag OC 14.1
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Pract. med. Alexander Meisel
Pract. med. Alexander Meisel im Interview
Heilung für das multiple Myelom?
Fortschritte des Wissens zur Pathogenese des multiplen Myeloms (MM) und die davon abgeleitete Entwicklung neuer Behandlungsformen haben zu einer signifikanten Steigerung des Überlebens ...