Toxicités aiguës des anticorps bispécifiques et des traitements par cellules CAR-T
Auteur:
Matthias Hellberg-Naegele, MSc
Pflegeexperte APN Netzwerk Onkologie
Entwicklung und Qualitätsmanagement, Kantonsspital St. Gallen
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les options thérapeutiques en hématologie évoluent rapidement. Outre les traitements par cellules CAR-T qui se sont établis au cours des dernières années, il existe désormais une série d’anticorps bispécifiques utilisés dans le traitement, notamment, des leucémies, des lymphomes et du myélome multiple. Les toxicités les plus aiguës des deux formes de traitement sont le syndrome de libération de cytokines (CRS) et le syndrome de neurotoxicité associé aux cellules immunitaires effectrices (ICANS). Le personnel infirmier joue un rôle important dans la détection précoce des symptômes associés.
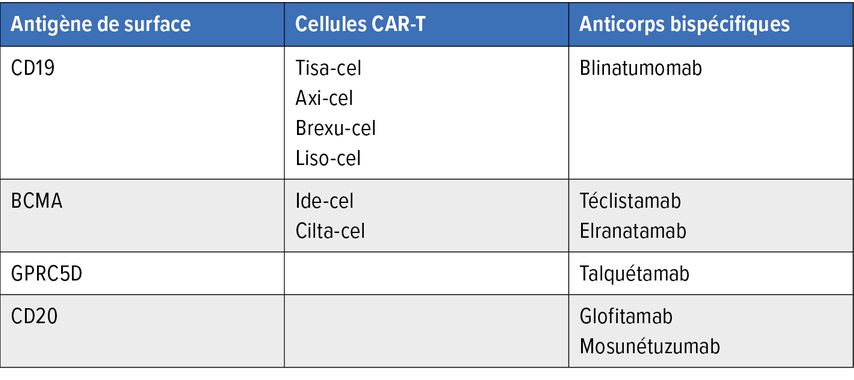
Les CAR-T (Chimeric antigen receptor) sont des lymphocytes T génétiquement modifiés pour exprimer des récepteurs pour les antigènes cibles de la cellule tumorale. Parmi les traitements actuellement disponibles sur le marché, on compte ceux ciblant l’antigène de surface CD19, autorisés pour différents lymphomes et la leucémie lymphoblastique aiguë (ALL), et le BCMA, un antigène de surface sur les cellules du myélome.
En revanche, les anticorps bispécifiques se lient non seulement aux cellules tumorales, mais aussi aux lymphocytes T (CD3). Ils rapprochent ainsi une cellule tumorale et un lymphocyte T qui peut la détruire. Pour le CD19, le blinatumomab est déjà établi depuis de nombreuses années dans le traitement de l’ALL, et, pour le BCMA, il existe désormais le téclistamab et l’elranatamab. De plus, le talquétamab cible le GPRC5D sur les cellules du myélome, et le glofitamab et le mosunétuzumab ciblent le CD20 sur les cellules du lymphome (Tab. 1).
Tab. 1: Vue d’ensemble des traitements par cellules CAR-T et des anticorps bispécifiques ciblant un antigène de surface
Syndrome de libération de cytokines
Le CRS se manifeste par une fièvre d’origine non infectieuse, des symptômes pseudo-grippaux, une hypotension et une hypoxie. La survenue d’un CRS après un traitement par cellules CAR-T est fréquente dans les premiers jours suivant la réinjection des cellules CAR-T.1 Sous anticorps bispécifiques, le CRS survient également souvent dans les premiers jours pendant les administrations de doses croissantes par paliers.2
L’interleukine 6 (IL-6) est considérée comme le médiateur central de la survenue d’un CRS. En conséquence, l’utilisation précoce du tocilizumab, jusqu’à quatre administrations, est le traitement de référence.3 Le tocilizumab est un anticorps monoclonal ciblant les récepteurs de l’IL-6. Pour un dépistage précoce du CRS, il est recommandé de contrôler régulièrement la tension artérielle, le pouls, la température et la saturation en oxygène. Il est important d’identifier rapidement la fièvre et d’exclure les infections ou la septicémie. En particulier, les patient·es sous cellules CAR-T peuvent présenter une neutropénie lors de l’apparition de la fièvre due à la chimiothérapie de déplétion lymphatique.3
Syndrome de neurotoxicité associé aux cellules immunitaires effectrices
L’ICANS se manifeste de manière très hétérogène par différents symptômes neurologiques (p.ex. diminution de la vigilance, troubles cognitifs, aphasie et crises convulsives) d’intensité variable et ne survient souvent que cinq à six jours après la réinjection des cellules CAR-T.1
Pour détecter plus rapidement l’ICANS, l’évaluation pluriquotidienne du score d’encéphalopathie associée aux cellules immunitaires effectrices (ICE) s’est établie. Le score ICE évalue l’orientation (année, mois, ville, lieu), la capacité à désigner trois objets, un test d’écriture, la concentration (compter à rebours à partir de 100, de 10 en 10) et la capacité à suivre tout en effectuant un geste.4
Le traitement de référence d’un ICANS serait l’utilisation de corticoïdes, voire de tocilizumab en cas de CRS concomitant.1–3 En cas d’ICANS sévère, le concept thérapeutique de la stimulation basale® peut aider à réduire l’anxiété des personnes concernées par le biais de perceptions sensorielles.5
CRS et ICANS: fréquence et prophylaxie
Le CRS et l’ICANS peuvent certes survenir aussi bien sous traitement par cellules CAR-T que sous anticorps bispécifiques, mais la fréquence et l’intensité sont réparties de manière assez différente entre les deux formes de traitement, mais aussi entre les différents produits. Ainsi, la fréquence de survenue d’un CRS de tout grade sous traitement par cellules CAR-T est supérieure à 90% pour la plupart des produits et supérieure à 20% pour les formes sévères ≥grade 3, notamment sous brexu-cel et tisa-cel, selon les indications.6–8
Afin de minimiser le risque de CRS, les doses d’anticorps bispécifiques sont augmentées progressivement par paliers jusqu’à la dose thérapeutique. Cela peut prendre d’une semaine à quelques semaines et permet de réduire le risque, surtout de CRS de grade ≥3, jusqu’à moins de 5%. Néanmoins, la probabilité d’un CRS de tout grade sous anticorps bispécifiques pour le myélome et le lymphome se situe entre 40 et 80%.9–12
Il en va de même pour l’ICANS qui est également fréquent sous traitement par cellules CAR-T. Pour l’axi-cel et le brexu-cel en particulier, leur incidence est supérieure à 50%.6,13–16 Pour l’axi-cel, il existe entre-temps une mise à jour concernant la gestion de la réduction de l’incidence du CRS et de l’ICANS. Dans la cohorte 6, l’utilisation prophylactique de corticoïdes et de lévétiracétam, plus l’utilisation précoce de corticoïdes et de tocilizumab en cas d’apparition de symptômes, a ainsi permis de réduire considérablement l’incidence du CRS et de l’ICANS.17 Sous anticorps bispécifiques, l’incidence de l’ICANS ou des symptômes neurologiques de tout grade, à l’exception du blinatumomab,18,19 est inférieure à 15%, l’incidence d’un grade ≥3 est inférieure à 2%.
Toxicité aiguë du talquétamab
En ce qui concerne la toxicité aiguë, le talquétamab est un anticorps bispécifique qui peut provoquer, outre les symptômes susmentionnés, une toxicité cutanée et unguéale, une sécheresse buccale et une dysgueusie sévère.20,21 Ces symptômes peuvent être très éprouvants pour les patient·es.
La sécheresse buccale et la dysgueusie peuvent entraîner une réduction significative de la prise alimentaire ainsi qu’une perte de poids dès les premières semaines. Une bonne hydratation est recommandée contre la xérose, ainsi que des lotions à base de lactate d’ammonium sur les mains et les pieds (12%). Des produits durcisseurs peuvent être utilisés sur les ongles. Pour lutter contre la sécheresse buccale, il est recommandé d’humidifier la bouche et d’utiliser des substituts salivaires. Une consultation en nutrition est également judicieuse.21
Soutien apporté par le personnel infirmier APN
Dans de nombreux hôpitaux suisses, le personnel infirmier APN (Advanced Practice Nurses)22 est chargé d’accompagner les patient·es ayant reçu un traitement par cellules CAR-T. Il a pour mission d’assurer le suivi des patient·es et d’aider à la mise en œuvre du traitement. Leur contribution s’étend sur différentes phases du traitement et comprend une multitude de tâches et de responsabilités.23 Le recours au personnel infirmier APN est également judicieux dans le cadre d’un traitement par anticorps bispécifiques.
Les tâches du personnel infirmier APN comprennent les suivantes:
-
Information et conseil des patient·es et de leurs familles. Il aide à réduire les craintes et les incertitudes, ainsi qu’à prendre des décisions en connaissance de cause.
-
Coordination des soins: le personnel infirmier APN fait office d’interlocuteur privilégié et coordonne les différents aspects du traitement.
-
Soutien des équipes soignantes dans le suivi et la gestion du CRS ainsi que de l’ICANS.
-
Soutien tout au long du traitement: le personnel infirmier APN garantit la continuité tout au long de la phase de traitement, c’est-à-dire de la préparation jusqu’au suivi, en passant par le traitement.
-
Formation des patient·es à l’autogestion: le personnel infirmier APN forme les patient·es et leurs familles aux stratégies d’autogestion nécessaires pour poursuivre le traitement à domicile et éviter les complications.
-
Recherche et pratique fondée sur des preuves: le personnel infirmier APN participe à des projets de recherche visant à améliorer l’efficacité et la sécurité du traitement par cellules CAR-T. Il applique des pratiques fondées sur des preuves et contribue au développement des connaissances infirmières dans ce domaine spécialisé.
-
Soutien psychosocial: le personnel infirmier APN apporte également un soutien psychosocial aux patient·es et aux familles en leur offrant un soutien émotionnel, en leur donnant accès à des services de soutien et en les aidant à surmonter le stress lié au traitement.
Conclusion
Tant le traitement par cellules CAR-T que les anticorps bispécifiques sont de nouvelles formes de traitement très efficaces et prometteuses en hématologie. Leurs toxicités aiguës exigent une grande expertise de la part du personnel soignant et une collaboration multiprofessionnelle concertée. Grâce à une prise en charge globale et à leur expertise, le personnel infirmier APN contribue largement à l’amélioration des résultats des patient·es et à l’optimisation de la qualité des soins.
Littérature:
1 Bücklein VL et al.: CAR-T Zellen: Management von Nebenwirkungen. En ligne sur https://www.onkopedia.com/de/onkopedia/guidelines/car-t-zellen-management-von-nebenwirkungen . Consulté le 27/06/2024 2 Crombie JL et al.: Consensus recommendations on the management of toxicity associated with CD3×CD20 bispecific antibody therapy. Blood 2024; 143(16): 1565-75 3 Hayden PJ et al.: Management of adults and children receiving CAR T-cell therapy: 2021 best practice recommendations of the European Society for Blood and Marrow Transplantation (EBMT) and the Joint Accreditation Committee of ISCT and EBMT (JACIE) and the European Haematology Association (EHA). Ann Oncol 2022; 33(3): 259-75 4 Ellard R et al.: The EBMT immune effector cell nursing guidelines on CAR-T therapy: a framework for patient care and managing common toxicities. Clin Hematol Int 2022; 4(3): 75-88 5 Rizzi CC, Naegele M: Basale Stimulation bei CAR-T-Zell-Therapie. Anwendung des Konzepts und ganzheitliche Erfassung bei ICANS. Onkologiepflege 2024; 10(2): 36-7 6 Shah BD et al.: KTE-X19 for relapsed or refractory adult B-cell acute lymphoblastic leukaemia: phase 2 results of the single-arm, open-label, multicentre ZUMA-3 study. Lancet 2021; 398(10299): 491-502 7Schuster SJ et al.: Tisagenlecleucel in adult relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2019; 380(1): 45-56 8 Maude SL et al.: Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med 2018; 378(5): 439-48 9 Chari A et al.: Talquetamab, a G protein-coupled receptor family C group 5 member D x CD3 bispecific antibody, in patients with relapsed/refractory multiple myeloma (RRMM): phase 1/2 results from monumenTAL-1. Blood 2022; 140(Suppl. 1): 384-87 10 Moreau P et al.: Teclistamab in relapsed or refractory multiple myeloma. NEngl J Med 2022; 387(6): 495-505 11 Dickinson MJ et al.: Glofitamab for relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2022; 387(24): 2220-31 12Budde LE et al.: Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single-arm, multicentre, phase 2 study. Lancet Oncol 2022; 23(8): 1055-65 13Wang M et al.: KTE-X19 CAR T-cell therapy in relapsed or refractory mantle-cell lymphoma. N Engl J Med 2020; 382(14): 1331-42 14 Jacobson CA et al.: Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin lymphoma (ZUMA-5): asingle-arm, multicentre, phase 2 trial. Lancet Oncol 2022; 23(1): 91-103 15 Neelapu SS et al.: Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med 2017; 377(26): 2531-44 16 Locke FL et al.: Axicabtagene ciloleucel as second-line therapy for large B-cell lymphoma. N Engl J Med 2022; 386(7): 640-54 17Oluwole OO et al.: Prophylactic corticosteroid use in patients receiving axicabtagene ciloleucel for large B-cell lymphoma. Br J Haematol 2021; 194(4): 690-700 18 Kantarjian HM et al.: Blinatumomab versus chemotherapy for advanced acute lymphoblastic leukemia. N Engl J Med 2017; 376(9): 836-47 19 Gökbuget N et al.: Blinatumomab for minimal residual disease in adults with B-cell precursor acute lymphoblastic leukemia. Blood 2018; 131(14): 1522-31 20 Laheij AMGA, van de Donk NWCJ: Characterization of dysgeusia and xerostomia in patients with multiple myeloma treated with the T-cell redirecting GPRC5D bispecific antibody talquetamab. Support Care Cancer 2024; 32(1): 20 21 Mancia SS et al.: Characterization and management of oral and dermatological toxicities in patients receiving the CD3 X GPRC5D bispecific antibody talquetamab (JNJ-64407564) for the treatment of relapsed and/or refractory multiple myeloma. Blood 2021; 138(Suppl. 1): 1658 22 Naegele M: Advanced Nursing Practice in der klinischen Praxis. Leading Opinions Hämatologie & Onkologie 2022; 18(8): 26-28 23 Kisielewski D, Naegele M: Advanced practice nursing and CAR-T cell therapy: opportunities, challenges and future directions. Semin Oncol Nurs 2024; 40(3): 151628
Das könnte Sie auch interessieren:
«Palliative Care» et «End-of-Life Care»
Les gliomes de haut grade se caractérisent par une évolution rapide et souvent agressive de la maladie. En raison de leur mortalité, ils constituent d’emblée une maladie palliative. Ils ...
Nouvelles indications du T-DXd dans le BC, aucun bénéfice de l’atézolizumab dans l’OC
Les résultats de l’étude DESTINY-Breast06 soutiennent le trastuzumab déruxtécan en première ou deuxième ligne de traitement du cancer du sein (BC) HR+, HER2-(ultra)low. Dans l’étude ...
FLOT périopératoire par rapport à CROSS néoadjuvante en cas d’EC:télésurveillance en cas de NSCLC
L’étude ESOPEC a examiné la chimiothérapie périopératoire (FLOT) par rapport à la chimioradiothérapie néoadjuvante (CROSS) chez des patient·es atteint·es d’un adénocarcinome de l’ ...