HER2 comme cible thérapeutique dans les tumeurs gastro-intestinales
Auteur:
Prof. Dr méd. Florian Lordick
Universitäres Krebszentrum Leipzig (UCCL), Mitteldeutsches Comprehensive Cancer Center (CCCG) und Klinik für Innere Medizin II
Universitätsmedizin Leipzig
On observe une expression cliniquement pertinente de HER2 dans certaines tumeurs gastro-intestinales comme les cancers de l’estomac et du côlon, ce qui offre une cible thérapeutique pour des substances éprouvées et nouvelles.
La surexpression de HER2 est le marqueur prédictif évalué dans le cancer de l’estomac et le cancer de la jonction gastro-œsophagienne (GEJ) ayant le plus long historique. Dans le cas des cancers avancés de l’estomac et de la GEJ HER2-positifs, le trastuzumab, un inhibiteur de HER2, associé à la chimiothérapie, est un pilier thérapeutique établi depuis plus de dix ans. En plus de l’inhibition de la signalisation HER2-dépendante, le trastuzumab agit en activant les cellules effectrices immunitaires.1 De plus, le traitement entraîne une internalisation et une dégradation des récepteurs HER2.
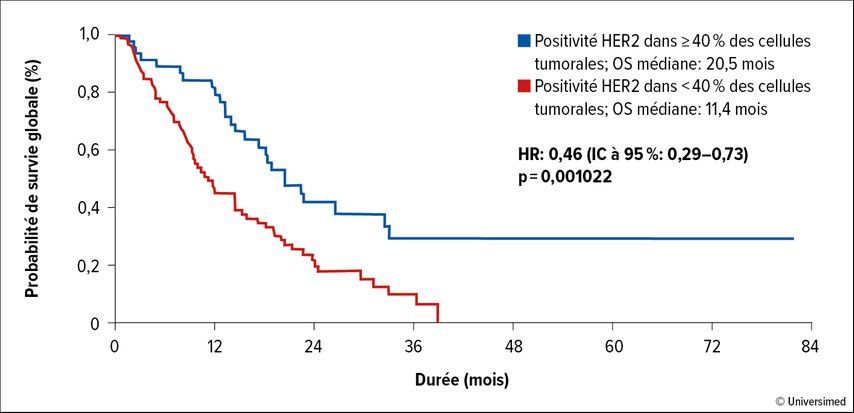
Toutefois, l’hétérogénéité intratumorale de l’expression de HER2, particulièrement marquée dans le cancer de l’estomac, pose des défis.2 Au fil du temps, le traitement ciblant HER2 peut entraîner une perte de HER2 et des aberrations de résistance, comme des amplifications de FGFR2 et de CCNE1.3 Une étude de réseau menée dans toute l’Allemagne a confirmé la fréquence de l’expression hétérogène de HER2.4 Il s’est également avéré que l’on ne peut s’attendre à un bénéfice clinique clair du trastuzumab que si l’expression de HER2 à la surface des cellules atteint au moins 40% des cellules. Dans ce groupe, la survie globale (OS) était nettement supérieure à celle obtenue avec une faible expression de HER2 (Fig. 1).
Fig.1: Survie globale (OS) sous trastuzumab dans le cancer de l’estomac métastatique avec coloration HER2 forte vs faible
T-DXd & zanidatamab
Les défis susmentionnés peuvent être surmontés, du moins en partie, grâce au conjugué anticorps-médicament trastuzumab déruxtécan (T-DXd), qui a été autorisé dans le cancer de l’estomac et de la GEJ HER2-positif après l’échec du trastuzumab. Une fois internalisé dans les cellules surexprimant HER2, le déruxtécan, inhibiteur de la topomérase I hautement cytotoxique, déploie ses effets non seulement à l’intérieur de la cellule HER2-positive, mais aussi dans son environnement immédiat (effet bystander).5 Dans l’étude asiatique DESTINY-Gastric01, le T-DXd administré en troisième ligne a montré une efficacité supérieure à celle de l’irinotécan ou du paclitaxel en termes de survie globale (OS; 12,5 vs 8,4mois; HR: 0,59; p=0,01) et de taux de réponse global (ORR; 43% vs 12%).6 L’étude à un bras DESTINY-Gastric02 a également donné un ORR >40% avec le T-DXd en deuxième ligne dans une population de patients occidentaux, ce qui est remarquable dans ce cadre.7 L’OS médiane était de 12,1mois. Il y avait également une grande cohérence entre les deux études en ce qui concerne les effets secondaires, la pneumonie potentiellement mortelle nécessitant la plus grande attention. Il faut garder à l’esprit que les patient·es sous T-DXd peuvent développer une pneumonie à tout moment.
L’anticorps biparatopique anti-HER2 zanidatamab – substance qui n’est pas encore autorisée – a montré des données prometteuses. Ici, la liaison se fait à deux domaines extracellulaires du récepteur HER2 au lieu d’un seul.8 Tout comme le trastuzumab, le zanidatamab inhibe la signalisation dépendante de HER2. Cependant, un autre effet important est une forte réaction immunitaire basée sur une cytotoxicité dépendante des anticorps et médiée par le complément. La première étude combinée dans le cancer de l’estomac a révélé un taux d’efficacité élevé avec l’association zanidatamab+chimiothérapie.9 La substance fait actuellement l’objet d’études de phase III.
Association de trastuzumab et d’immunothérapie
Les résultats de la recherche ont récemment fourni des arguments solides en faveur de la combinaison de l’immunothérapie et du traitement ciblant HER2. Le fait que les cancers de l’estomac HER2-positifs présentent plus souvent des cellules immunitaires infiltrées dans le stroma que les carcinomes HER2-négatifs plaide en faveur de cette hypothèse.10 De plus, une hyperrégulation de PD-L1 a été observée in vitro comme mécanisme potentiel de résistance au blocage de HER2 par le trastuzumab.11
L’étude KEYNOTE-811 a donc évalué le schéma pembrolizumab+trastuzumab et chimiothérapie dans le cancer de l’estomac HER2-positif avancé n’ayant pas encore été traité. Comparativement au schéma placebo+trastuzumab et chimiothérapie, il en est résulté des avantages en termes d’ORR (73% vs 60%) et de survie sans progression (PFS; 10,0 vs 8,1mois; HR: 0,73).12 L’évaluation finale et la présentation des données de l’OS sont attendues. Selon un communiqué de presse, le critère d’évaluation de l’OS est positif.13 Sur la base de ces données, le schéma pembrolizumab+trastuzumab et chimiothérapie ont été approuvés pour le traitement de première ligne du cancer de l’estomac/GEJ avancé HER2-positif avec expression de PD-L1. En cas de détection d’un PD-L1 CPS ≥1, l’association devrait être utilisée comme nouveau standard selon les lignes directrices actuelles de l’ESMO.14 Aucun effet n’est attendu en cas de PD-L1 négatif, raison pour laquelle il n’existe pas d’autorisation de mise sur le marché dans ce cas.
Autres sites GI
Les cancers des voies biliaires et de la vésicule biliaire peuvent également exprimer HER2. Les lignes directrices de l’ESMO recommandent l’évaluation de HER2 au stade avancé et suggèrent, en cas de surexpression de HER2, une bithérapie de deuxième ligne par trastuzumab et pertuzumab.15 De nouveaux développements sont attendus prochainement dans cette indication, par exemple l’utilisation de T-DXd.
Enfin, HER2 entre également en ligne de compte comme cible dans le cancer colorectal (CRC). Un groupe de recherche a évalué différentes substances ciblant HER2 dans le cadre d’un CCR HER2-positif ayant déjà fait l’objet d’un traitement, un taux d’efficacité de 30% ayant été obtenu avec le schéma trastuzumab+lapatinib.16 Le schéma trastuzumab/pertuzumab a également entraîné un taux d’efficacité de 32% dans une autre étude.17 Une conclusion importante de cette étude est que le schéma trastuzumab/pertuzumab n’est efficace qu’en présence d’un KRAS de type sauvage, car la mutation KRAS confère une résistance primaire aux substances ciblant HER2. Aux États-Unis, l’association tucatinib-trastuzumab a été approuvée dans le traitement des cancers colorectaux HER2-positifs et des cancers colorectaux métastatiques avec RAS de type sauvage surexprimant HER2 et réfractaires à d’autres traitements. Cette autorisation repose sur l’étude MOUNTAINEER, qui a montré dans cette indication un taux de réponse global de 38,1% avec l’association tucatinib/trastuzumab et une bonne tolérabilité globale.18
Selon l’étude DESTINY-CRC01, le T-DXd est également efficace dans le CRC HER2-positif métastatique et réfractaire avec RAS et BRAF de type sauvage: un taux d’efficacité de 45,3% a été rapporté, avec quelques rémissions de longue durée.19 Dans ce cas, seul·es les patient·es présentant une positivité HER2 évidente (IHC 3+ ou HIS 2+) ont obtenu des bienfaits significatifs. À partir de la troisième ligne, les lignes directrices de l’ESMO recommandent un test HER2 et un traitement ciblant HER2 en présence de RAS et BRAF de type sauvage.20
Littérature:
1 Hudis C et al.: Trastuzumab – mechanism of action and use in clinical practice. N Engl J Med 2007; 357(1): 39-51 2 Nakamura Y et al.: Biomarker-targeted therapies for advanced-stage gastric and gastro-oesophageal junction cancers: an emerging paradigm. Nat Rev Clin Oncol 2021; 18(8): 473-87 3 Kim ST et al.: Impact of genomic alterations on lapatinib treatment outcome and cell-free genomic landscape during HER2 therapy in HER2+ gastric cancer patients. Ann Oncol 2021; 29(4): 1037-48 4 Haffner I et al.: HER2 expression, test deviations, and their impact on survival in metastatic gastric cancer: Results from the prospective multicenter VARIANZ study. J Clin Oncol 2021; 39(13): 1468-78 5 Swain SM et al.: Multidisciplinary clinical guidance on trastuzumab deruxtecan (T-DXd)-related interstitial lung disease/pneumonitis-Focus on proactive monitoring, diagnosis, and management. Cancer Treat Rev 2022; 106: 102378 6 Shitara K et al.: Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer. N Engl J Med 2020; 382(25): 2419-30 7 Van Cutsem E et al.: Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study. Lancet Oncol 2023; 24: 744-56 8 Weisser NE et al.: An anti-HER2 biparatopic antibody that induces unique HER2 clustering and complement-dependent cytotoxicity. Nat Comm 2023; 14(1): 1394 9 Elimova E et al.: Zanidatamab + chemotherapy as first-line treatment for HER2-expressing metastatic gastroesophageal adenocarcinoma (mGEA). J Clin Oncol 2023; 41(Suppl_4): Abstr. #347 10 Aisa A et al.: Immune checkpoint inhibitors combined with HER-2 targeted therapy in HER-2 positive gastroesophageal cancer. Crit Rev Oncol Hematol 2022; 180: 103864 11 Chaganti BKR et al.: Trastuzumab upregulates PD-L1 as a potential mechanism of trastuzumab resistance through engagement of immune effector cells and stimulation of IFNγ secretion. Cancer Lett 2018; 430: 47-56 12 Janjigian YY et al.: Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023; 402(10418): 2197-208 13 www.merck.com/news/merck-announces-phase-3-keynote-811-trial-met-dual-primary-endpoint-of-overall-survival-os-as-first-line-treatment-in-patients-with-her2-positive-advanced-gastric-or-gastroesophageal-junction-gej 14 ESMO Gastric Cancer Living Guideline ( www.esmo.org/living-guidelines/esmo-gastric-cancer-living-guideline ) 15 Vogel A et al.: Biliary tract cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(2): 127-40 16 Sartore-Bianchi A et al.: Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17(6): 738-46 17 Meric-Bernstam F et al.: Pertuzumab plus trastuzumab for HER2-amplified metastatic colorectal cancer (MyPathway): an updated report from a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol 2019; 20(4): 518-30 18 Strickler JH et al.: Tucatinib plus trastuzumab for chemotherapy-refractory, HER2-positive, RAS wild-type unresectable or metastatic colorectal cancer (MOUNTAINEER): a multicentre, open-label, phase 2 study. Lancet Oncol 2023; 24(5): 496-508 19 Yoshino T et al.: Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer. Nat Commun 2023; 14(1): 3332 20 Cervantes A et al: Updated treatment recommendation for third-line treatment in advanced colorectal cancer from the ESMO Metastatic Colorectal Cancer Living Guideline. Ann Oncol 2024; 35(2): 241-3
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...