Selektion ist der Schlüssel in der Behandlung gastrointestinaler Tumoren
Bericht:
Dr. Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die molekulare Differenzierung innerhalb von Tumorentitäten hat insbesondere bezüglich der zielgerichteten Therapiestrategien zu neuen Behandlungsoptionen geführt. Die Immuntherapie hat ebenso Biomarker etabliert, die mit der Patient:innenselektion zu erhöhten Erfolgschancen führen. Beim diesjährigen ASCO Gastrointestinal Cancers Symposium (ASCO GI) wurden zudem bessere Therapieerfolge bei Kombination von etablierten Therapien gezeigt.
Hohe Effektivität der doppelten Immunblockade bei MSI-H/dMMR mCRC
Patient:innen mit metastasiertem Kolorektalkarzinom (mCRC) und hoher Mikrosatelliteninstabilität (MSI-H) oder Mismatch-Reparatur-Defizienz (dMMR) haben mit einer Standardchemotherapie, auch in Kombination mit einer zielgerichteten Therapie, eine schlechte Prognose. In der Phase-III-Studie CheckMate 8HW wurde die doppelte Immunblockade mit dem PD-1-gerichteten Antikörper Nivolumab und dem CTLA4-gerichteten Antikörper Ipilimumab bei Patient:innen mit MSI-high/dMMR mCRC untersucht. Erste Ergebnisse wurden auf dem ASCO GI vorgestellt.1 Die dreiarmige Studie verglich 2:2:1-randomisiert Nivolumab vs. Nivolumab+Ipilimumab vs. Chemotherapie nach Wahl der Behandelnden. 56 der Patient:innen im Chemotherapiearm erhielten zudem Bevacizumab und zehn Patient:innen Cetuximab. Die Studienmedikationen wurden bis zum Tumorprogress, bis zu nicht tolerierbarer Toxizität oder einer maximalen Dauer von zwei Jahren gegeben. Beim ASCO GI wurden Ergebnisse für die Erstlinientherapie im Vergleich zu der kombinierten Immuntherapie vs. Chemotherapiearm präsentiert.
In die zum ASCO GI ausgewerteten Studienarme wurden 202 bzw. 101 Patient:innen eingeschlossen. Das Alter lag bei median 62 bzw. 65 Jahren und 58% vs. 46% der Betroffenen waren jünger als 65 Jahre. 42% vs. 49% der Patient:innen waren im Stadium IV und bei 68% vs. 67% der Tumoren handelte es sich um einen rechtsseitigen Primarius. Bei 72% bzw. 79% der Patient:innen lag die PD-L1-Expression <1% und bei 23% der Patient:innen in beiden Studienarmen wurde ein BRAF/KRAS/NRAS-Wildtyp festgestellt. Bei 86% vs. 83% der Patient:innen war eine Tumorresektion durchgeführt worden.
Ein Drittel vs. 0% der Patient:innen komplettierten Nivolumab+Ipilimumab bzw. die Chemotherapie. Die mediane Dauer der Behandlung lag bei 13,5 Monaten im Immuntherapiearm vs. 4,0 Monate im Chemotherapiearm. 48% vs. 93% der Patient:innen brachen die Therapie ab, 19% vs. 69% aufgrund von Krankheitsprogress und 18% vs. 5% aufgrund von therapieassoziierten Nebenwirkungen.
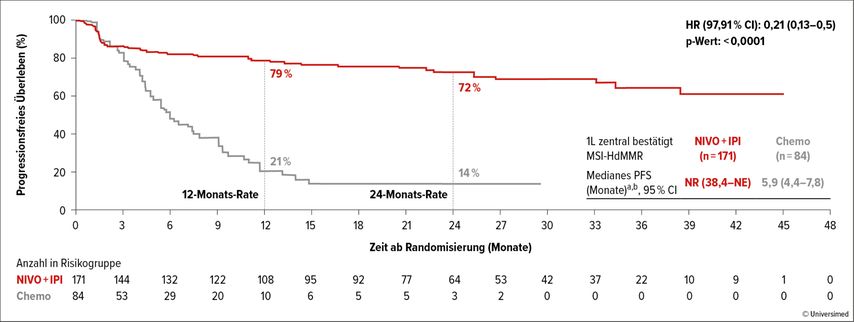
Die Studie erreichte ihren ersten dualen primären Endpunkt. Der Median für das progressionsfreie Überleben (PFS) war im Nivolumab+Ipilimumab-Arm noch nicht erreicht und betrug 5,9 Monate im Chemotherapiearm. Das Risiko für einen Progress war unter der doppelten Immunblockade um 79% niedriger im Vergleich zur Chemotherapie (HR: 0,21; 95% CI: 0,13–0,35; p<0,0001; Abb. 1).
Abb. 1: Progressionsfreies Überleben (PFS) unter Erstlinientherapie mit Nivolumab+Ipilimumab (Nivo+Ipi) vs. Chemotherapie (Chemo) bei MSI-H/dMMR mCRC. (modifiziert nach Thierry A et al.)1
Nach zwölf Monaten lebten 79% vs. 21% und nach 24 Monaten 72% vs. 14% der Patient:innen ohne Progress. Alle untersuchten Subgruppen zeigten ein signifikant verlängertes PFS unter der doppelten Immunblockade im Vergleich zur Chemotherapie. Das Sicherheitsprofil war für die beiden Studienarme unterschiedlich, insgesamt traten aber weniger häufig therapieassoziierte Nebenwirkungen Grad 3/4 unter Nivolumab+Ipilimumab im Vergleich zum Chemotherapiearm auf.
Die Ergebnisse stützen Nivolumab+Ipilimumab als eine Standard-Erstlinientherapie für Patient:innen mit MSI-H/dMMR mCRC, schlussfolgerten die Autor:innen.
Ösophaguskarzinom: Kombinationen für die erste Therapielinie
In der ersten Therapielinie bei Patient:innen mit Speiseröhrenkrebs hat sich die Kombination von Checkpoint-Inhibitoren und Chemotherapie bereits bewiesen. Die Ergebnisse der placebokontrollierten, randomisierten Phase-III-Studie KEYNOTE-590 zeigten einen Überlebensvorteil, wenn Pembrolizumab zusätzlich zur Chemotherapie gegeben wurde. Beim ASCO GI wurden die 5-Jahres-Daten der Studie sowie eine Subgruppenauswertung für das squamöse Ösophaguskarzinom (ESCC) präsentiert.2
Für die ITT-Population (n=652) betrug das mediane PFS 6,3 vs. 5,8 Monate (HR: 0,64; 95% CI: 0,54–0,75). Nach 60 Monaten lebten noch 5,5% der Patient:innen ohne Progress, aber 0% Patient:innen des Placeboarms. Das Gesamtüberleben (OS) betrug im Median 12,3 vs. 9,8 Monate (HR: 0,72; 95% CI: 0,62–0,84), mit einer 60-Monats-Rate von 10,6% vs. 3,0%. Die Ergebnisse für die ESCC-Population (n=548) waren vergleichbar mit der ITT-Population: Im Median lag das PFS bei 6,3 Monaten vs. 5,8 (HR: 0,65; 95% CI: 0,54–0,78) und das OS bei 12,6 Monaten vs. 9,8 (HR: 0,71; 95% CI: 0,60–0,85). Nach 60 Monaten lebten noch 6,7% vs. 0% der Patient:innen ohne Progress und 11,8% vs. 3,4% waren noch am Leben. Es sprachen 43,8% vs. 31,0% der ESCC-Population auf Pembrolizumab+Chemotherapie bzw. Placebo+Chemotherapie an, Patient:innen mit einem CPS ≥10 hatten ein Ansprechen in 51,1% vs. 28,0% der Fälle. Die Dauer des Ansprechens lag bei 9,1 Monaten vs. 6,1 (ESCC) bzw. 10,4 Monaten vs. 4,4 (ESCC/CPS ≥10).
Auch für den PD-1-Inhibitor Nivolumab in der Erstlinientherapie des fortgeschrittenen ESCC wurden beim ASCO GI neue Daten gezeigt.3 Insgesamt 970 Studienteilnehmer:innen erhielten in der dreiarmigen Phase-III-Studie CheckMate 648 Nivolumab+Ipilimumab, Nivolumab+Chemotherapie oder die alleinige Chemotherapie.
Es wurde für die beiden Nivolumab-haltigen Studienarme eine Verlängerung des OS gegenüber der Chemotherapie sowie eine erhaltene Lebensqualität gezeigt. In einer aktuellen Auswertung wurde die angepasste Qualität der Zeit ohne Symptome und Toxizität verglichen („quality-adjusted time without symptoms and toxicity“; Q-TWiST). Dazu wurde das OS aufgeteilt in die Zeit, in der Toxizität beobachtet wurde, die Zeit zwischen Tumorprogress und Versterben sowie die Zeit ohne Symptome oder Toxizität (TWiST). Ein Unterschied >1,1 Monate zwischen den drei Qualitätsgruppen wurde als klinisch relevant definiert.
Im Ergebnis zeigten Patient:innen im Nivolumab+Chemotherapiearm eine etwas längere Zeit mit Toxizität (1,4 Monate) im Vergleich zu Nivolumab+Ipilimumab (1,0 Monate) und Chemotherapie (0,9 Monate), aber auch die längste TWiST (8,0 vs. 6,6 vs. 5,8 Monate). Die Zeit zwischen Tumorprogress und Versterben lag in den drei Studienarmen bei 7,5 Monaten (Nivolumab+Chemotherapie), 9,0 Monaten (Nivolumab+Ipilimumab) und 7,3 Monaten (Chemotherapie). Mit einem Unterschied von 1,7 bzw. 1,3 Monaten zeigte sich ein relevanter Unterschied der Q-TWiST im Vergleich von Nivolumab+Chemotherapie wie auch Nivolumab+Ipilimumab gegenüber der alleinigen Chemotherapie.
Synergistische Therapie mit neuem Checkpoint-Inhibitor beim ESCC
Eine innovative Kombination für die Behandlung des ESCC besteht aus Tiragolumab+Atezolizumab+Chemotherapie.Tiragolumab ist ein monoklonaler Antikörper, der an den Rezeptor TIGIT auf T-Zellen und natürlichen Killerzellen bindet und damit die immunsupprimierende Interaktion mit dem Protein PVR blockiert.
Die synergistische Immunkombination mit Atezolizumab wurde in der randomisierten, doppelblinden, placebokontrollierten Phase-III-Studie SKYSCRAPER-08 für die Erstlinientherapie beim ESCC geprüft.4 Primäre Endpunkte waren das OS und das PFS. Eingeschlossen wurden 461 asiatische Patient:innen mit einem medianen Alter von 63,0 Jahren. 88–89% der Patient:innen wiesen einen positiven PD-L1-Status (TAP-Score ≥1%) auf und bei 20–23% lagen Lebermetastasen vor.
Die finalen OS-Ergebnisse bestätigen einen signifikanten Vorteil für die Immunkombination im Vergleich zur alleinigen Chemotherapie (HR: 0,70; 95% CI: 0,55–0,88; p=0,0024). Im Median lag das OS bei 15,7 Monaten vs. 11,1, nach 18 Monaten waren 47,2% vs. 33,8% der Patient:innen am Leben. Das PFS betrug median 6,2 vs. 5,4 Monate, mit einer 12-Monats-PFS-Rate von 24,0% vs. 6,1% (HR: 0,56; 95% CI: 0,45–0,70; p<0,0001). Subgruppenanalysen bestätigen den OS- und PFS-Vorteil durch Tiragolumab und Atezolizumab für alle untersuchten Subgruppen.
Es sprachen 59,7% vs. 45,5% der Patient:innen auf die Studienmedikation an, mit Komplettremissionen bei 11,5% vs. 3,2%. Die mediane Dauer des Ansprechens lag bei 7,1 Monaten vs. 4,3. Die zusätzliche Immuntherapie war insgesamt gut verträglich, mit Nebenwirkungen Grad 3/4 bei 68,0% vs. 61,2%, Grad 5 bei 5,7% vs. 4,8% und klinisch relevanten Nebenwirkungen bei 41,2% vs. 39,2% der Patient:innen. 19,7% vs. 10,6% der Patient:innen brachen Teile der Studienmedikation aufgrund von Nebenwirkungen ab.
Die Autor:innen resümierten, dass die Kombination von Tiragolumab, Atezolizumab und Chemotherapie einen neuen Standard für die Erstlinientherapie des lokal fortgeschrittenen, nicht resezierbaren oder metastasierten ESCC darstellen könnte.
Pankreaskarzinom: reduzierte Toxizität der Chemotherapie
Die randomisierte ALPACA-Studie (AIO-PAK-0114) untersuchte, ob mit der alternierenden Gabe von Gemcitabin+nab-Paclitaxel und Gemcitabin die Toxizität der Chemotherapie bei Patient:innen mit Adenokarzinom des Pankreas reduziert werden könnte.5 In die Studie wurden 325 Patient:innen aus 29 deutschen Zentren und Praxen eingeschlossen, die bis dato nicht in der metastasierten Situation behandelt worden waren.
In der Induktionsphase begannen 319 Patient:innen die Therapie für geplante drei Zyklen Gemcitabin+nab-Paclitaxel. 174 Patient:innen erreichten eine Stabilisierung der Erkrankung und wurden randomisiert, 167 starteten entweder die alternierende Therapie oder die kontinuierliche Behandlung mit Gemcitabin+nab-Paclitaxel. Mit der alternierenden Therapie wurden ein numerisch verlängertes PFS mit median 5,5 Monaten vs. 5,4 Monate (HR: 0,80; 95% CI: 0,58–1,11; p=0,18) und ein vergleichbares OS mit median 10,5 vs. 10,4 Monaten (HR: 0,90; 95% CI: 0,72–1,13; p=0,56) gegenüber der kontinuierlichen Behandlung beobachtet. Die Toxizität, insbesondere periphere Neuropathie (14,1% vs. 21,3%) und Infektionen (10,6% vs. 20,0%), war vorteilhafter unter der alternierenden Behandlung.
Leberzellkarzinom: TACE plus Durvalumab plus Bevacizumab
Bevacizumab+Durvalumab in Kombination mit einer transarteriellen Chemoembolisation (TACE) könnte, so die Ergebnisse der doppelblinden, placebokontrollierten Phase-III-Studie EMERALD-1, ein neuer Behandlungsstandard für Patient:innen mit nicht resezierbarem Leberzellkarzinom, aber mit Eignung für eine Embolisation sein.6 In der dreiarmigen Studie erhielten insgesamt 616 Patient:innen entweder Durvalumab+TACE gefolgt von Durvalumab+Placebo (Arm A), Durvalumab+TACE gefolgt von Durvalumab+Bevacizumab (Arm B) oder Placebo+TACE gefolgt von Placebo+Placebo (Arm C). Primärer Studienendpunkt war das PFS im Vergleich der Studienarme B und C. Die Anzahl der TACE bestand aus 1–4 Prozeduren innerhalb von 16 Wochen, nach Ermessen der Behandelnden.
Im Median wurde die systemische Kombinationstherapie 14 Wochen nach der ersten TACE-Dosis begonnen. Die Mehrheit der Patient:innen erhielt ein bis zwei TACE-Prozeduren.
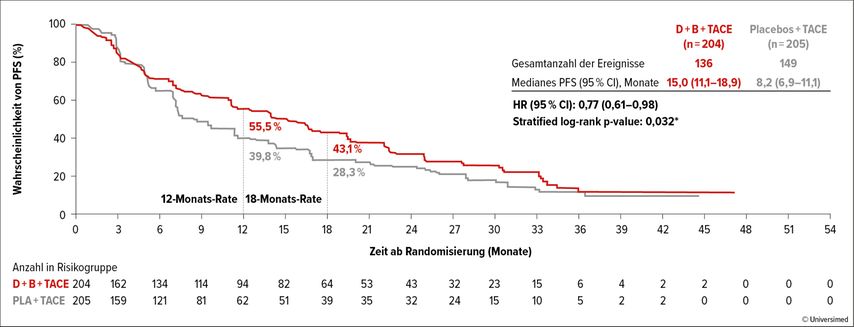
Im Ergebnis wurde das mediane PFS um 6,8 Monate mit Durvalumab+Bevacizumab im Vergleich zum Arm mit doppeltem Placebo verlängert (15,0 vs. 8,2 Monate). Das Risiko für einen Progress wurde um 23% signifikant reduziert (HR: 0,77; 95% CI: 0,61–0,98; p=0,032). Nach zwölf Monaten lag die PFS-Rate bei 55,5% vs. 39,8% und nach 18 Monaten bei 43,1% vs. 28,3% (Abb. 2). Im Gegensatz dazu waren die Kaplan-Meier-Kurven im Vergleich von Arm A und C nicht statistisch verschieden (HR: 0,94; 95% CI: 0,75–1,19; p=0,638).
Abb. 2: Progressionsfreies Überleben (PFS) unter Durvalumab+Bevacizumab+TACE (D+B+TACE) vs. Placebo+Placebo vs. TACE. (modifiziert nach Lencioni R et al.)6
Die Zeit bis zur Progression (TTP) betrug median 22,9 (Arm A) vs. 11,5 (Arm B) vs. 10,0 Monate (Arm C) mit einer Hazard-Ratio von 0,63 im Vergleich von Arm A und C (95% CI: 0,48–0,82). Ein Ansprechen wurde bei 43,6% vs. 41,0% vs. 29,6% der Patient:innen beobachtet, bei einer medianen Dauer des Ansprechens von 22,1 Monaten vs. 14,0 vs. 16,4 Monate. Das Nebenwirkungsprofil entsprach den bekannten Daten für Durvalumab, Bevacizumab und TACE.
Die Autor:innen resümierten, dass die Kombination von Durvalumab+Bevacizumab und TACE ein neuer Standard für das nicht resektable Leberzellkarzinom sein könnte.
Quelle:
ASCO Gastrointestinal Cancers Symposium (ASCO GI), 18.–20. Jänner 2024, San Francisco, USA
Literatur:
1 Thierry A et al.: Nivolumab plus ipilimumab vs chemotherapy as first-line treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer: first results of the CheckMate 8HW study. ASCO GI 2024; Abstr. #LBA768 2 Shah MA et al.: First-line pembrolizumab plus chemotherapy for advanced esophageal cancer: 5-year outcomes from the phase 3 KEYNOTE-590 study. ASCO GI 2024; Abstr. #250 3 Chau I et al.: A quality-adjusted time without symptoms and toxicity (Q-TWIST) analysis comparing nivolumab plus ipilimumab or nivolumab plus chemotherapy vs. cemotherapy in patients with advanced esophageal squamous cell carcinoma: CheckMate 648. ASCO GI 2024; Abstr. #251 4 Hsu CH et al.: SKYSCRAPER-08: A phase III, randomized, double-blind, placebo-controlled study of first-line triagolumab + atezolizumab and chemotherapy in patients with esophageal squamous cell carcinoma (ESCC). ASCO GI 2024; Abstr. #245 5 Dorman K et al.: Alternating application of gemcitabine/nab-paclitaxel (Gem/nab-Pac) and Gem monotherapy or continuous application of Gem/nab-Pac after induction treatment for first-line treatment of metastatic pancreatic cancer: first results from the randomized phase 2 ALPACA study from the German AIO study group (AIO-PAK-0114). ASCO GI 2024; Abstr. #605 6 Lencioni R et al.: EMERALD-1: a phase 3, randomized, placebo-controlled study of transarterial chemoembolization combined with durvalumab with or without bevacizumab in participants with unresectable hepatocellular carcinoma eligible for embolization. ASCO GI 2024; Abstr. #LBA432
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...