Neue Therapiestandards, Kombinationstherapien und optimale Sequenzierung
Bericht:
Mag. pharm. Irene Senn, PhD
Der European Lung Cancer Congress (ELCC) fand von 20. bis 23. März in Prag statt. Ein starker Fokus lag auch in diesem Jahr auf immunologischen und zielgerichteten Therapien. Im Folgenden wird eine Auswahl von aktuellen Studienergebnissen erläutert, die das Potenzial haben, die Therapielandschaft künftig nachhaltig zu prägen.
NSCLC im Frühstadium
Perioperatives Tislelizumab: chirurgische Ergebnisse
Obwohl bei Patient:innen mit resektablem nichtkleinzelligem Bronchialkarzinom (NSCLC) im Frühstadium eine Operation die wirksamste Erstbehandlung ist, ist die 5-Jahres-Tumorrezidivrate immer noch inakzeptabel hoch. Effektive neoadjuvante und adjuvante Strategien sind daher dringend erforderlich. Die Studie RATIONALE-315 evaluierte die Effektivität und Sicherheit von perioperativem Tislelizumab (TIS) in Kombination mit neoadjuvanter Chemotherapie (CT) bei Patient:innen mit resektablem NSCLC im Stadium II–IIIA. In die Studie wurden 453 Patient:innen eingeschlossen, die randomisiert entweder TIS+CT oder Placebo+CT erhielten, gefolgt von einer Operation und adjuvanter Therapie (TIS oder Placebo). Am European Lung Cancer Congress 2024 (ELCC24) wurden nun die chirurgischen Ergebnisse präsentiert.
Im TIS-Arm kam es zu deutlich weniger Pneumektomien (8,4% vs. 12,1%). Die R0-Resektionsrate (95,3% vs. 93,1%) sowie die mediane Anzahl der entfernten Lymphknoten (18 vs. 16) waren in beiden Gruppen ähnlich hoch. Die mediane Zeit zwischen der letzten neoadjuvanten Dosis und der Operation lag bei 5,5 vs. 5,3 Wochen und auch bei den postoperativen Komplikationen gab es keine signifikante Diskrepanz zwischen den beiden Gruppen (63,7 vs. 61,3%). TIS zeigt somit Potenzial, das Ansprechen zu verbessern, ohne die Durchführbarkeit oder Vollständigkeit der chirurgischen Interventionen negativ zu beeinflussen.1
Fortgeschrittenes, inoperables NSCLC
PACIFIC-2 erreicht Endpunkte nicht
Dass mehr nicht immer mehr ist, zeigten die am ELCC24 veröffentlichten Daten zur PACIFIC-2-Studie. Das Hinzufügen von Durvalumab (DUR) zur Chemoradiotherapie (CRT) brachte keine Vorteile hinsichtlich der Ansprechrate (ORR), des progressionsfreien (PFS) oder des Gesamtüberlebens (OS) für Patient:innen mit lokal fortgeschrittenem, inoperablem NSCLC im Stadium III.
Die Phase-III-Studie verglich die Wirksamkeit von DUR+CRT gefolgt von einer Konsolidierungsbehandlung mit DUR, gegenüber CRT allein gefolgt von Placebo. Zwischen den beiden Gruppen konnten keine statistisch signifikanten Unterschiede hinsichtlich ORR (60,7 vs. 60,6%), PFS (13,8 vs. 9,4 Monate; HR 0,85) und OS (36,4 vs. 29,5 Monate; HR 1,03) gefunden werden.2 Die Ergebnisse unterstreichen, dass das ursprüngliche PACIFIC-Regime, bestehend aus CRT gefolgt von DUR-Konsolidierung, weiterhin der Behandlungsstandard für diese Patient:innen bleibt.3,4
Neue Kombinationen bei EGFR-mutiertem NSCLC
Mehrere Präsentationen beschäftigten sich damit, wie sich in Zukunft die Therapielandschaft beim EGFRmut-NSCLC verändern könnte.
Osimertinib-Kombinationstherapie
Die FLAURA-2-Studie untersucht die Wirksamkeit der Kombination von Osimertinib mit platinbasierter CT (OSI+CT) im Vergleich zu OSI allein bei Patient:innen mit fortgeschrittenem EGFRmut-NSCLC. Die positiven PFS-Daten aus dieser Studie wurden bereits bei der World Conference on Lung Cancer (WCLC) 2023 vorgestellt: Unter der Kombinationstherapie zeigte sich eine signifikante Verlängerung des medianen PFS um 38% (25,5 vs. 16,7 Monate).5
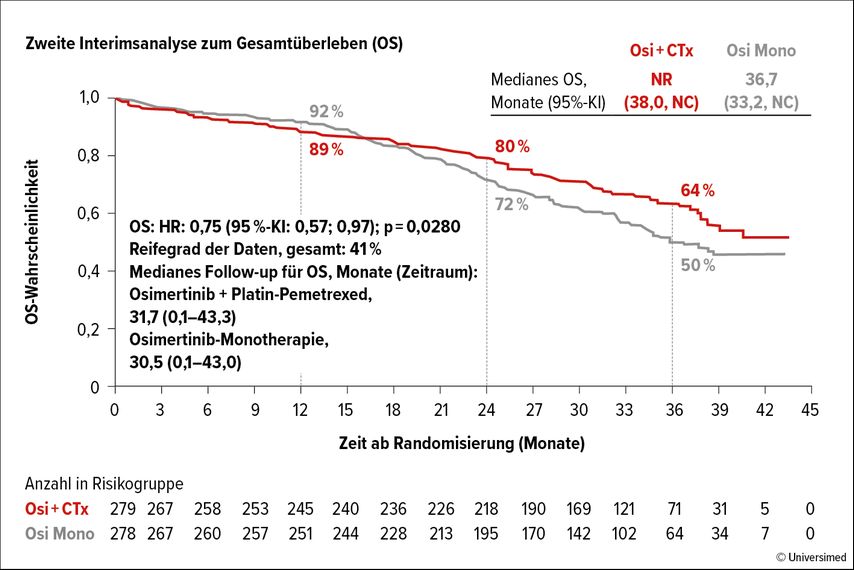
Die am ELCC24 präsentierten Resultate bestätigen, dass sich OSI+CT auch nach Fortschreiten der Erkrankung als vorteilhaft erweist. Es wurden eine längere Zeit bis zur ersten (30,7 vs. 25,4 Monate) und zweiten Folgetherapie sowie ein längeres zweites PFS (PFS2) berichtet. Zudem wurde eine zweite Zwischenanalyse der OS-Daten nach etwa 30 Monaten Nachbeobachtung präsentiert. Sie zeigen einen Trend zugunsten der Kombinationstherapie (HR 0,75); das vorgegebene Niveau der statistischen Signifikanz konnte jedoch nicht erreicht werden (Abb. 1).6
Abb. 1: Zweite Zwischenanalyse der OS-Daten der FLAURA-2-Studie nach etwa 30 Monaten Nachbeobachtung (modifiziert nach Valdiviezo Lama N et al.)6
Amivantamab-Kombinationstherapie
Die Studie MARIPOSA-2 vergleicht die Kombination aus Amivantamab plus CT (AMI+CT) mit oder ohne Lazertinib (LAZ) mit einer alleinigen CT bei Patient:innen mit EGFRmut metastasiertem NSCLC, die nach OSI einen Progress erfahren haben. Zuvor hatte diese Studie einen signifikanten PFS-Vorteil unter AMI+CT vs. alleinige CT gezeigt (HR 0,48).7 Am ELCC24 wurde nun die Post-Progression-Analyse präsentiert. Die Zugabe von AMI zur CT nach der Krankheitsprogression konnte im Vergleich zur alleinigen CT die Zeit bis zum Abbruch der Behandlung (11,0 vs. 4,5 Monate; HR 0,37), die Zeit bis zur Folgetherapie (HR 0,42) und das PFS2 (HR 0,60) signifikant verlängern. Darüber hinaus konnten fast zwei Drittel der Patient:innen in der Studie eine Folgetherapie erhalten, was wichtig ist, wenn man eine Drittlinientherapie für diese Gruppe in Betracht zieht. Die zusätzliche Gabe von AMI ging mit einer höheren Rate hämatologischer Toxizität einher, die jedoch hauptsächlich auf den ersten Behandlungszyklus beschränkt war.8
Amivantamab: wirksam trotz Dosisunterbrechung
Die am ELCC24 vorgestellte explorative Analyse der MARIPOSA-Studie zeigte, dass eine frühzeitige Unterbrechung der Erstlinienbehandlung mit AMI+LAZ aufgrund unerwünschter Ereignisse keine negativen Auswirkungen auf die Behandlungsergebnisse hat. Bei etwa der Hälfte der Patient:innen, die in dieser Studie die Kombinationstherapie erhielten, musste die AMI-Dosis während der ersten vier Therapiemonate unterbrochen werden. Interessanterweise zeigte sich jedoch, dass das PFS dieser Patient:innen ähnlich war wie das PFS von Patient:innen ohne Dosisunterbrechung (27,5 vs. 25,7 Monate). Diese Analyse deutet also darauf hin, dass Dosisunterbrechungen ein wirksames Mittel sind, um Nebenwirkungen unter AMI+LAZ zu kontrollieren, ohne das PFS zu beeinträchtigen.9
„EGFR exon-20 insertion“- mutiertes NSCLC
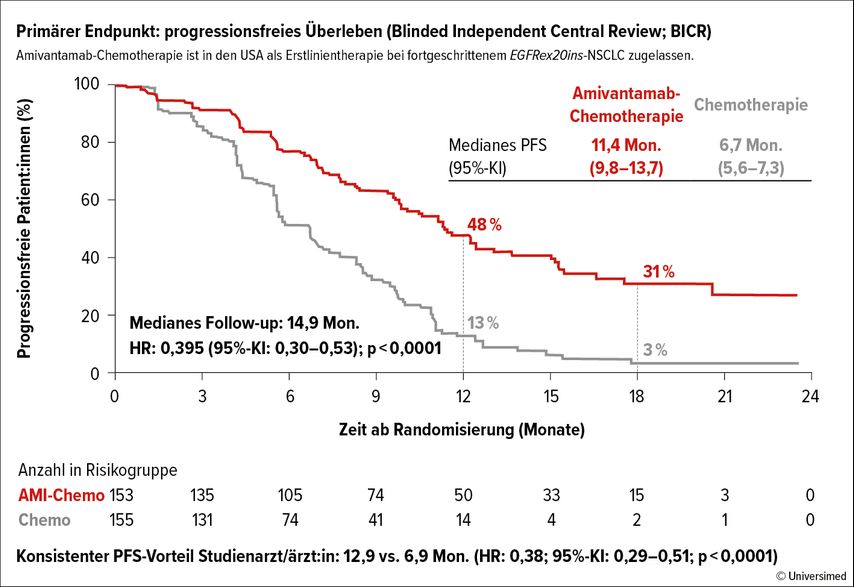
Die PAPILLON-Studie untersuchte den Nutzen von Amivantamab (AMI) in Kombination mit CT bei „EGFR exon-20 insertion“(EGFRex20ins)-mutiertem fortgeschrittenem NSCLC. Die Hinzunahme von AMI zur Erstlinien-CT führte im Vergleich zur alleinigen CT zu einer signifikanten Verlängerung des PFS (11,4 vs. 6,7 Monate; HR 0,395) (Abb. 2).
Abb. 2: Die Addition von Amivantamab zur Erstlinien-CT in der PAPILLON-Studie verlängerte im Vergleich zur alleinigen CT das PFS signifikant (modifiziert nach Felip E et al.)10
Weiters verlängerten sich die Zeit bis zum Abbruch der Behandlung (13,2 vs. 7,5 Monate; HR: 0,38) und die Zeit bis zur nächsten Systemtherapie (17,7 vs. 9,9 Monate; HR: 0,35).10 AMI+CT stellt damit den neuen Standard in der Erstlinie für Patient:innen mit EGFRex20ins-NSCLC im fortgeschrittenen oder metastasierten Stadium dar und wurde am 1. März 2024 von der FDA in dieser Indikation zugelassen (in Kombination mit CT sowie als Monotherapie nach Progression).11
Vielversprechende Daten zu subkutanen Formulierungen
Die Vorteile einer subkutanen (s.c.) Applikation liegen auf der Hand: weniger infusionsbedingte Reaktionen (IRR), weniger Klinikbesuche und ein höherer Behandlungskomfort für die Patient:innen. Am ELCC wurden zwei Studien präsentiert, die sich mit s.c. Formulierungen von onkologischen Immuntherapien beschäftigen.
Subkutanes Amivantamab
Nach intravenöser Verabreichung von Amivantamab (AMI) treten bei 67% der Behandelten IRR auf, was zur Folge hat, dass die erste Dosis über zwei Tage verteilt verabreicht werden muss.12 Aus diesem Grund wurde eine subkutane Formulierung von AMI entwickelt, die in der Phase-Ib-Studie PALOMA evaluiert wird. Die Studie bestätigte bereits zuvor, dass mittels der s.c. Formulierung eine ähnliche Arzneimittelexposition erreicht werden kann wie durch die zugelassene i.v. Dosis, während IRR signifikant seltener (16%) auftreten und weniger schwerwiegend sind. Ein entscheidender Vorteil dieser Formulierung ist zudem die deutlich verkürzte Verabreichungszeit von nur 7–10 Minuten.
Weitere Analysen der PALOMA-Studie zeigten nun, dass AMI alle vier Wochen (q4w) subkutan verabreicht werden kann, ohne dass die Wirksamkeit beeinträchtigt wird (anstatt alle zwei oder drei Wochen für zwei bis vier Stunden). Die IRR-Inzidenz blieb mit 16% unverändert und beschränkte sich auf Reaktionen der Grade 1–2 nach der ersten Dosis. Eine q4w-Dosis von 3520mg (≥80kg: 4640mg) erzielte eine ähnliche Exposition wie die zugelassene IV-Dosis.13
Subkutanes Atezolizumab
Dass die s.c. Gabe auch von Patient:innen bevorzugt wird, bestätigten die am ELCC24 vorgestellten Ergebnisse aus der IMscin002-Cross-over-Studie. Diese erreichte ihren primären Endpunkt: 70,7% der Patient:innen gaben an, Atezolizumab s.c. zu bevorzugen, verglichen mit 21,1% mit einer Präferenz für Atezolizumab i.v. nach jeweils drei Zyklen. Die Hauptgründe für die Präferenz waren der kürzere Zeitaufwand in der Klinik (64,4%), angenehmeres Empfinden (46,0%) und weniger emotionale Belastung (29,9%). Nach jeweils drei Zyklen wählten die Patient:innen die von ihnen bevorzugte Verabreichungsart für die Fortsetzung der Behandlung, und mehr als drei Viertel (79,4%) entschieden sich für die s.c. Verabreichung.14 Im vergangenen Jahr zeigten die Ergebnisse der IMscin001-Studie, dass die s.c. und die i.v. Therapie mit Atezolizumab bei Patient:innen mit NSCLC eine vergleichbare Exposition, Wirksamkeit und Sicherheit aufweisen.15 Dies führte zur weltweit ersten Einführung eines s.c. Anti-PD-(L)1-Wirkstoffs durch das NHS in England.
Neues beim SCLC
Ergänzende Strahlentherapie in der Erstlinie
Beim kleinzelligen Lungenkarzinom im extensiven Stadium (ES-SCLC) hat sich die Kombination aus Durvalumab (DUR) mit CT (Etoposid+Platin) als Erstlinienstandard etabliert.16 In der Phase-II-Studie LEAD wird nun das Potenzial einer zusätzlichen niedrig dosierten Strahlentherapie (LDRT, 15Gy/5f) zur Verbesserung der Immunantwort untersucht. Die am ELCC24 vorgestellten Ergebnisse deuten darauf hin, dass eine zusätzliche LDRT synergistisch wirken kann, ohne die Toxizität zu erhöhen. Die objektive Ansprechrate (ORR) betrug 86,7%; alle drei Patient:innen mit ZNS-/Hirnmetastasen in der Studie erreichten ein partielles Ansprechen. Die mediane Ansprechdauer (DOR) lag bei 7 Monaten. Bei einer medianen Nachbeobachtungszeit von 17,3 Monaten betrug das mediane PFS 8,3 Monate; das mediane OS wurde nicht erreicht. Die Kombination der LDRT mit DUR+CT wurde im Allgemeinen gut toleriert.17 Diese Resultate unterstützen eine weiterführende Untersuchung dieser Behandlungskombination.
Tarlatamab: aussichtsreicher T-Zell-Engager
Bei Versagen der ersten Chemoimmuntherapie sind die Behandlungsoptionen für Patient:innen mit SCLC begrenzt. Der Delta-like-Ligand 3 (DLL3) ist ein potenzielles therapeutisches Ziel, da er auf der Oberfläche von SCLC-Zellen abnormal exprimiert wird. Der bispezifische T-Zell-Engager (BiTE®) Tarlatamab ist die erste auf DLL3 abzielende Immuntherapie, die klinisch geprüft wird.18 Die am ELCC24 präsentierten Langzeitergebnisse der Phase-I-Studie DeLLphi-300 zeigen eine hohe Rate an dauerhaftem Ansprechen, ein medianes Überleben von 17,5 Monaten und eine vielversprechende intrakranielle Aktivität in einer Kohorte von 152 Patient:innen mit vorbehandeltem ES-SCLC. Die Follow-up-Daten fanden zudem keine neuen Sicherheitssignale.19
Quelle:
European Lung Cancer Congress, 20.–23. März 2024, Prag (Tschechien)
Literatur:
1 Yue D et al.: Surgical outcomes from RATIONALE-315: randomized, double-blind, phase III study of perioperative tislelizumab with neoadjuvant chemotherapy in resectable NSCLC (Abstr. #1080). Ann Oncol 2024; 9(Suppl. 3): 1-10 2 Bardley J et al.: Durvalumab in combination with chemoradiotherapy for patients with unresectable stage III NSCLC: final results from PACIFIC-2. Ann Oncol 2024; 9(Suppl. 3): 1-53 3 Antonia SJ et al.: Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. NEJM 2017; 377(20): 1919-29 4 Remon J et al.: Early and locally advanced non-small-cell lung cancer: an update of the ESMO Clinical Practice Guidelines focusing on diagnosis, staging, systemic and local therapy. Ann Oncol 2021; 32(12): 1637-42 5 Planchard D et al.: Osimertinib with or without chemotherapy in EGFR-mutated advanced NSCLC. NEJM 2023; 389(21): 1935-48 6 Valdiviezo Lama N et al.: First-line (1L) osimertinib (osi) ± platinum-pemetrexed in EGFR-mutated (EGFRm) advanced NSCLC: FLAURA2 post-progression outcomes. Ann Oncol 2024; 9(Suppl. 3): 1-53 7 Passaro A et al.: Amivantamab plus chemotherapy (with or without lazertinib) vs chemotherapy in EGFR-mutated advanced NSCLC after progression on osimertinib: MARIPOSA-2, a phase III, global, randomized, controlled trial. Ann Oncol 2023; 34(Suppl. 2): S1254-S335 8 Gentzler R et al.: Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutant advanced NSCLC after progression on osimertinib: a post-progression analysis of MARIPOSA-2. Ann Oncol 2024; 9(Suppl. 3): 1-53 9 Garcia Campelo MR et al.: Effect of amivantamab dose interruptions on efficacy and safety of first-line amivantamab plus lazertinib in EGFR-mutant advanced NSCLC: exploratory analyses from the MARIPOSA study. Ann Oncol 2024; 9(Suppl. 3): 1-53 10 Felip E et al.: Amivantamab plus chemotherapy vs chemotherapy as first-line treatment in EGFR exon 20 insertion–mutated advanced NSCLC: analysis of post-progression endpoints from PAPILLON. Ann Oncol 2024; 9(Suppl. 3): 1-53 11 www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-amivantamab-vmjw-egfr-exon-20-insertion-mutated-non-small-cell-lung-cancer-indications (abgerufen am 1.4.2024) 12 Minchom AR et al.: Subcutaneous amivantamab (ami) in patients (pts) with advanced solid malignancies: the PALOMA study—updated safety and identification of the recommended phase 2 dose. JClin Oncol 2023; 41(Suppl. 16) 13 Leighl N et al.: Subcutaneous amivantamab administered every 4 weeks (Q4W) in patients with advanced solid malignancies: the phase 1b PALOMA study. Ann Oncol 2024; 9(Suppl. 3): 1-53 14 Cappuzzo F et al.: Primary results from IMscin002: a study to evaluate patient (pt)- and healthcare professional (HCP)-reported preferences for atezolizumab (atezo) subcutaneous (SC) vs intravenous (IV) for the treatment of NSCLC. Ann Oncol 2024; 9 (Suppl. 3): 1-53 15 Burotto M et al.: IMscin001 part 2: a randomised phase III, open-label, multicentre study examining the pharmacokinetics, efficacy, immunogenicity, and safety of atezolizumab subcutaneous versus intravenous administration in previously treated locally advanced or metastatic non-small-cell lung cancer and pharmacokinetics comparison with other approved indications. Ann Oncol 2023; 34(8): 693-702 16 Paz-Ares L et al.: Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394(10212): 1929-39 17 Zhang Y et al.: Phase II study of low-dose radiation (LDRT) plus durvalumab (D) and etoposide/platinum/EP) as first-line treatment in ES-SCLC (LEAD): efficacy and safety results. Ann Oncol 2024; 9(Suppl. 3): 1-11 18 Giffin MJ et al.: AMG 757, a half-life extended, DLL3-targeted bispecific t-cell engager, shows high potency and sensitivity in preclinical models of small-cell lung cancer. Clin Cancer Res 2021; 27(5): 1526-37 19 Hummel HD et al.: Tarlatamab in previously treated small cell lung cancer (SCLC): DeLLphi-300 phase I study long-term outcomes and intracranial activity. Ann Oncol 2024; 9(Suppl. 3): 1-11