«Der Infarkt beginnt im Bein» – Ein Blick auf die Prognose der PAVK
Autoren:
Dr. med. Lili Sike
Assistenzärztin
Dr. med. Thorsten Grumann
Leitender Arzt
Abteilung Angiologie, Department Medizin, Luzerner Kantonsspital
Spitalstrasse, 6000 Luzern 16
E-Mail: thorsten.grumann@luks.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die periphere arterielle Verschlusskrankheit (PAVK) ist unterschätzt, unterdiagnostiziert und bleibt häufig unentdeckt. Dabei gehört sie inzwischen zu den häufigsten Erkrankungen des höheren Alters und hat einen pandemischen Charakter angenommen. In der überwiegenden Anzahl der Fälle (>90%) wird die chronische PAVK durch Arteriosklerose verursacht, akute, damit oft auch symptomatische Formen, mehrheitlich durch Atherothrombose.
Keypoints
-
Die PAVK hat einen pandemischen Charakter angenommen. Die Prävalenz nimmt weltweit zu, im letzten Jahrzehnt um 22%, in Europa am stärksten.
-
ABI, TBI und Zehendruck sind wichtige prognostische Parameter: Je niedriger der ABI, desto höher die kardiovaskuläre Morbidität und Mortalität.
-
PAVK, DM und CKD – das «infernalische Trio»: Die PAVK ist häufiger, wird früher manifest und zeigt einen rascheren Progress in höhere, kritische Stadien, verbunden mit einem vielfach erhöhten Risiko für MACE und einer drastischen Abnahme des amputationsfreien Überlebens.
-
Die fehlende Awareness, die ausbleibende Diagnosestellung und der damit verbundene therapeutische Nihilismus sind alarmierend.
-
«Window of opportunity»: Die Früherkennung der PAVK erlaubt eine rechtzeitige konsequente Behandlung der kvRF, welche eine Progression der Erkrankung hinauszögern kann.
-
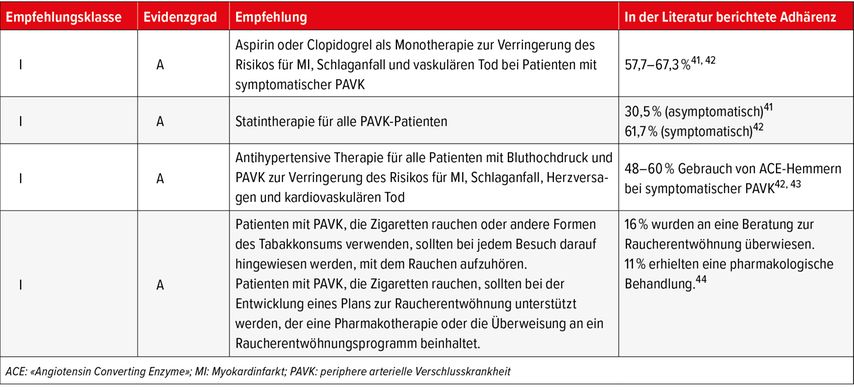
Die Umsetzung von 4 evidenzbasierten Empfehlungen aus den aktuellen internationalen Leitlinien kann die Rate an MACE mehr als dritteln und die von MALE halbieren: 1. Aspirin oder Clopidogrel als Monotherapie bei symptomatischer PAVK; 2. Statintherapie; 3.antihypertensive Therapie, bevorzugt RAS-Inhibitoren;4. Rauchstopp.
Die Arteriosklerose ist ein schleichender, komplexer Krankheitsprozess. Er schreitet «leise», meist ohne Kenntnis der Betroffenen voran. So hat z.B. nur eine von vier Personen mit PAVK auch typische Symptome, wie eine Claudicatio intermittens (CI). Das wird umso gefährlicher, wenn zusätzlich andere Gefässregionen betroffen sind. Denn auch schwerwiegende Ereignisse wie Herzinfarkt und Schlaganfall sind lediglich unterschiedliche Manifestationsformen ein- und derselben Erkrankung. Sie sind verbunden mit einer hohen Sterblichkeit. Eine fehlende Abklärung und Diagnose bedeuten also, einen vorbeugenden Ansatz zu verpassen.
Gerade bei der PAVK klaffen Lücken in Prävention, Früherkennung und Therapie. Eindrücklich konnte das in einer aktuellen Studie aus England gezeigt werden, in der man die Inzidenz der koronaren Herzerkrankung (KHK) und der PAVK zwischen den Jahren 2006 und 2015 analysiert hat. Hierzu verwendete man elektronische Daten des Gesundheitssystems von 4,6 Millionen Personen. Während die kardiovaskuläre Mortalität bei Patienten mit KHK in diesem Zeitraum um 43% abnahm, blieb sie bei Patienten mit PAVK weitgehend unverändert. Diesen Unterschied führte man vor allem auf die frühere Diagnostik und Verbesserung der Therapie des akuten Koronarsyndroms zurück.1
Bei der PAVK stellt sich somit die Frage nach «Awareness».
Braucht es im klinischen Alltag einen Blick auf die PAVK?
Die PAVK hat eine globale Dimension. Sie ist nach der KHK und dem Schlaganfall die dritthäufigste Ursache für atherosklerotische Morbidität. Im Jahr 2015 lebten 237 Millionen Menschen im Alter von ≥25 Jahren mit einer PAVK (5,6%). Damit hat ihre Prävalenz seit 2010 um 22% zugenommen und ist in Europa mit knapp 8% am höchsten, allen voran in Deutschland (10,7%).2 Mit der Überalterung der Bevölkerung wird die Bedeutung der PAVK weiter zunehmen. Nach Szenarien zur Bevölkerungsentwicklung der Kantone in der Schweiz geht das Bundesamt für Statistik davon aus, dass sich der Anteil der über 60-Jährigen bis 2045 verdoppeln, der Anteil der über 80-Jährigen sogar verdreifachen wird.3
Liegt die Prävalenz der PAVK im Alter von 40 bis 44 Jahren bei circa 5%, ist in der Altersgruppe 65+ jede fünfte Person (20%) davon betroffen. Liegen zusätzliche kardiovaskuläre Risikofaktoren vor, allen voran Nikotinkonsum und Diabetes mellitus (DM), aber auch Dyslipidämie, arterielle Hypertonie und Übergewicht, erhöht sich das relative Risiko bzw. die Chance für eine PAVK um ein Vielfaches. So weisen 29% der Patienten mit Diabetes mellitus bereits im Alter von 50 Jahren eine PAVK auf. Das Risiko, sie zu entwickeln, ist um das 2- bis 3-Fache erhöht.4 Auch die Stoffwechsellage macht sich bemerkbar: Jeder HbA1c-Anstieg um 1% erhöht das PAVK-Risiko um circa 28%.5,6
Die Auswirkung von Tabakrauchen auf das Risiko und den Schweregrad einer PAVK ist bestens belegt. Beides erhöht sich mit dem Expositionsstart sowie der Expositionsdauer und -höhe (Anzahl der Pack Years). So ist das relative PAVK-Risiko sogar doppelt so hoch wie das für KHK oder Schlaganfall. Menschen, die 35 Jahre oder länger rauchen, haben ein 5,6-fach höheres Risiko für eine PAVK.7
Auch der Zusammenhang zwischen erhöhtem Blutdruck und PAVK wird immer konkreter. In der ARIC-Studie (Atherosclerosis Risk in Communities) fand sich bei einem systolischen Blutdruck ≥140mmHg ein gut 2,5-fach erhöhtes Risiko (Hazard-Ratio [HR]: 2,6) für eine PAVK. Dieses war bei der isolierten Betrachtung des diastolischen Blutdrucks weniger stark ausgeprägt und wurde erst ab >90mmHg signifkant.8
Traditionell geht man davon aus, dass Männer stärker von einer PAVK betroffen sind als Frauen. Neuere bevölkerungsbezogene Studien zeigen jedoch widersprüchliche Ergebnisse über den Zusammenhang zwischen Geschlecht und PAVK. Auf der Grundlage von ABI(«ankle-brachial index»)-Messungen scheinen Frauen eine gleich hohe oder sogar höhere Prävalenz zu haben. Meist treten atherosklerotische Erkrankungen jedoch circa 10 Jahre später auf als bei Männern (da die weiblichen Sexualhormone protektiv wirken). Das hat zur Folge, dass Frauen bei der Diagnose einer PAVK oft älter sind, schwerwiegendere Stadien und mehr Komorbiditäten aufweisen.9
Interessant ist ebenfalls der Einfluss von sozioökonomischen Faktoren. Erwachsene mit niedrigem Haushaltseinkommen, niedrigem Bildungsniveau und schwierigen Familienverhältnissen haben ein mehr als 2-fach erhöhtes Risiko, an einer PAVK zu erkranken, selbst nach Bereinigung der kardiovaskulären Risikofaktoren.10,11
Was hat Einfluss auf diePrognose der PAVK?
Die klinische Ausprägung
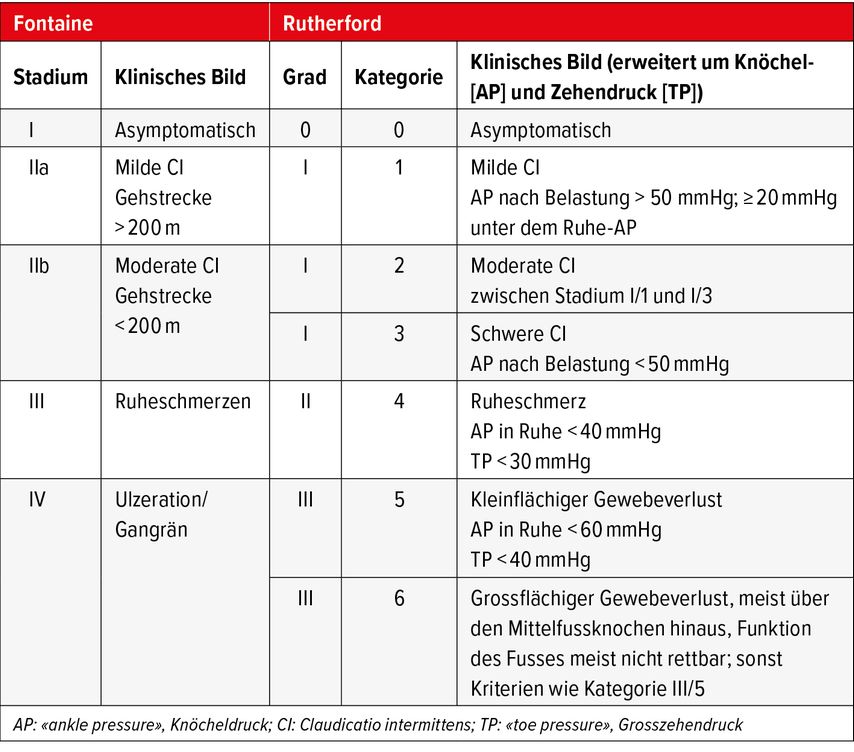
Die klinische Einteilung der PAVK erfolgt gemäss der Symptomatik, im deutschsprachigen Raum üblicherweise nach den Stadien von Fontaine. International und in wissenschaftlichen Arbeiten gebräuchlicher ist dagegen die Rutherford-Klassifikation (Tab. 1).12 Die symptomatischen Stadien werden mit dem Begriff «Claudicatio intermittens» und im Spätstadium als «kritische Extremitätenischämie» oder «Gliedmassen bedrohende Ischämie» (CLI) bezeichnet.
Die CI, oder auch das «unterbrochene Hinken», beschreibt neben einer Abnahme der schmerzfreien Gehstrecke auch eine verminderte Schrittgeschwindigkeit. Typisch ist das Auftreten reproduzierbarer, belastungsabhängiger Muskelschmerzen, die sich in Ruhe rasch zurückbilden können, vergleichbar mit der Angina pectoris am Herzen («Herzenge») bei einer symptomatischen KHK. In Abhängigkeit von der Höhenlokalisation der arteriellen Stenose oder des Verschlusses kann der Schmerz segmental oder auch kombiniert in der Gluteal-, Oberschenkel-, Waden- und Fussmuskulatur auftreten. Weitere Symptome sind ein Schwäche- und Müdigkeitsgefühl der Beine mit einem oft damit einhergehenden Verlust der Feinmotorik mit Gangunsicherheit.
Das Schicksal der Patienten wird vor allem durch schwerwiegende kardiovaskuläre Ereignisse (MACE «Major Adverse Cardiovascular Events»), wie Myokardinfarkt, Schlaganfall, kardiovaskulärer Tod und MALE («Major Adverse Limb Events») entscheidend bestimmt. Dazu gehören die Amputation und die akute oder chronische Beinischämie mit Notwendigkeit zur Revaskularisation. Mit dem klinischen Schweregrad der PAVK verschlechtert sich unaufhaltsam die Prognose. Bereits im asymptomatischen Stadium verdoppelt sich die Gesamtsterblichkeit binnen 5 Jahren,13 verändert sich aber in den symptomatischen Rutherford-Stadien 1–3 mit 18,9% kaum.
Die CLI ist die schwerste Form der PAVK und wird in der Regel durch Ruheschmerzen, nicht heilende Wunden oder Gewebeverlust definiert (Fontaine III–IV bzw. Rutherford-Stadium 4–6). Etwa 10% der PAVK-Patienten erleiden einen Progress in ein «kritisches» Stadium. Die CLI birgt dabei neben dem erhöhten Risiko für kardiovaskuläre Morbidität und (Gesamt-)Mortalität auch ein erhöhtes Amputationsrisiko, das je nach Schweregrad der CLI variiert.14,15 Mit ihr verbunden ist ein sprunghafter Anstieg der Mortalität auf über 37,7% (Stadium 4), 52,2% (Stadium 5) respektive 63,5% (Stadium 6) binnen 4 Jahren.16 Eine 1-Jahres-Mortalität von 20% wird beschrieben!17 Das Vorhandensein von Ulzerationen lässt sie nochmals ansteigen auf 28,7%.18 Die 1-Jahres-Amputationsrate liegt bei nahezu 20%.19
Die physikalischen Messparameter ABI, TBI und Zehendruck: nicht invasive First-Line-Diagnostika mit wertvoller prognostischer Aussagekraft
Die Verdachtsdiagnose PAVK kann in gut 80% der Fälle bereits mithilfe der Anamnese, des Pulsstatus und der Auskultation der Arterien verlässlich gestellt werden. Dabei kann im klinischen Alltag schon eine einfache Frage als erster Schritt dienen: «Haben Sie beim normalen Gehen Schmerzen in den Beinen?»20
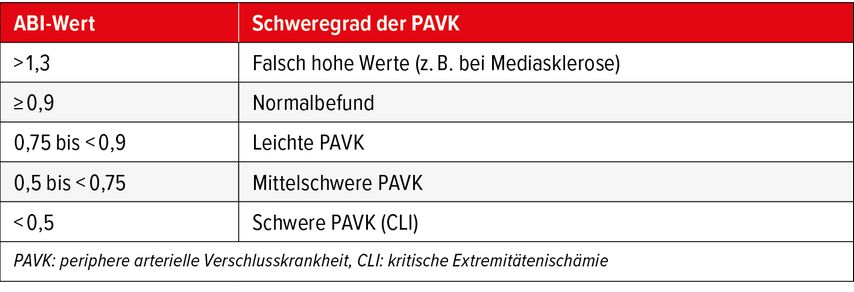
Um die Diagnose «PAVK» zu sichern, folgt nach Anamnese und klinischer Untersuchung die nicht invasive Messung des Knöchel-Arm-Index (ABI) mittels der Dopplerverschlussdrücke, also des Verhältnisses zwischen dem systolischen Blutdruck im Knöchelbereich und dem mittleren Armarteriendruck – Ausnahme: Bei Druckunterschieden ≥10mmHg wird der höhere Druck verwendet. Voraussetzung ist eine standardisierte Messmethodik. Ein ABI-Wert von <0,9 gilt als beweisend für das Vorliegen einer relevanten PAVK (Tab.2). Während in früheren Studien der höchste gemessene Knöcheldruck Verwendung fand, ist inzwischen die Verwendung des niedrigsten Fussarteriendrucks für den Ausschluss bzw. Nachweis einer PAVK allgemein akzeptierter Standard. Er erhöht die Sensitivität für das Erkennen einer relevanten arteriellen Verschlusskrankheit auf >90%, bei einer vergleichbaren Spezifität von fast 100%. Damit senkt er die Rate nicht identifizierter Hochrisiko-Patienten. Dabei gilt: Je niedriger der Wert, umso ausgeprägter sind die atherosklerotischen Veränderungen im Bein und somit die Behinderung des Blutflusses. Aber: Ein «normaler» ABI schliesst eine PAVK nicht aus. Durch eine gute Kollateralisierung können Stenosen und/oder Gefässverschlüsse ausreichend kompensiert werden. Bei Verdacht, insbesondere unter Berücksichtigung einer typischen Anamnese, sollte eine ergänzende Messung des ABI nach Belastung (z.B. Laufbandtest: 3,5km/h, 12% Steigung, alternativ 30 Zehenstände) zwingend erfolgen. Obwohl die Kriterien für die Bewertung des Nachbelastungs-ABI nicht standardisiert sind, gelten ein ABI <0,9 oder ein ABI-Abfall von >20% resp. ein Druckabfall im Knöchelbereich um >30mmHg in der Regel als relevant.
Falsch hohe ABI-Werte (>1,3) durch Mediasklerose erschweren die Bewertung. Sie finden sich gehäuft bei Diabetikern, Patienten mit chronischen Nierenerkrankungen oder peripheren Ödemen. In solch einem Fall kann die Bestimmung des Zehen-Arm-Index («toe-brachial index», TBI) bzw. des Zehendrucks hilfreich sein, da die Verkalkung der Media nur selten die Digitalarterien betrifft. Im Allgemeinen wird ein TBI ≤0,70 als Sicherung der PAVK akzeptiert. Ein Zehendruck <40mmHg erhöht das Risiko für Fussläsionen bzw. eine ausbleibende Wundheilung.
Es besteht ein starker Zusammenhang zwischen einem niedrigen (≤0,9) und einem hohen (>1,3) ABI sowie der Gesamt- und der kardiovaskulären Mortalität. Er ist dabei ein unabhängiger Prädiktor. In einer Metaanalyse von 16 bevölkerungsbasierten Kohortenstudien verdoppelte sich die Gesamtsterblichkeit bei einem ABI zwischen 0,81 und 0,9, bei Personen mit einem ABI ≤0,70 vervierfachte sie sich sogar. Personen mit einem grenzwertig niedrigen ABI wiesen ebenfalls eine signifikant erhöhte Sterblichkeit auf.21
«Duo infernale» Nr. 1: PAVK und Diabetes mellitus
Mehr als die Hälfte aller grossen (Major-)Amputationen (ober- oder unterhalb des Knies) ist auf DM und PAVK zurückzuführen.22,23 Bis zu 30% aller Patienten mit CI und 50% aller Patienten mit CLI sind Diabetiker.24 Diese Patientengruppe mit gleichzeitigem DM und PAVK hat dabei ein viermal höheres Amputationsrisiko als der Durchschnitt.25,26
Verschiedene Aspekte sind hier ursächlich zu benennen: Im Vergleich zu Menschen ohne DM entwickelt sich die PAVK bei Menschen mit DM früher, schreitet schneller voran und geht häufiger in die CLI über. Anatomisch-morphologisch ist eine multisegmentale Manifestation mit langstreckigen, kalzifizierten Stenosen/Verschlüssen vor allem der Unterschenkelarterien, mit unzureichender Kollateralbildung, typisch. Klinisch präsentieren sich Menschen mit DM häufig mit einer kritischen Ischämie, auch weil die einer kritischen Ischämie vorausgehende Claudicatio intermittens und der Ruheschmerz aufgrund der diabetischen sensiblen Polyneuropathie lange Zeit maskiert bleiben können. Diabetische Geschwüre, die mit motorischen, sensorischen und autonomen Neuropathien und daraus resultierenden Fussdeformitäten und einer gestörten Wundheilung einhergehen, tragen ebenfalls wesentlich zum Amputationsrisiko bei Patienten mit DM bei. Es wird jedoch geschätzt, dass circa 50% der Patienten mit einem diabetischen Ulkus gleichzeitig eine PAVK aufweisen.27
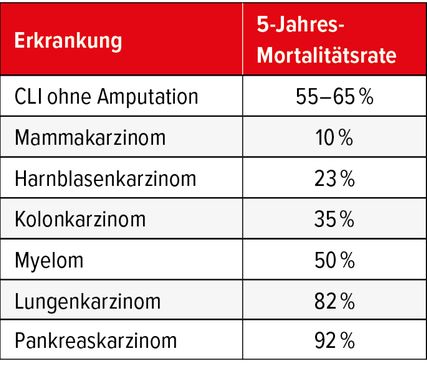
Die insgesamt schlechte Prognose ist neben hohen Ischämie- und Ulkusrezidivraten auch durch die hohe Rate an Komorbiditäten und der Koprävalenz von Endorganschäden wie Herz- und Niereninsuffizienz bedingt, die die Mortalität unabhängig erhöhen. Amputationen im Zusammenhang mit DM und PAVK stellen eine enorme Belastung für die Patienten und ihr Umfeld dar. Von den Patienten, die sich aufgrund eines DM und/oder einer PAVK einer Amputation unterziehen müssen, ist mehr als die Hälfte danach dauerhaft behindert. Eine ähnliche Anzahl, vor allem derjenigen, die sich einer Amputation oberhalb des Knies unterziehen müssen, kehrt nie wieder in einen ambulanten Status zurück.28 Bei Patienten, die sich aufgrund einer CLI einer Major-Amputation unterziehen mussten, lag die 1-Jahres-Sterblichkeit in einer kürzlich durchgeführten Medicare-Studie in den USA bei 40,4%. Dies verdeutlicht die Schwere dieser Erkrankung über die Zeit. Die 5-Jahres-Sterblichkeit bei CLI ohne Amputation wird auf 55–65% geschätzt.17 Wie in Tabelle 3 dargestellt, übersteigt dies die 5-Jahres-Sterblichkeit durch z.B. Mammakarzinom (10%), Kolonkarzinom (35%) und Myelom (50%).29
«Duo infernale» Nr. 2: PAVK und chronische Niereninsuffizienz
Patienten mit chronischer Niereninsuffizienz (CKD) haben ein deutlich erhöhtes Risiko für eine PAVK. So zeigen Daten aus der US-amerikanischen NHANE Studie (National Health and Nutrition Examination Survey), dass die Prävalenz der PAVK bei Patienten mit einer geschätzten glomerulären Filtrationsrate (eGFR) <60 im Vergleich zu einer eGFR ≥60ml/min/1,73m2 um das 6,5-Fache ansteigt.30 Im CKD-Stadium 5 betrifft es circa 30% der Patienten, bei Dialysepflichtigkeit nahezu jeden Zweiten.31,32 Die CKD an sich ist ein klinischer Zustand, der durch eine hohe (kardiovaskuläre) Morbidität und Mortalität gekennzeichnet ist, mit steigender Prävalenz und Inzidenz. Tritt eine PAVK hinzu, potenziert sich das Risiko.33,34 Es vervierfacht sich bei Patienten, die sowohl an einer PAVK als auch einer CKD leiden, im Vergleich zu Patienten ohne Erkrankung und verdoppelt sich im Vergleich zu denen mit nur einer Krankheitsentität. Absolut gesehen liegt die 6-Jahres-Sterblichkeitsrate in dieser PAVK+CKD-Population bei 45%.35
Darüber hinaus hat sich gezeigt, dass die CKD an sich, aber insbesondere in den Stadien 4 und 5, mit einer CLI assoziiert ist.36 Sie senkt die Wahrscheinlichkeit eines amputationsfreien Überlebens bei Patienten mit CLI über einen Beobachtungszeitraum von 3 Jahren drastisch (HR: 3,68; 95% CI: 1,51–8,94).37
PAVK – der Sentinel einer polyvaskulären Erkrankung
Die PAVK hat in letzter Zeit im Zusammenhang mit polyvaskulären Erkrankungen an Aufmerksamkeit gewonnen. Als Referenz kann das REACH-Register (Reduction of Atherothrombosis for Continued Health) angeführt werden. Es ist eine multinationale Datenbank, in welcher die Häufigkeit von atherothrombotischen Erkrankungen und die damit assoziierten Risikofaktoren im klinischen Alltag erfasst werden. Es ist mit über 68000 Patienten in 44 Ländern das geografisch und hinsichtlich der Fallzahl grösste Patienten-Register zur Atherothrombose. Darin haben drei von fünf Patienten mit PAVK eine Manifestation in einem anderen Gefässbett (61,5% in ≥1; 48% in 2 und 13,5% in 3). Die 1-Jahres-Rate für schwerwiegende Ereignisse (kardiovaskulärer Tod, nicht tödlicher Schlaganfall und Myokardinfarkt) steigt dabei deutlich mit der Anzahl der symptomatischen Gefässbetten an und reicht von 2,2% (bei Patienten mit nur Risikofaktoren) bis 9,2% (bei Patienten mit dokumentierter kardialer, zerebraler und peripherer Gefässerkrankung).38
In mehreren Studien zur Bewertung neuer lipidsenkender oder antithrombotischer Therapien im Bereich der kardiovaskulären Prävention, wie der FOURIER-Studie (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Patients With Elevated Risk) und der COMPASS-Studie (Cardiovascular Outcomes for People Using Anticoagulation Strategies), wiesen Patienten mit polyvaskulären Erkrankungen ein höheres Risiko auf als Patienten ohne diese Erkrankungen, was sich in einer höheren absoluten Risikosenkung durch diese neuen Behandlungen niederschlug.39,40 In der FOURIER-Studie beispielsweise wies die Kombination aus PAVK und Myokardinfarkt/Schlaganfall mit einem 2,5-Jahres-Risiko von 14,9% erwartungsgemäss das höchste Risiko für schwerwiegende kardiovaskuläre Ereignisse (kardiovaskuläre Mortalität, Myokardinfarkt und Schlaganfall) auf. Bemerkenswert ist, dass eine PAVK ohne Myokardinfarkt/Schlaganfall ein höheres Risiko für schwerwiegende unerwünschte kardiovaskuläre Ereignisse (10,3%) aufwies als ein Myokardinfarkt/Schlaganfall ohne PAVK (7,6%).
Die PAVK – eine grosse Herausforderung!
Unzureichende Umsetzung der evidenz- basierten präventiven Therapie
Alle internationalen Leitlinien benennen Thrombozytenaggregationshemmer, Statine, Antihypertensiva, Blutzuckerkontrolle und Raucherentwöhnung als Empfehlungen der Klasse I (stark) und IIa (moderat). Trotz dieser evidenzbasierten Leitlinienempfehlungen werden Patienten mit PAVK nach wie vor drastisch unterbehandelt (Tab. 4). In einer Analyse von Personen mit PAVK (definiert durch einen ABI ≤0,9) aus der NHANES lag die Verwendung von Aspirin, Statinen und Inhibitoren des Renin-Angiotensin-Systems (RAS) bei nur 35,8%, 30,5% bzw. 24,9%.41 Eine aktuellere Studie mit Patienten nach einer peripheren Revaskularisation – eine Untergruppe mit besonders hohem Risiko für kardiovaskuläre und ischämische Komplikationen an den Extremitäten – berichtete über die Verwendung von Aspirin, P2Y12- Rezeptorantagonisten (wie z.B. Clopidogrel) und RAS-Inhibitoren bei lediglich 67,3%, 57,7% bzw. 47,6% der Patienten bei der Spitalentlassung. Nur 61,7% der Patienten erhielten ein Statin.42
Tab. 4: Internationale Leitlinien zur PAVK: Klasse-I-(Evidenzgrad-A)-Empfehlungen und deren Umsetzung im klinischen Alltag
Vor diesem Hintergrund verwundern die Ergebnisse einer erst kürzlich durchgeführten systematischen Untersuchung über das Wissen und den Bekanntheitsgrad der PAVK nicht. Darin hatten lediglich 61% der Allgemeinmediziner ihre Patienten auf PAVK untersucht und nur 6% kannten die Leitlinien für eine evidenzbasierte Therapie. Bei den Patienten und in der Öffentlichkeit schwankte der Anteil mit Wissen über die PAVK zwischen 21% und 61%. Mangelndes Bewusstsein bei Patienten und medizinischem Fachpersonal trägt entscheidend zu einer verzögerten und/oder unzureichenden Behandlung bei.45 So werden nicht selten Claudicatio-Schmerzen, insbesondere der Gesässregion und der Fusssohle, zunächst anderen, vor allem neurologischen und/oder orthopädischen Krankheitsbildern zugeordnet.
Eine wichtige Rolle bei der Nichtwahrnehmung der PAVK ist sicherlich die mangelnde Kenntnis und Wertschätzung der schlechten Prognose der PAVK. In diesem Zusammenhang kann die Terminologie der «peripheren» AVK den Eindruck erwecken, dass diese Erkrankung harmlos sei. Diese Vorstellung ist – wie gezeigt – eindeutig falsch!
Die Sensibilisierung für alle Aspekte der PAVK, einschliesslich Definition, Diagnose, klinische Manifestation und Komplikationen, ist von entscheidender Bedeutung für die Verbesserung der Gesamtprognose in dieser wachsenden und unterbehandelten Bevölkerungsgruppe.
Literatur:
1 Sundaram V et al.: Eur Heart J 2020; 41: 1636-49 2 Song P et al.: Lancet Glob Health 2019; 7: e1020-30 3 Szenarien zur Bevölkerungsentwicklung der Kantone 2015–2045, Quelle: Bundesamt für Statistik, Schweiz 4 American Diabetes Association: Diabetes Care 2013; 26: 3333-41 5 Zhang Y et al.: PLoS One 2012; 7: e42551 6 Adler AI et al.: Diab Care 2002; 25: 894-9 7 Ding N et al.: J Am Coll Cardiol 2019; 74: 498-507 8 Lu Y et al.: Eur J Prev Cardiol 2020; 27: 51-9 9 Peters F et al.: Eur J Vasc Endovasc Surg 2020; 60: 421-9 10 Pande RL, Creager MA: Circ Cardiovasc Qual Outcomes 2014; 7: 532-9 11 Vart P et al.: J Am Heart Assoc 2017; 6: e004995 12 Hirsch AT et al.: Circulation 2006; 113: 463-654 13 Diehm C et al.: Circulation 2009; 120: 2053-61 14 Agarwal S et al.: J Am Coll Cardiol 2016; 67: 1901-13 15 Unwin N: Br J Surg 2000; 87: 328-37 16 Reinecke H et al.: Eur Heart J 2015; 36: 932-8 17 Abu Dabrh AM et al.: J Vasc Surg 2015; 62: 1642-51 18 Cambou JP et al.: Eur J Vasc Endovasc Surg 2010; 39: 577-85 19 Duff S et al.: Vasc Health Risk Manag 2019; 15: 187-208 20 Kieback AG et al.: PLoS One 2019; 14: e0224608 21 Fowkes FG et al.: JAMA 2008; 300: 197-208 22 Goldberg JB et al.: J Vasc Surg 2012; 56: 1663-8 23 Goodney PP et al.: J Vasc Surg 2009; 50: 54-60 24 Malyar N et al.: J Diab Compl 2016; 30: 1117-22 25 Bild DE et al.: Diabetes Care 1989; 12: 24-31 26 Humphries MD et al.: J Vasc Surg 2016; 64: 1747-55.e3 27 Prompers L et al.: Diabetologia 2007; 50: 18-25 28 Goodney PP et al.: J Vasc Surg 2009; 49: 1431.e1-1439.e1 29 American Cancer Society: Cancer Facts & Statistics. American Cancer Society. http://cancerstatisticscenter.cancer.org/ . Accessed November 3, 2019 30 Selvin E, Erlinger TP: Circulation 2004; 110: 738-43 31 Leskinen Y et al.: Am J Kidney Dis 2002; 40: 472-9 32 United States Renal Data System. Annual Data Report: Epidemiology of Kidney Disease in the United States. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases; 2018 33 Liew YP et al.: Clin J Am Soc Nephrol 2008; 3: 1084-9 34 Otmann J et al.: J Vasc Surg 2012; 56: 737-45.e1 35 Zlatanovi P et al.: Eur J Vasc Endovasc Surg 2018; 56: 78-86 36 Owens CD et al.: J Vasc Surg 2007; 45: 944-52 37 Engelhardt M et al.: Eur J Vasc Endovasc Surg 2012; 43: 55-61 38 Steg PG et al.: JAMA 2007; 297: 1197-206 39 Bonaca MP et al.: Circulation 2018; 137: 338-50 40 Steffel J et al.: Circulation 2020; 142: 40-8 41 Pande RL et al.: Circulation 2011; 124: 17-23 42 Hess CN et al.: J Am Coll Cardiol 2018; 72: 999-1011 43 Armstrong EJ et al.: J Am Heart Assoc 2014; 3: e000697 44 Patel KK et al.: J Am Heart Assoc 2018; 7: e010076 45 Bridgwood BM et al.: Vasc Med 2020; 25: 263-73
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...