Fortgeschrittene Therapie der Herzinsuffizienz: Warum und wie?
Autor:innen:
Dr. med. Bruno Schnegg1
Dr. med. Christian Muster1
Dr. med. Lukás Capek1
Dr. med. Jolie Donna Bruno1
Dr. med. David Reineke2
1Universitätsklinik für Kardiologie
Inselspital, Universitätsspital Bern
2Universitätsklinik für Herzchirurgie
Inselspital, Universitätsspital Bern
Korrespondenz:
E-Mail: bruno.schnegg@insel.com
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Patienten mit fortgeschrittener Herzinsuffizienz haben eine eingeschränkte Lebensqualität und eine niedrigere Lebenserwartung. Bei akuter und chronischer Herzinsuffizienz gibt es verschiedene Möglichkeiten, die Ventrikelfunktion zu unterstützen bzw. zu ersetzen. Hier stellen wir Ihnen einige dieser Möglichkeiten vor. Wir gehen auf Indikationen, Kontraindikationen und Komplikationen ein und öffnen den Blick in die Zukunft.
Keypoints
-
In den letzten 30 Jahren wurde die Therapie der chronischen Herzinsuffizienz revolutioniert. Einerseits durch zahlreiche neue Medikamente, andererseits durch funktionelle Rekonstruktion der Herzklappen und Fortschritte in der Rhythmologie.
-
Bestimmte Patienten benötigen akut bzw. im Verlauf ihrer Krankheit eine Unterstützung oder einen Ersatz der Ventrikelfunktion. Wir haben vorübergehende Optionen (ECMO, Impella®) und dauerhafte Optionen (voll implantierbare ventrikuläre Unterstützungssysteme, Herztransplantation).
-
Der Bereich der Herzersatz- und Unterstützungsysteme entwickelt sich schnell, insbesondere durch den Einsatz fortschrittlicher Techniken zur Konservierung des Herzens ausserhalb des Körpers des Spenders («organ care system») und bedeutende Fortschritte bei der temporären (Impella®) und endgültigen mechanischen Unterstützung («left ventricular assist device», «total artificial heart»).
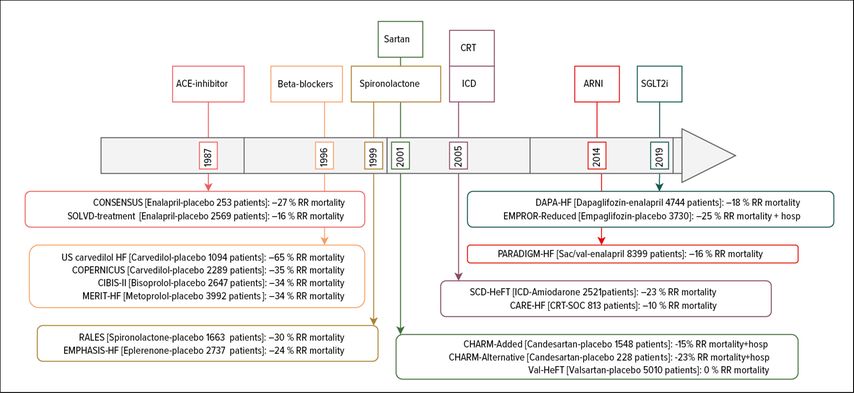
Die medikamentöse Behandlung der Herzinsuffizienz hat sich in den letzten 30 Jahren stark verändert. Der aktuelle Standard ist eine medikamentöse Vierfachtherapie aus Betablockern, Sartan in Kombination mit Neprilisin-Inhibitoren (ARNI), Mineralokortikoidrezeptorblockern (MRA) und SGLT2-Inhibitoren. Der Rückgang der relativen Mortalität durch die medikamentöse Herzinsuffizienztherapie ist in Landmark-Studien gut belegt (Abb. 1). Zusätzlich ermöglichen uns Fortschritte in der Rhythmologie (Resynchronisationsschrittmacher und Defibrillatoren) sowie interventionelle Eingriffe an Mitral- und Trikuspidalklappe, die Lebensqualität und die Prognose von Patienten mit fortgeschrittener Herzinsuffizienz zu verbessern. Leider bleibt ein Teil der Patienten symptomatisch und benötigt eine fortgeschrittene Herzinsuffizienztherapie.
Abb. 1: Chronologie der wichtigsten Studien zur Herzinsuffizienz in den letzten Jahren
Fortgeschrittene Herzinsuffizienztherapie
Es gibt zwei Arten von ventrikulärer Unterstützung bzw. Ersatz: mechanisch (vorübergehend interventionell oder dauerhaft voll implantierbar) oder Transplantation. Diese verschiedenen Behandlungen haben unterschiedliche Indikationen, Verfügbarkeiten, Vor- und Nachteile, Komplikationen und Ergebnisse.
Temporäre mechanische Unterstützung
Wir unterscheiden zwei Arten von temporärer mechanischer Unterstützung: mit und ohne Oxygenator.
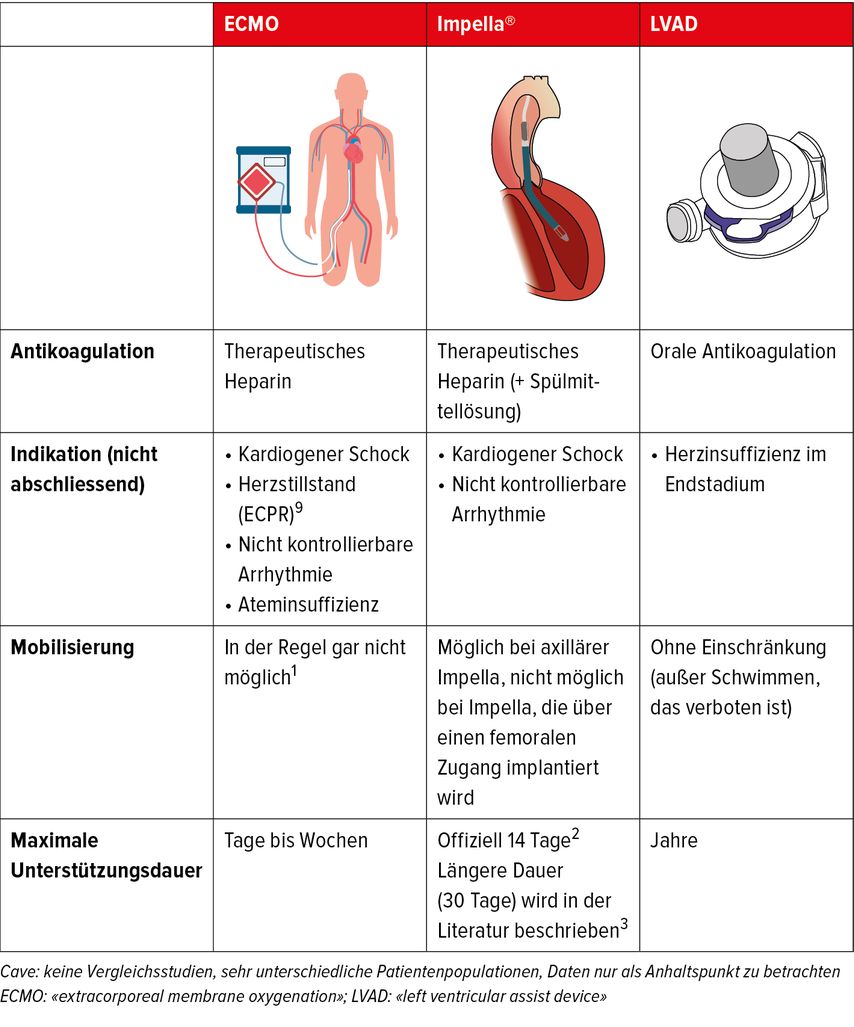
Die ECMO («extra corporeal membrane oxygenation») ist eine temporäre Unterstützung mit Oxygenator, die dem Körper Blut entzieht, es oxygeniert und anschliessend zurückgibt. Eine ECMO kann insbesondere bei kardiogenem Schock oder in Fällen reversibler Ateminsuffizienz (z.B. bei Covid-19) eingesetzt werden. Die ECMO ist vor allem aufgrund der fehlenden Nachlastsenkung und der damit verbundenen Probleme (Lungenödem, fehlende Herzerholung) nur eine vorübergehende Lösung. Die ECMO sollte es ermöglichen, durch die Wiederherstellung eines suffizienten Kreislaufes eine Strategie für eine endgültige Lösung zu erarbeiten (Tab. 1).
Tab. 1: Systeme zur temporären (ECMO, Impella®) oder langfristigen mechanischen Unterstützung des linken Ventrikels (LVAD)
Für die Unterstützung ohne Oxygenator ist die Impella® das am häufigsten verwendete System. Sie besteht aus einem Katheter mit einem Durchmesser von 4–7mm, der peripher von der Leiste oder via A. subclavia über die Aortenklappe in den linken Ventrikel eingebracht wird. Am Ende des Katheters befindet sich eine axiale Mikropumpe, welche durch eine erste Öffnung in der Katheterspitze das Blut aus dem Ventrikel ansaugt und es anschliessend durch eine zweite Katheteröffnung distal der Aortenklappe auswirft (Tab. 1). Die Impella® kann in einer kleineren Version (Impella CP®) femoral von Kardiologen im Herzkatheterlabor oder in der grösseren Version (Impella 5,5®) von einem Herzchirurgen über einen axillären Gefässzugang implantiert werden. Bei letzterer Version kann die Mobilisation des Patienten erfolgen. Die Impella® bietet eine hervorragende Möglichkeit, die linke Herzkammer zu entlasten und gleichzeitig ein Herzzeitvolumen von bis zu 5,5 Litern pro Minute zu gewährleisten. Im Gegensatz zur Impella® erhöht die ECMO die Nachlast der linken Herzkammer, indem sie das sauerstoffreiche Blut retrograd gegen die Aortenklappe in die Aorta drückt und so die Erholung des Herzens verhindert. Die Impella® kann allein oder bei Bedarf zusammen mit einer ECMO verwendet werden. Die von der Firma garantierte maximale Nutzungsdauer beträgt 14 Tage.2 In der Literatur wird jedoch auch eine längere Anwendung von bis zu einem Monat beschrieben.3
Sowohl ECMO als auch Impella® sind Notfallbehandlungen, die sofort verfügbar sind. Die hauptsächlichen Einschränkungen sind Komplikationen aufgrund einer mangelnden Hämokompatibilität (Blutungen und Thrombose) und Probleme mit dem peripheren arteriellen Zugang (akute Ischämie in den unteren Extremitäten). Zudem besteht mit zunehmender Behandlungsdauer ein erhöhtes Sepsisrisiko und der Patient bleibt mehr oder weniger an ein intensivmedizinisches Umfeld gebunden.
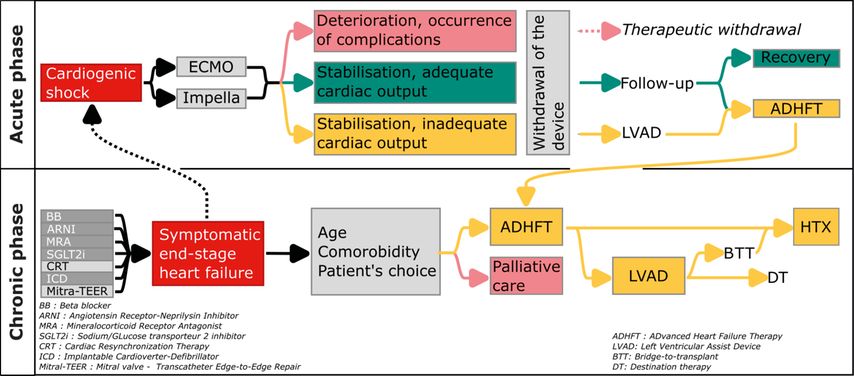
Eine vorübergehende mechanische Ventrikelunterstützung kann zu drei verschiedenen Szenarien führen (Abb. 2):
-
Therapieabbruch: Der Patient verschlechtert sich kardial weiter oder die neurologische Situation ist ungünstig und die Fortsetzung der Behandlung wird als aussichtslos erachtet. Nach beschlossenem Therapieabbruch wird das Gerät entfernt und eine Komforttherapie eingeleitet.
-
Dauerhafte ventrikuläre Unterstützung: Der Patient stabilisiert sich auf einem Niveau, das zu niedrig ist, als dass das Herz ein ausreichendes Herzzeitvolumen liefern könnte. Falls es keine Kontraindikationen gibt, wird eine permanente ventrikuläre Unterstützung, in der Regel ein Linksherzunterstützungssystem (LVAD), eingesetzt.
-
Verbesserung/Normalisierung der ventrikulären Funktion: Die Herzleistung desPatienten verbessert sich so weit, dass der Patient ohne externe maschinelle Unterstützung leben kann. Die vorübergehende Unterstützung wird dann über einen Zeitraum von einigen Stunden bis Tagen entwöhnt und anschliessend entfernt.
Abb. 2: Algorithmus zur Entscheidungsfindung bei akuter und chronischer Herzinsuffizienz
Langfristige mechanische Unterstützung
Die Herztransplantation ist zwar eine langfristige Lösung, mit der die Ventrikelfunktion auf physiologische Weise ersetzt werden kann. Die Verfügbarkeit ist aber naturgemäss eingeschränkt (Warteliste). Zudem ist sie nicht für alle Patienten mit terminaler Herzinsuffizienz eine Lösung (Alter, Komorbidität, Patientenpräferenz). Es gibt also häufig Situationen, in denen der Patient rasch auf eine mittel- bis langfristige Unterstützung des linken Ventrikels angewiesen ist, um zu überleben bzw. eine akzeptable Lebensqualität zu erreichen. In diesen Fällen wird eine mechanische linksventrikuläre Unterstützung oder LVAD («left ventricular assist device») eingesetzt.
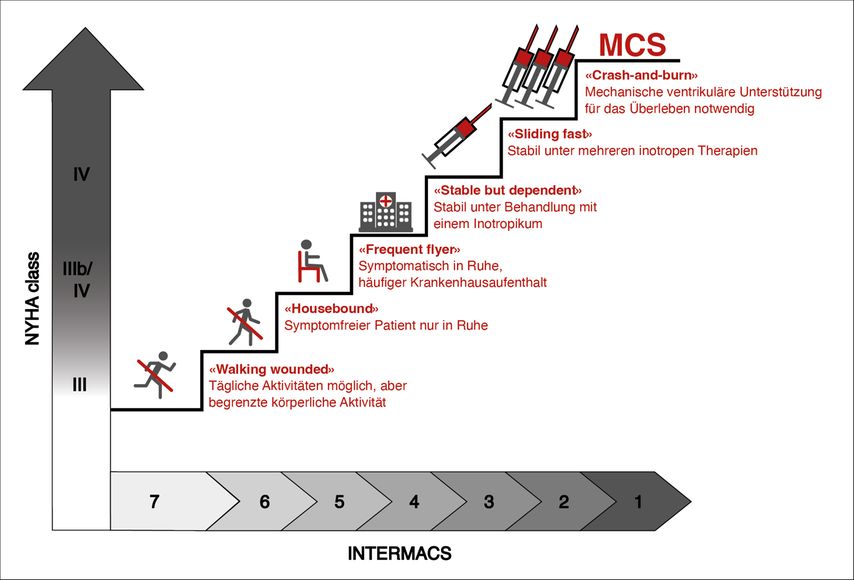
Um Arzt und Patient bei der Beurteilung des erwarteten Nutzens der LVAD-Behandlung zu unterstützen, ist die Verwendung des INTERMACS-Scores und der damit verbundenen Studien zur Lebensqualität und zum Überleben sehr hilfreich (Abb. 3).
Der INTERMACS-Score unterteilt die NYHA-Stadien III und IV in sieben Unterkategorien. Patienten der INTERMACS-Stadien 1 und 2 sind intensivpflichtig, solche der INTERMACS-Stadien 3 und 4 werden wiederholt wegen kardialer Dekompensation ins Krankenhaus eingeliefert. Patienten im INTERMACS-Stadium 5 sind zu schwach, um das Haus zu verlassen, und können sich nicht mehr körperlich anstrengen. Die INTERMACS-Stadien 6 und 7 umfassen Patienten mit Schwierigkeiten, sich körperlich zu betätigen.
Je nach INTERMACS-Stadium ändert sich der zu erwartende Nutzen der Implantation eines LVAD. Folgendes ist zu erwarten:
-
Ein kurzfristiges Überleben des Patienten in Fällen, in denen die Entwöhnung vom provisorischen ventrikulären Unterstützungssystem nicht möglich ist (INTERMACS 1 und 2).4
-
Eine Verbesserung der Prognose bei Patienten mit schwer symptomatischer Herzinsuffizienz trotz Maximierung der medikamentösen Therapie (INTERMACS 3 bis 5).5
-
Eine Verbesserung der Lebensqualität bei Patienten mit symptomatischer Herzinsuffizienz (INTERMACS 5 bis 7).6
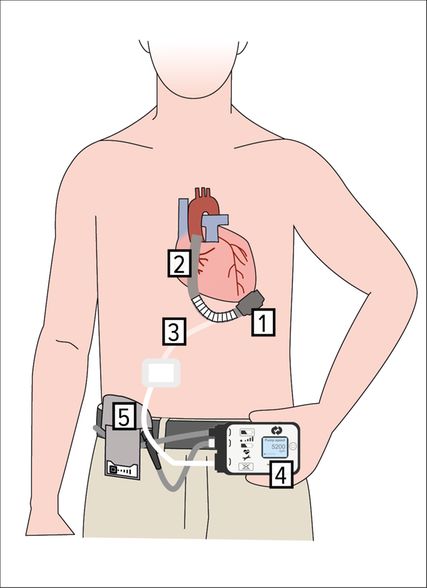
Abb. 4: Komponenten des LVAD. 1: Pumpe, 2: arterieller Blutleiter, 3: Driveline, 4: Controller, 5: Batterie
Die Implantation eines LVAD ist ein grosser Eingriff. Dabei wird chirurgisch ein Ansaugstutzen an der Herzspitze fxiert, der das Blut aus dem Ventrikel entnimmt und über einen Ausflussgraft in die Aorta ascendens leitet. Ein Strom- und Kommunikationskabel, das mit der Pumpe verbunden ist, verläuft am Bauch durch die Haut und ist mit einem externen Steuergerät verbunden, welches wiederum mit zwei Batterien verbunden ist (Driveline, Abb. 4).
Das Einsetzen eines LVAD verändert das Leben des Patienten in jeder Hinsicht. Auf der einen Seite ist der Patient körperlich wieder belastbarer: Er kann gehen, Treppen steigen und leichte körperliche Aktivitäten ausüben. Andererseits ist sein Überleben nun von einer Maschine abhängig, die eine besondere Pflege erfordert (Antikoagulation, Batteriewechsel, Hautpflege an der Austrittsstelle des Kommunikations- und Stromkabels).
Die Vorteile für Patienten mit terminaler Herzinsuffizienz sind zwar enorm, aber das System hat drei grosse Bürden.
-
Hämokompatibilität der Pumpe: Die Patienten müssen unter Antiaggregation (Aspirin 100mg) und Antikoagulation mit einem Vitamin-K-Antagonisten (Ziel-INR 2,0–3,0) gehalten werden, um thromboembolische Komplikationen zu vermeiden. Trotz dieser Vorsichtsmassnahmen sind ischämische Ereignisse möglich und Blutungen sind häufige Komplikationen der LVAD-Behandlung.
-
Rechtsherzinsuffizienz: Da der rechte Teil des Herzens nicht vom LVAD unterstützt wird, können Patienten bei biventrikulärer Dysfunktion trotz des Einsatzes des LVAD symptomatisch bleiben.
-
Infektionen/Entzündungen: 30% aller Patienten erleben klinisch manifeste Infektionen an der Austrittsstelle der Driveline, 50–75% aller Patienten haben eine bakterielle Kolonisation.7
Herztransplantation
Aufgrund der Komplikationen und der Autonomieeinschränkungen bleibt die Herztransplantation bei geeigneten Patienten (Alter, Komorbiditäten, Wunsch des Patienten) immer noch die Strategie der Wahl.
Die Indikation für eine Herztransplantation ist eine symptomatische Herzinsuffizienz, typischerweise charakterisiert durch eine Spiroergometrie mit einer VO2max (maximale Menge an transportiertem Sauerstoff pro Minute und Kilogramm Körpergewicht) von weniger als 12–14ml/min/m2. Weitere Indikationen für eine Herztransplantation sind symptomatische Rechtsherzinsuffizienz, rezidivierende therapierefraktäre Arrhythmien und therapierefraktäre Angina pectoris.
Die klassischen Kontraindikationen für eine solche Therapie sind Alter des Patienten (bei >65- bis 67-Jährigen fällt die Risiko-Nutzen-Abwägung nicht mehr zugunsten einer Transplantation aus), Komorbiditäten (z.B. fortgeschrittene COPD mit Lungenemphysem), onkologische, neuromuskuläre (mit ungünstiger Langzeitprognose) und einzelne psychiatrische Erkrankungen.8
Wenn ein Patient nach ausführlichen Abklärungen als für eine Transplantation geeignet erachtet wird und keine Kontraindikationen bestehen, wird er auf die nationale Warteliste gesetzt.
In der Schweiz ist das Zuteilungssystem transparent und beruht auf einem Algorithmus, der nicht nur die immunologische Kompatibilität und Gesamtwartezeit berücksichtigt, sondern auch Alters-, Gewichts- und Grössenunterschiede zwischen Empfänger und Spender. Wie in allen Industrieländern besteht auch in der Schweiz eine grosse Diskrepanz zwischen der Anzahl potenzieller Empfänger und der tatsächlichen Anzahl von Spendern. Diese Diskrepanz ist für die relativ langen Wartezeiten verantwortlich, die mehrere Jahre betragen können.
Die Herztransplantation selbst wird von zwei Chirurgenteams durchgeführt, von denen eines das Herz entnimmt und das andere den Empfänger auf die Implantation des neuen Herzens vorbereitet. Nach der Transplantation verbringt der Patient einige Tage auf der Intensivstation und mehrere Wochen auf der Normalstation, bevor er die kardiologische Rehabilitation antreten kann.
Nach der Transplantation nehmen die Patienten eine Reihe von Medikamenten gegen die Abstossung ein (in der Regel drei) und werden relativ häufig ambulant nachkontrolliert, um Komplikationen und Abstossungsreaktionen möglichst früh zu erkennen. Zu diesem Nachsorgeschema gehören Myokardbiopsien.
Das Leben von Patienten nach einer Transplantation ist, abgesehen von der regelmässigen und obligatorischen Einnahme von Medikamenten gegen die Abstossung, relativ normal. Dennoch sind die lang- und sehr langfristige Prognose nicht identisch mit der eines nicht transplantierten Menschen. Infektiöse und neoplastische Komplikationen sowie der langsame Funktionsverlust des Transplantats (insbesondere wegen Transplantatvaskulopathie) schränken das Überleben ein.
Zukunft der Behandlung der schweren Herzinsuffizienz
Wie wir in den vorangegangenen Abschnitten gesehen haben, verfügen wir derzeit über äusserst wirksame Behandlungsmethoden, um das Leben zu verlängern und die Lebensqualität von Patienten mit schwerer Herzinsuffizienz zu verbessern. Sei es akut, z.B. nach einem grossen Herzinfarkt, oder chronisch, z.B. im Zusammenhang mit einer familiären dilatativen Kardiomyopathie. Diese Techniken sind jedoch unvollkommen und mit Komplikationen und Einschränkungen verbunden. Wir möchten Ihnen hier einige der möglichen Entwicklungen im Bereich der Behandlung der terminalen Herzinsuffizienz vorstellen.
«Total artificial heart»
Wie bereits erwähnt, können LVAD nur den linken Ventrikel unterstützen. In sehr seltenen Fällen wird zusätzlich zum LVAD eine Pumpe in die rechte Herzkammer implantiert (RVAD). Dann spricht man von einem BiVAD (LVAD+ RVAD). Diese Lösung ist mit einer hohen Morbidität und Mortalität nach 6 Monaten verbunden und wird in der Praxis kaum eingesetzt.
Die Verwendung eines vollständigen Kunstherzens ist bei schwerer biventrikulärer Insuffizienz eine bessere Lösung als ein BiVAD. Derzeit sind mehrere Modelle auf dem Markt erhältlich, von denen das BiVACOR und das Aeson® CARMAT die vielversprechendsten sind. Das Aeson® ist ein Kunstherz, das die Pulsatilität eines normalen Herzens nachahmt, das BiVACOR ist ein Kunstherz, das aus zwei «aneinandergeklebten» LVAD besteht. Diese neuen Techniken sollen in Zukunft die Anzahl der Komplikationen verringern und vielleicht die Transplantation teilweise ersetzen.
Fortschritte bei der Herztransplantation
Im Bereich der Herztransplantation werden grosse Anstrengungen unternommen, um die Anzahl der potenziell transplantierbaren Herzen zu erhöhen. Die viel diskutierte Xenotransplantation ist aktuell noch weit weg von der Umsetzung in unserem Alltag.
Eine weitere Errungenschaft der letzten Jahre ist Verwendung einer Ex-vivo-Perfusionsmaschine, des «organ care system» (OCS) von Transmedic. Diese Maschine ermöglicht es, ein Herz weit entfernt vom Zentrum des Empfängers zu entnehmen (z.B. >4 Flugstunden) und das Spenderherz in einem funktionellen Zustand (schlagend) und unter günstigen Bedingungen (Temperatur, Sauerstoffversorgung) zu halten, bis es im Krankenhaus des Empfängers eintrifft.
Zusätzlich ermöglicht das OCS die Beurteilung und den Transport eines gespendeten Herzens nach einem Herz-Kreislauf-Stillstand («donation after circulatory death», DCD). Diese Technik wird weltweit seit Jahren erfolgreich eingesetzt.
Schlussfolgerung
Neben der Anwendung von klassischen Herzinsuffizienzmedikamenten, strukturellen Reparaturen und Resynchronisationsschrittmachern sowie Defibrillatoren können wir Patienten, die noch symptomatisch sind, wirksame Behandlungen anbieten, um die Organperfusion wiederherzustellen und das Überleben und die Lebensqualität zu verbessern.
Dank
Unser Dank geht an Prof. Dr. med. Lukas Hunziker Munsch, Dr. med. Monika Fürholz, Dr. med. Michele Vittorio Martinelli und Prof. Dr. med. Matthias Siepe.
Literatur:
1 Aleef MCM, Labib A: Early mobilization and ICU rehabilitation of ECMO patients. Qatar Med J 2017; 2017: 71 2 Burzotta F et al.: Impella: pumps overview and access site management. Minerva Cardioangiol 2018; 66: 606-11 3 Zeschky C et al.: ‘Long-term’ use of Impella - safe to so? J Heart Lung Transplant 2022; 41: 187 4 Mehra MR et al.: Primary results of long-term outcomes in the MOMENTUM 3 pivotal trial and continued access protocol study phase: a study of 2200 HeartMate 3 left ventricular assist device implants. Eur J Heart Fail 2021; 23: 1392-400 5 Ambardekar AV et al.: Outcomes with ambulatory advanced heart failure from the Medical Arm of Mechanically Assisted Circulatory Support (MedaMACS) Registry. J Heart Lung Transplant 2019; 38: 408-17 6 Shah KB et al.: Left ventricular assist devices versus medical management in ambulatory heart failure patients: An analysis of INTERMACS profiles 4 and 5 to 7 from the ROADMAP study. J Heart Lung Transplant 2018; 37: 706-14 7 Spano G et al.: Ten-year retrospective cohort analysis of ventricular assist device infections. Artif Organs 2023; 47: 898-905 8 Mehra MR et al.: The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant 2016; 35: 1-23 9 De Charrière A et al.: ECMO in cardiac arrest: A narrative review of the literature. J Clin Med 2021; 10: 534 10 Schmidt M et al.: Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE) score. Eur Heart J 2015; 36: 2246-56 11 Ramzy D et al.: New surgical circulatory support system outcomes. ASAIO J 2020; 66: 746
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...