Kardiogener Schock: mechanische Kreislaufunterstützungssysteme wann und wie?
Autor:
Assoc. Prof. Priv.-Doz. Dr. Bernhard Richter
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Trotz des medizinischen Fortschritts ist der kardiogene Schock weiterhin mit einer sehr hohen Kurzzeitmortalität von 40–50% assoziiert. In zunehmendem Maße werden mechanische Kreislaufunterstützungssysteme („mechanical circulatory support devices“ – MCS) verwendet, welche effektiv Herzzeitvolumen und Organperfusion wiederherstellen können. Allerdings sind sie auch mit einer hohen Komplikationsrate behaftet und bis dato konnte in großen randomisierten Studien noch kein Mortalitätsbenefit durch MCS gezeigt werden.
Keypoints
-
Mechanische Kreislaufunterstützungssysteme (MCS) können im kardiogenen Schock ein adäquates Herzzeitvolumen und die Organperfusion wiederherstellen.
-
MCS sind eine „bridge to decision“, „to recovery“, zu einem Kunstherz oder einer Herztransplantation.
-
MCS sind mit häufigen, teils lebensbedrohlichen Komplikationen assoziiert.
-
Derzeit ist noch kein Mortalitätsbenefit durch MCS bewiesen, große randomisierte Studien sind im Laufen.
Die immer häufigere Verwendung von temporären MCS betrifft in erster Linie die veno-arterielle (VA) extrakorporale Membranoxygenierung (ECMO, verschiedene Anbieter) und die Impella® (Firma Abiomed in Danvers, MA, USA), während die früher häufig verwendete intraaortale Ballonpumpe (verschiedene Anbieter) im kardiogenen Schock aufgrund ihrer nur moderaten hämodynamischen Effekte ihre Bedeutung verloren hat. Das TandemHeart (TandemLife, Pittsburgh, PA, USA) spielt in Österreich (anders als in anderen Ländern) eine nur untergeordnete Rolle.
Im Gegensatz zu diesen temporären MCS, die für Stunden bis wenige Wochen auf der Intensivstation oder im Herzkatheterlabor eingesetzt werden, bieten komplett im Körper implantierte Kunstherzen (Left Ventricular Assist Device [LVAD], Biventricular Assist Device [BIVAD], Total Artificial Heart) eine langfristige, auch jahrelange hämodynamische Unterstützung und ermöglichen eine Entlassung der Patienten nach Hause.
MCS-Indikationen
Die Hauptindikation für temporäre MCS ist der kardiogene Schock, z.B. nach akutem Myokardinfarkt (mit und ohne mechanische Infarktkomplikationen wie Papillarmuskelabriss oder ischämischen Ventrikelseptumdefekt), bei fulminanter Myokarditis, dekompensierter chronischer Herzinsuffizienz, dekompensierten Klappenvitien, bei malignen Arrhythmien, akuter Pulmonalembolie, Graftversagen nach HTX und nach kardiochirurgischen Eingriffen. Neben dem kardiogenen Schock werden temporäre MCS auch im Rahmen von komplexen Koronarinterventionen („protected PCI“, v.a. Impella®) und elektrophysiologischen Eingriffen, bei Intoxikationen, bei akzidentieller Hypothermie und im Rahmen der extrakorporalen kardiopulmonalen Reanimation (ECPR) verwendet. Bei der ECPR wird eine VA-ECMO eingebaut, wenn durch konventionelle Reanimationsmaßnahmen kein spontaner Kreislauf wiederhergestellt werden kann.
Was sind MCS-Kontraindikationen?
Eine Kontraindikation gegen ein MCS ist das Fehlen einer reversiblen Schockursache oder von weiterführenden Therapieoptionen, wie Kunstherzimplantation oder Herztransplantation. Das MCS ist keine kausale Therapie für die Schockursache, sondern ist vielmehr eine „bridge to decision“, „to recovery“ oder zu weiterführenden Therapieoptionen. Weitere Kontraindikationen stellen Erkrankungen im Endstadium mit kurzer Lebenserwartung dar, wie zum Beispiel Malignome im Endstadium. Es gibt keine definitive Altersgrenze, hohes Alter ist aber natürlich ein wichtiger Faktor. Weitere absolute Kontraindikationen sind mittelschwere oder schwere Aorteninsuffizienz, schwere PAVK, Aortendissektion und Komorbiditäten, bei denen eine Vollantikoagulation nicht möglich ist (z.B. unkontrollierbare Blutungen, Schädel-Hirn-Trauma, intrakranielle Blutungen, nicht beherrschbare Koagulopathien etc.).
Klinischer Einsatz von MCS
Anhand der verfügbaren Evidenz kann die Frage nicht eindeutig beantwortet werden, welche Patienten in welchem Schockstadium von der Verwendung eines MCS letztendlich profitieren werden. In der klinischen Praxis werden MCS derzeit beim therapierefraktären kardiogenen Schock mit Zeichen einer Organminderperfusion eingesetzt, wenn es unter konventioneller Schocktherapie (Vasopressoren, positiv inotrope Medikamente, Volumentherapie, rasche Revaskularisation im akuten Myokardinfarkt, Atemhilfen etc.) zu keiner Besserung oder sogar zur Verschlechterung des kardiogenen Schocks kommt. Die Definition der Society for Cardiovascular Angiography and Interventions (SCAI) mit 5 Schockstadien bietet eine gute Entscheidungshilfe (Abb.1). MCS werden beim therapierefraktären SCAI-Stadium C (klassischer Schock, Charakteristika: Cardiac Index <2,2L/min/m2, PCWP >15 mmHg, Laktat >2mmol/l, Anstieg der Nierenretentionsparameter und Leberfunktionsparameter, Abnahme der Harnmenge, „mental confusion“, Zentralisierung mit kalten Extremitäten), vor allem aber beim Übergang zum Stadium D („deteriorating shock“, kontinuierlicher Anstieg von Laktat, Verschlechterung von Niere und Leber) innerhalb von 6 Stunden eingesetzt. Ziel ist es, durch das MCS die Organdurchblutung rasch wiederherzustellen, um weitere irreversible ischämische Organschäden und letztendlich ein Multiorganversagen mit hoher Mortalität zu verhindern. Ein zu später MCS-Einbau kann oft die dann schon sehr schlechte Prognose nicht mehr signifikant beeinflussen. Patienten in frühen Schockstadien (SCAI Stadium B) hingegen haben auch ohne MCS eine relativ gute Überlebenschance und würden durch eine MCS-Implantation den MCS-assoziierten, teils lebensbedrohlichen Komplikationen ausgesetzt werden.
Abb. 1: Klassifikationspyramide für kardiogenen Schock der Society for Cardiovascular Angiography and Interventions (SCAI)
Komplikationen
Die Komplikationsrate ist bei der VA-ECMO am höchsten und bei der intraaortalen Ballonpumpe am niedrigsten. Hauptkomplikationen sind Blutungen und Thromboembolien. Die Blutungsgefahr wird unter anderem durch die Notwendigkeit einer Vollantikoagulation (meist unfraktioniertes Heparin), durch Thrombozytenfunktionsstörungen, Thrombopenie, Koagulopathie, Hyperfibrinolyse und gehäufte Heparin-induzierte Thrombopenien bedingt. Bei der VA-ECMO kann es im extrakorporalen Kreislauf (Schlauchsystem/Oxygenator) zu Thrombenbildung mit konsekutiver Embolisation in Gehirn und andere Bereiche der arteriellen Strombahn kommen. An den intravaskulär gelegenen MCS-Komponenten kann es zu lokaler Thrombenbildung kommen. Des Weiteren besteht durch die Implantation der großlumigen Kanülen/Schleusen/MCS-Komponenten eine Gefahr von Gefäßkomplikationen, wie Dissektionen, Blutungen, Kompartmentsyndromen und Extremitätenischämien. Weitere Komplikationen sind Hämolyse und therapierefraktäre Sepsis. Die Verwendung von MCS erfordert ein ständiges Monitoring und rasches Reagieren auf Komplikationen durch ein multidisziplinäres Team, um die Morbidität und Mortalität in Bezug auf MCS-assoziierte Komplikationen möglichst gering zu halten.
ECMO-Funktionsweise & Varianten
Bei der VA-ECMO (Abb. 2) wird Blut durch eine Pumpe über eine venöse Kanüle in den extrakorporalen Schaltkreis angesaugt, im Oxygenator mit Sauerstoff angereichert und von Kohlendioxid befreit und über eine arterielle Kanüle retrograd in die Aorta rückgeführt. Die venöse und die arterielle Kanüle werden meist femoral mittels Punktion (oder chirurgisch) gelegt (meist zwischen 17 und 25 French), die Spitze der venösen Kanüle liegt dabei in der proximalen Vena cava inferior oder im rechten Vorhof, die arterielle Kanüle in der Aorta descendens. Alternativ kann das Blut über die Arteria subclavia rückgeführt werden (chirurgisch implantiert). Im Gegensatz zur VA-ECMO erfolgt bei der veno-venösen (VV-)ECMO (Abb.2) die Blutrückgabe in das venöse System (meist Vena cava superior). Damit bietet die VV-ECMO einen rein respiratorischen Support (Indikation: respiratorisches Versagen, z.B. bei Covid-19) und kann im kardiogenen Schock nicht eingesetzt werden. Die VA-ECMO hingegen bietet sowohl hämodynamische als auch respiratorische Unterstützung. Bei rein respiratorischem Versagen sollte aufgrund der geringeren Komplikationsrate und der besseren Oxygenierung der oberen Körperhäfte eine VV-ECMO verwendet werden. Bei einer femoral implantierten VA-ECMO wird nämlich die untere Körperhälfte besser als die obere Körperhälfte oxygeniert, was bei schweren Oxygenationsstörungen unzureichend sein kann. Dieses Problem kann zwar durch eine Blutrückführung über die Arteria subclavia behoben werden, was allerdings mit einem erhöhten Risiko für zerebrale Thromboembolien einhergeht. In speziellen Situationen sind auch VAV(veno-arteriell-venöse)-ECMO-Konstellationen mit Blutrückführung sowohl in das venöse als auch arterielle System sinnvoll.
Bei großen Kanülen und adäquatem Volumenstatus kann mit einer VA-ECMO das komplette Herzzeitvolumen (bis max. 6–7l/min) ersetzt werden. Die VA-ECMO ist sowohl bei links- als auch bei rechtsventrikulärem und kardiorespiratorischem Versagen geeignet und kann auch ohne Durchleuchtung auf der Intensivstation eingebaut werden. Einer ihrer größten Nachteile ist der Anstieg der linksventrikulären Nachlast bedingt durch die retrograde Blutrückgabe entgegen der normalen Blutflussrichtung. Diese erschwert es dem linken Ventrikel, selber Blut auszuwerfen, und führt zu einem Anstieg von linksventrikulären Füllungsdrücken, mechanischer Herzarbeit und myokardialem Sauerstoffverbrauch. Im schlimmsten Fall schafft es der linke Ventrikel gar nicht mehr, gegen den erhöhten Widerstand Blut auszuwerfen (nichtpulsatile arterielle Druckkurve, sich nicht mehr öffnende Aortenklappe im Herzecho). Diese Situation führt zu einer linksventrikulären Stase des Blutes mit der Gefahr von linksventrikulärer Thrombenbildung und therapierefraktärem Lungenödem. Durch das zusätzliche Einbringen einer linksventrikulären Impella® oder einer chirurgisch implantierten Kanüle in den linksventrikulären Apex mit Abfluss in den venösen ECMO-Schenkel kann der linksventrikuläre Durchfluss wiederhergestellt werden. Die Kombination von Impella® und VA-ECMO wird als „ECPella“ oder „ECMella“ bezeichnet.
Impella®
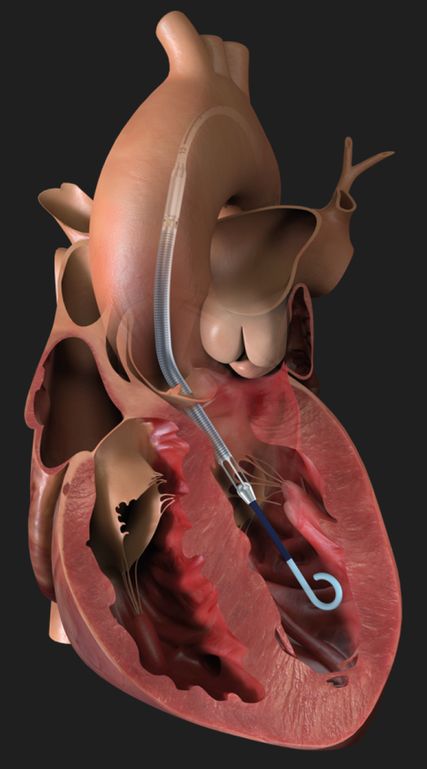
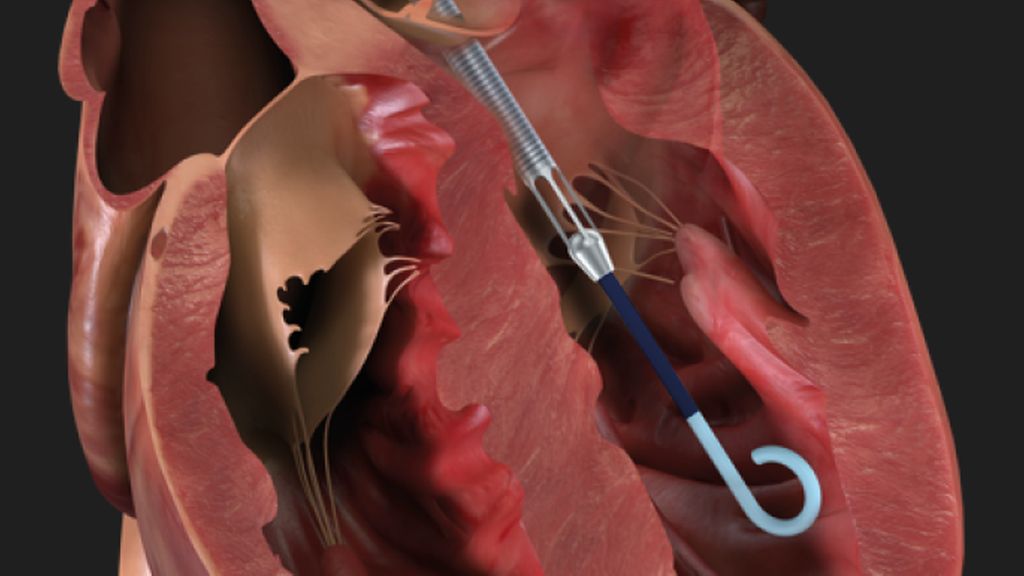
Abb. 3: Impella – das Inlet-Areal liegt im linken Ventrikel, das Outlet-Areal liegt in der Aorta ascendens (www.abiomed.de, 29.11.2022)
Die Impella® (Abb. 3) ist ein intrakorporales Herzunterstützungssystem, das für den linksventrikulären Support derzeit in zwei Größen verfügbar ist: die perkutan femoral gelegte Impella CP® (bis 3,7l/min, 14 French), welche unter Durchleuchtung über einen Draht in den linken Ventrikel eingebracht wird, sowie die Impella 5.5® (vormals Impella 5.0®), welche chirurgisch (meist über die Arteria axillaris) implantiert werden muss. Außerdem gibt es noch eine perkutan gelegte Impella RP® für den rechtsventrikulären Support, die derzeit aber noch seltener eingesetzt wird. Antrieb der Impella® ist eine mikroaxiale Pumpe, ein mit 50000U/min rotierender Impeller. Die Impella saugt Blut über ein Inlet-Areal im distalen, im linken Ventrikel liegenden Teil an und wirft es über ein Outlet-Areal wieder in die Aorta ascendens aus. Dadurch kommt es im Gegensatz zur VA-ECMO zu einer Entlastung („Unloading“) des linken Ventrikels, zu einer Senkung von linksventrikulären Füllungsdrücken, Nachlast, mechanischer Herzarbeit und myokardialem Sauerstoffverbrauch. Der arterielle Mitteldruck steigt an. Da die Impella ein zusätzliches Herzzeitvolumen von 3,7l/min (Impella CP®) bis 5,5l/min (Impella 5,5®) generieren kann, ist sie auch für den profunden kardiogenen Schock geeignet. Im Gegensatz zur VA-ECMO bietet sie keine respiratorische Unterstützung. Da eine linksseitig gelegte Impella nur den linken Ventrikel unterstützt, muss bei gleichzeitig bestehendem Rechtsherzversagen entweder zusätzlich eine VA-ECMO oder eine rechtsventrikuläre Impella RP® gelegt werden. Die Impella® wird auch bei der „protected PCI“ bei komplexen High-Risk-Interventionen im Herzkatheterlabor eingesetzt, wo sie meist periinterventionell für nur wenige Stunden zur Anwendung kommt.
Intraaortale Ballonpumpe
Die intraaortale Ballonpumpe (IABP; Abb. 4) hat im kardiogenen Schock aufgrund des IABP-Shock-II-Trials ihre Bedeutung verloren und ist laut den ESC-Leitlinien 2021 nur mehr eine Klasse-III-Empfehlung für die routinemäßige Anwendung (in speziellen Situationen, z.B. bei mechanischen Infarktkomplikationen, Klasse-IIb-Empfehlung).
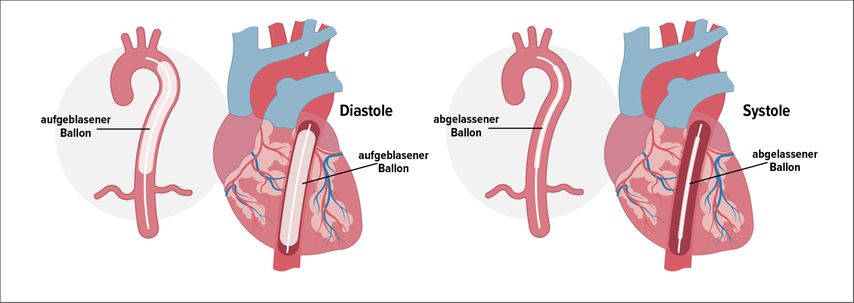
Abb. 4: Intraaortale Ballonpumpe (IABP): Wirkprinzip der Ballongegenpulsation
Die IABP bietet im Vergleich zur Impella®, zur VA-ECMO oder zum TandemHeart eine nur moderate hämodynamische Unterstützung und kann das Herzzeitvolumen um ca. 20% erhöhen, was im profunden kardiogenen Schock nicht ausreichend ist, aber bei leichten Schockformen, bei mechanischen Infarktkomplikationen oder bei dekompensierter Aortenstenose zu einer gewissen hämodynamischen Verbesserung führen kann. Grundsätzlich wird bei der intraaortalen Ballongegenpulsationherzsynchron in der Diastole ein Ballon in der Aorta descendens aufgeblasen, der den Abstrom von Blut nach distal verhindert und den diastolischen Druck in der Aorta ascendens und im Aortenbogen erhöht. Dadurch kommt es zu einem gesteigerten Koronarperfusionsdruck mit potenziell gesteigerter Koronardurchblutung sowie zu einer gesteigerten zerebralen Durchblutung. Durch das rasche Ablassen des Ballons in der Systole entsteht ein Unterdruck, der zur Senkung der linksventrikulären Nachlast, der linksventrikulären Füllungsdrücke und der Wandspannung sowie zur Senkung des linksventrikulären Sauerstoffverbrauchs führt. Die Ballonpumpe ist das MCS, welches am meisten bekannt und verbreitet ist, es ist vergleichsweise einfach zu legen und hat vergleichsweise niedrige Komplikationsraten und Kosten. In manchen Zentren wird es noch im Herzkatheterlabor im Rahmen der „protected PCI“ verwendet, wobei auch in dieser Indikation die Impella® aufgrund ihres stärkeren hämodynamischen Supports überlegen sein dürfte.
TandemHeart
Das TandemHeart ist eine perkutane extrakorporale Zentrifugalpumpe, welche in verschiedensten Konstellationen für links, rechts- oder biventrikuläres Versagen zur Verfügung steht und bis zu 5l/min Herzzeitvolumen generieren kann. In der klassischen Konfiguration wird Blut aus dem linken Atrium entnommen und über die Femoralarterie wieder rückgeführt. Um die Kanüle im linken Atrium zu platzieren, ist eine transseptale Punktion erforderlich. Das TandemHeart spielt in Österreich derzeit eine untergeordnete Rolle.
Studienlage
Trotz der ausgeprägten hämodynamischen Effekte der Impella®, der VA-ECMO und des „TandemHearts“ und der Möglichkeit, die Organperfusion mit diesen Devices wiederherzustellen, ist es bis jetzt nicht gelungen, einen Mortalitätsbenefit im kardiogenen Schock in randomisierten Studien zu zeigen. Die bisherigen randomisierten Studien waren klein und inkludierten meist ein relativ heterogenes Patientenkollektiv. In Metaanalysen aus Beobachtungsstudien zeigten sich inkonklusive Resultate. Aufgrund der derzeit unzureichenden Datenlage stellt die Verwendung der temporären MCS im kardiogenen Schock in den ESC-Leitlinien 2021 eine Klasse-IIa-Empfehlung (Level of Evidenz C) dar. Derzeit sind zwei große randomisierte Studien im Laufen: einerseits der „DanGer Shock Trial“, der konventionelle Therapien vs. konventionelle Therapie + Impella® bei Patienten mit akutem Myokardinfarkt und kardiogenem Schock vergleicht, und andererseits die „ECLS SHOCK“-Studie, die konventionelle Therapie vs. konventionelle Therapie + VA-ECMO bei Patienten mit akutem Myokardinfarkt und kardiogenem Schock vergleicht. Die „ECLS SHOCK“-Studie wird voraussichtlich schon im Laufe des nächsten Jahres Daten präsentieren.
Fazit
Bis zum Vorliegen besserer Studien gibt es noch viele offene Fragen bezüglich Indikation, Zeitpunkt und Art der Anwendung eines MCS und diese Entscheidungen sollten personalisiert in einem erfahrenen Zentrum getroffen werden.Eine zu frühe Indikationsstellung gefährdet Patienten, die vermutlich auch ohne MCS überleben würden, durch potenziell lebensbedrohliche MCS-assoziierte Komplikationen. Eine zu späte MCS-Implantation bei bereits irreversiblen ischämischen Organschäden kann die schon sehr schlechte Prognose vermutlich auch nicht mehr positiv beeinflussen. Neben der Anwendung im richtigen Schockstadium sind auch die Auswahl des für den jeweiligen Schocktyp am besten geeignete Devices, ein striktes Monitoring und Reagieren auf potenzielle Komplikationen und das weiterführende Patientenmanagement bezüglich nachfolgender Therapieoptionen für das Outcome des Patienten von entscheidender Bedeutung.
Literatur:
• Geller BJ et al.: Escalating and de-escalating temporary mechanical circulatory support in cardiogenic shock: A scientific statement from the American Heart Association. Circulation 2022; 146(6): e50-68 • Thiele H et al.: Management of cardiogenic shock complicating myocardial infarction: An update 2019. Eur Heart J 2019; 40(32): 2671-83