Kardiomyopathien, ein Update
Autor:
Dr. med. Federico Moccetti
Oberarzt mbF
Kardiologie, Interventionelle Kardiologie
Luzerner Kantonsspital, Luzern
E-Mail: federico.moccetti@luks.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dieses Update beschränkt sich auf drei praxisrelevante Kardiomyopathien: die hypertrophe Kardiomyopathie, die kardiale Amyloidose und die Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF). Letztere scheint auf den ersten Blick eine Diagnose zu sein, die eigentlich in die Schublade «Herzinsuffizienz» gehört, es gibt jedoch Überlappungen mit den Kardiomyopathien und das diagnostische Vorgehen sowie die Pitfalls/Gefahren der Fehldiagnose sind die gleichen wie bei den Kardiomyopathien.
Keypoints
-
Die hypertrophe Kardiomyopathie ist nicht selten, die meisten Patienten sind 50–70 Jahre alt. Mavacamten, ein neues Medikament, ist in ersten klinischen Studien vielversprechend.
-
Die kardiale Amyloidose ist häufiger als früher angenommen. Die Diagnostik ist einfacher geworden, mehrere Ursachen sind behandelbar.
-
Hinter der Diagnose HFpEF (Herzinsuffizienz mit erhaltener Pumpfunktion) können sich andere Ursachen der Dyspnoe verbergen, wie kardiale Amyloidose, Valvulopathien (Aortenstenose, Mitralinsuffizienz), koronare Herzerkrankung (mit Dyspnoe als Angina-Äquivalent), konstriktive Perikarditis, restriktive Kardiomyopathie oder andere Kardiomyopathien.
-
Zentral ist deshalb das Erkennen von «red flags» (s. Tab. 1).
Hypertrophe Kardiomyopathie
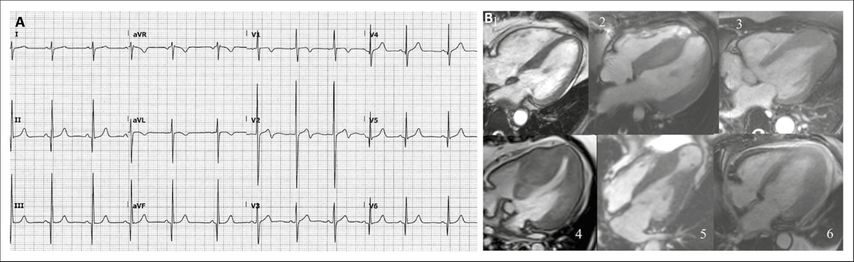
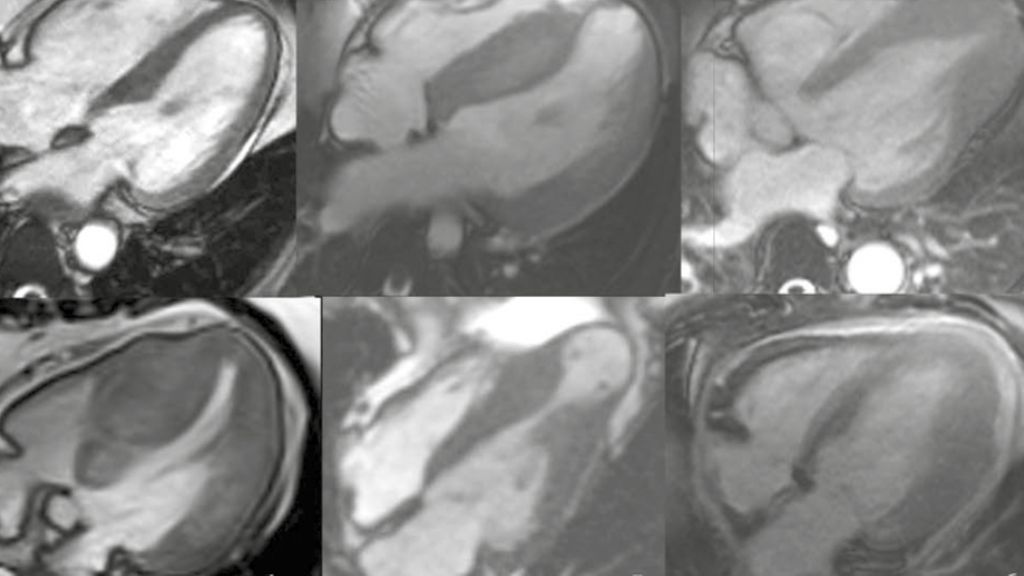
Die hypertrophe Kardiomyopathie (HCM) beruht auf Mutationen von Genen, welche für den kontraktilen Apparat codieren. Dadurch entstehen Myofibrillen, die nicht wie gewohnt, sondern durcheinander («in disarray») angeordnet sind, woraus hypertrophe Kardiomyozyten resultieren. Die makroskopische Übersetzung dieser zellulären Hypertrophie kann je nach Ausprägung und anatomischer Lokalisation (von septumbetont bis zu lediglich apikal lokalisiert) verschiedene Formen annehmen (Abb. 1). Eine der häufigsten Fehlannahmen ist, dass sich die HCM bereits im Kindes-/jungen Erwachsenenalter manifestiert. Es handelt sich zwar um eine genetische Erkrankung, aber der Phänotyp (Hypertrophie) und die damit verbundenen Symptome treten bei der Mehrzahl der Patienten erst im Erwachsenenalter (zweite Lebenshälfte) auf.
Abb. 1: A) EKG mit Hypertrophiezeichen; B) MRI verschiedener Formen der HCM: 1) normales Herz als Vergleich; 2) HCM, keine Ausflusstraktobstruktion; 3) HCM, apikale Form; 4) HCM mit Ausflusstraktobstruktion (HOCM); 5) HCM, midventrikuläre Obstruktion, mit apikalem Aneurysma; 6) HCM, Hypertrophie vor allem der anterolateralen Wand
Die 3 hauptsächlichen Symptome und Komplikationen der HCM sind: Dyspnoe, Synkope und plötzlicher Herztod. Glücklicherweise ist der plötzliche Herztod dank moderner Therapien, des Screenings und des gut selektionierten Einsatzes von Defibrillatoren (ICD) selten geworden.
Die 3 hauptsächlichen Ursachen der Dyspnoe bei Patienten mit HCM sind: Ausflusstraktobstruktion und/oder diastolische Dysfunktion des hypertrophen und «steifen» Ventrikels. Zusätzlich kann bei gewissen Patienten eine Interaktion zwischen dem anatomisch eng benachbarten, hypertrophen Septum und dem anterioren Mitralklappensegel entstehen, welche zu einer Mitralinsuffizienz führen kann (SAM, «systolic anterior movement»).
Durch den Einsatz von Betablockern und Kalziumantagonisten (und seltener negativ inotropen Medikamenten) können Ausflusstraktobstruktion und SAM verringert werden. Wenn die medikamentöse Therapie nicht ausreicht, besteht die Möglichkeit, das hypertrophe Septum physikalisch (entweder mittels chirurgischer Myektomie oder interventioneller Septumablation) zu beseitigen.
In den letzten zwei Jahren haben einige klinische Studien positive Resultate für den Einsatz von Mavacamten bei stark symptomatischen Patienten mit HCM gezeigt. Bei Mavacamten handelt es sich um ein stark negativ inotropes Medikament. In der VALOR-HCM-Studie wurde es bei Patienten (n=112, 60-jährig, 49% Frauen) mit ausgeprägter Dyspnoe (93% davon NYHA III–IV), bei welchen die Erkrankung derart ausgeprägt war, dass sie für eine interventionelle oder chirurgische Myektomie qualifizierten, untersucht. Nach 16 Wochen Therapie mit Mavacamten oder Placebo war bei 63% der Patienten in der Mavacamten-Gruppe eine Reduktion der Dyspnoe um ≥1 NYHA-Klasse zu verzeichnen (vs. 21% in der Placebogruppe). Der Gradient im Ausflusstrakt konnte ebenfalls auf deutlich niedrigere Werte reduziert werden: 14mmHg unter Mavacamten vs. 46mmHg unter Placebo. Am Ende der Studie qualifizierten in der Mavacamten-Gruppe nur noch 18% der Patienten für eine chirurgische oder interventionelle Myektomie (77% in der Placebogruppe).1
Kardiale Amyloidose
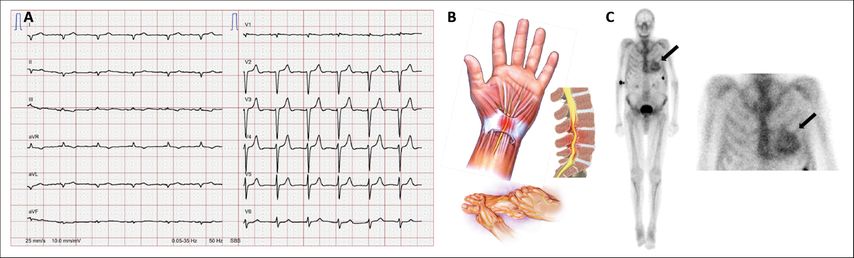
Bei der kardialen Amyloidose kommt es zu einer Ablagerung von Proteinen im Herzmuskel. Die zwei häufigsten Ursachen sind die AL-Amyloidose, i.d.R. bei multiplem Myelom, und die Transthyretin(ATTR)-Amyloidose. Transthyretin ist ein Transportprotein für Tyroxin und Retinol (Vitamin A). Aufgrund einer Fehlfaltung des Proteins kommt es zu einer pathologischen Ablagerung desselben im Myokard. Das Hauptsymptom ist die Dyspnoe, die «red flags» sind das EKG mit Niedervoltage (meistens periphere Niedervoltage in den Extremitätenableitungen) oder eine Pseudoinfarktkonstellation im EKG (Abb. 2A). Dies ist besonders suspekt, wenn die Echokardiografie eine Myokardhypertrophie zeigt («viel Muskel, wenig Strom»). Klinische und anamnestische «red flags» sind (bilaterales) Karpaltunnelsyndrom, Spinalkanalstenose und Polyneuropathie (Abb. 2B).
Während sich die Diagnostik und Therapie der AL-Amyloidose nicht wesentlich verändert hat und auf der Diagnose und Therapie des multiplen Myeloms beruht, hat sich bei der ATTR-Amyloidose einiges getan. Die Diagnostik, die früher häufig eine Biopsie benötigte, ist heute durch die Möglichkeit der Szintigrafie deutlich vereinfacht worden. Hierfür können Tracer benutzt werden, die häufig für Knochenszintigrafie eingesetzt werden (Tc-PYP oder Tc-DPD). Die Untersuchung ist einfach (lediglich eine Injektion des radioaktiven Tracers über einen venösen Zugang und eine kurze Aufnahme unter der Kamera). Die Anreicherung des radioaktiven Tracers im Myokard (Abb. 2C) erlaubt die Diagnose einer ATTR-Amyloidose mit einer hohen Sensitivität und Spezifizität. Die Diagnosestellung hat seit wenigen Jahren auch eine therapeutische Konsequenz: Falls die Kriterien erfüllt sind, kann Tafamidis verabreicht werden. Das Medikament stabilisiert das Transthyretin-Tetramer und verhindert die Fehlfaltung des Proteins (und somit die Akkumulation im Myokard). Die ATTR-ACT-Studie mit 440 Patienten (randomisiert zu Tafamidis oder Placebo) konnte eine relative Reduktion der Mortalität um 30% und der Hospitalisationen um 32% zeigen.2
Abb. 2: A) EKG bei kardialer Amyloidose mit peripherer Niedervoltage und «Pseudoinfarkt-Konstellation»; B) einige «red flags» der Amyloidose; C) DPD-Technetium-Szintigrafie mit Anreicherung des Tracers im Myokard, typisch für ATTR-Amyloidose
HFpEF
Die Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF) hat in den letzten Jahren viel Aufmerksamkeit erhalten. Nachdem jahrzehntelange für kein Medikament, das bei dieser Erkrankung getestet wurde, ein Vorteil nachgewiesen werden konnte, ergab die EMPEROR-Preserved-Studie 2021 erstmals ein positives Resultat: Der SGLT2-Inhibitor Empagliflozin ist das erste Medikament, für das bei HpEF eine Reduktion der Herzinsuffizienz-bedingten Hospitalisationen gezeigt wurde.3
Epidemiologische Studien zeigen, dass HFpEF keine Seltenheit ist und wahrscheinlich gleich häufig vorkommt wie die «gewöhnliche» Herzinsuffizienz mit reduzierter Pumpfunktion (HFrEF).4
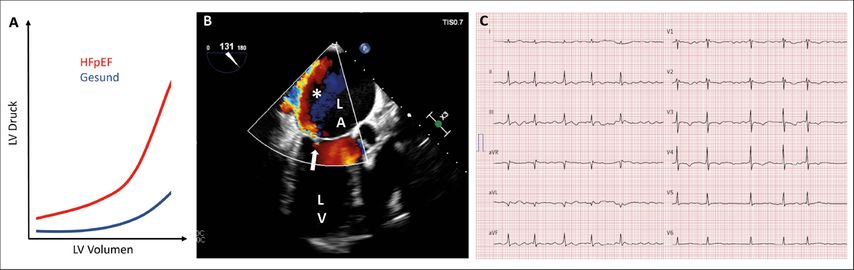
Ähnlich wie bei der HCM und der kardialen Amyloidose stellt sich ein Patient mit HFpEF in Ihrer Praxis mit Dyspnoe oder Leistungsintoleranz vor. Zentral für die Diagnose sind zusätzlich zur Anamnese und klinischen Untersuchung (vor allem sorgfältige Auskultation) das EKG, die Bestimmung von BNP sowie die Echokardiografie. Gemäss unserer Erfahrung und den aktuellen Guidelines5 reichen für die Diagnose die oben erwähnten diagnostischen Tools jedoch nicht immer aus, d.h., dass es nach Anamnese, EKG, BNP-Messung, eventueller pneumologischer Untersuchung und Echokardiografie häufig noch nicht eindeutig ist, ob man die Diagnose HFpEF tatsächlich stellen kann. In solchen Fällen schafft die Rechtsherzkatheteruntersuchung Klarheit (Abb. 3A). Diese kann über einen venösen Zugang (in unserer Klinik meistens die V. cubitalis) ambulant durchgeführt werden. Bei der HFpEF ist der PCWP oder «Wedge-Druck» – kurz gesagt der Druck, der während des gesamten Herzzyklus im linken Vorhof und folglich auch in der Lunge herrscht – viel zu hoch. Dies kann bereits in Ruhe der Fall sein oder bei etwa der Hälfte der Fälle erst unter Belastung.
Abb. 3: A) Druck-Volumen-Beziehung des linken Ventrikels bei Gesunden und bei Patienten mit HFpEF: Bei HFpEF erzeugt bereits eine kleine Zunahme des Volumens im «steifen» Ventrikel eine erhebliche Zunahme des Drucks, der an den linken Vorhof und die Lungengefässe weitergegeben wird und zu Dyspnoe führt. B) Transösophageale Untersuchung der Patientin im erwähnten Fallbeispiel, bei der der stark exzentrische Insuffizienzjet (*) der Mitralklappe (Pfeil) sichtbar ist (LA: linker Vorhof; LV: linker Ventrikel). C) EKG der Patientin im Fallbeispiel
Dyspnoe plus erhaltene Pumpfunktion gleich HFpEF? Nicht immer!
Die Kombination von Dyspnoe und echokardiografisch erhaltener Pumpfunktion ist häufig, was dazu geführt hat, dass der Begriff HFpEF häufig verwendet wird, sobald ein Patient beides aufweist. Dies birgt die Gefahr, dass die Diagnose HFpEF ein Sammelsurium von verschiedenen kardiovaskulären und pneumologischen Problemen wird. Wie bei den Kardiomyopathien ist deshalb auch hier das Augenmerk auf die «red flags» wichtig. In meinem klinischen Alltag habe ich mehrere Patienten mitbetreut, welche mit der Diagnose HFpEF «gelabelt» waren, bei denen sich aber nach genauerem Hinschauen eine ganz andere Ursache für die Symptome herausstellte.
Als Beispiel sei eine 61-jährige Patientin erwähnt, welche nach mehreren Monaten mit progredienter Dyspnoe aufgrund einer kardialen Dekompensation hospitalisiert werden musste. Nach Rekompensation mit Diuretika zeigte die Echokardiografie eine LVEF von 65%, keine Wandbewegungsstörungen und keine Vitien. Es wurde die Diagnose HFpEF gestellt. Kurz darauf kontaktierte uns die Hausärztin der Patientin mit der Frage, welche Erklärung wir für das 3/6-Systolikum hätten. In der erneuten Echokardiografie in unserer Sprechstunde war keine Mitralinsuffizienz zu sehen, aber die transösophageale Untersuchung ergab schliesslich eine schwere Mitralinsuffizienz mit einem extrem exzentrischen Jet entlang der Vorhofwand (der transthorakal nicht gesehen werden konnte; Abb. 3B). Nach der operativen Mitralklappenrekonstruktion war die Patientin frei von Dyspnoe. Dieser Fall illustriert, wie andere Diagnosen fälschlicherweise als HFpEF klassifiziert werden können.
Die «red flags» zu kennen und zu erkennen (Tab. 1) hilft häufig dabei, zur korrekten Diagnose und Therapie zu kommen.
Literatur:
1 Olivotto I et al.; EXPLORER-HCM study investigators: Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2020; 396: 759-69 2 Maurer MS et al.; ATTR-ACT Study Investigators: Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med 2018; 379: 1007-16 3 Anker SD et al.; EMPEROR-Preserved Trial Investigators: Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385: 1451-61 4 Owan TE et al.: Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006; 355: 251-9 5 Pieske B et al.: How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J 2019; 40: 3297-317
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...