HCM: Mavacamten langfristig wirksam
Bericht:
Reno Barth, Medizinjournalist
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In der Studie VALOR-HCM reduzierte der Myosin-Inhibitor Mavacamten (Camzyos®) bei erwachsenen Patienten mit symptomatischer, hypertropher obstruktiver Kardiomyopathie (HOCM) den Bedarf einer Septumreduktion signifikant. Die nun präsentierte Auswertung der offenen Verlängerung der Studie zeigt eine anhaltend gute Wirksamkeit und Verträglichkeit von Mavacamten.
Fortschritte, aber nach wie vor Herausforderungen bei Erstellung der Leitlinie
Die HOCM wurde und wird unter anderem mit Betablockern oder Calciumkanalblockern behandelt.1 Eine gezielt in den Pathomechanismus eingreifende Therapie gab es bis vor Kurzem nicht. Für die Pathophysiologie der Erkrankung ist eine exzessive kardiale Kontraktilität wichtig, die unter anderem zu einer verringerten diastolischen Füllung des Herzens führt.2,3 Mit Mavacamten wurde kürzlich eine kausale orale Therapie der HOCM zugelassen. Durch die reversible Bindung an kardiales Myosin vermindert Mavacamten die Anzahl der Aktin-Myosin-Querbrückenverbindungen, die für die Hyperkontraktilität und damit für die linksventrikuläre Hypertrophie und die verringerte Herzmuskelelastizität verantwortlich sind. Bei symptomatischen Patienten mit hämodynamisch relevantem LVOT-Gradienten trotz maximal verträglicher medikamentöser Therapie war bislang eine septale Reduktionstherapie (SRT), die chirurgisch oder mittels Alkoholablation durchgeführt werden kann, die letzte Option für Symptomlinderung und Gradientsenkung.1
Die 2023 ESC Guidelines für Kardiomyopathien empfehlen den Einsatz von Mavacamten nun vor einer SRT (IIa-A-Empfehlung).1
Die VALOR-HCM-Studie
In der placebokontrollierten Phase-III-Studie VALOR-HCM wurde ein Kollektiv von Patienten mit HOCM untersucht, bei dem trotz maximal verträglicher medikamentöser Therapie eine SRT indiziert war. Primärer Studienendpunkt nach einem 16-Wochen-Follow-up war ein Komposit aus der Patientenentscheidung für eine SRT und der Eignung des Patienten für diesen Eingriff gemäss der 2011 ACC/AHA-Leitlinie. Diesen Endpunkt erfüllten nach 16 Wochen 17,9% der Verum- und 76,8% der Placebopatienten. Das heisst, bei ca. 82% der Patienten, die Mavacamten erhielten, war eine SRT nach 16 Wochen nicht mehr erforderlich oder gewünscht.4
Die VALOR-HCM-Studie wurde fortgeführt, wobei die Patienten der Placebogruppe nun auf Mavacamten umgestellt wurden. Eine vor Kurzem publizierte Auswertung nach 32 Wochen ergab, dass die 32-wöchige Behandlung mit Mavacamten zu einer weiteren Verringerung des Anteils der Patienten führte, die sich für eine SRT entschieden oder dafür infrage kamen. Bei Patienten, die nach 16 Wochen von Placebo auf Mavacamten umgestellt wurden, ging der Anteil an Patienten, die den Kompositendpunkt erfüllten, von 76,8% auf 13% zurück.5
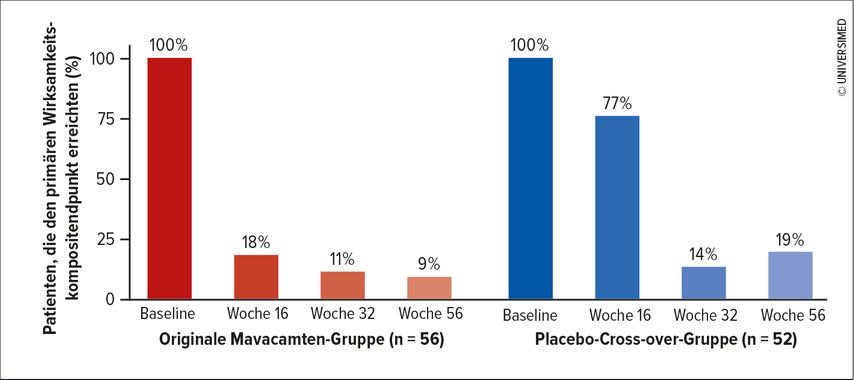
Im Rahmen des ESC-Kongresses präsentierte Studien-Erstautor Prof. Milind Desai, Cleveland Clinic, Ohio, nun eine Auswertung des Follow-ups über 56 Wochen. Die ursprüngliche Placebogruppe wurde getrennt ausgewertet. Die Langzeitauswertung zeigt ein nach wie vor konsistentes Ansprechen auf Mavacamten. Während bei Einschluss in die Studie 100% der Patienten in beiden Armen die Leitlinienkriterien für eine SRT erfüllten, waren es nach 56 Wochen in der ursprünglichen Verumgruppe nur noch 9% und in der ehemaligen Placebogruppe, die im Verlauf auf Mavacamten umgestellt wurde, 19% (Abb. 1).6 Prof. Desai: «Neun von zehn Patienten haben entschieden, dass sie keine Septumreduktion wollen.»
Abb. 1: Primärer Wirksamkeitskompositendpunkt: Patientenentscheidung für eine SRT und Eignung des Patienten für diesen Eingriff gemäss Leitlinie (modifiziert nach Desai et al., 2023)6
In der ursprünglichen Verumgruppe zeigte die Behandlung mit Mavacamten nach 56 Wochen bei 93% der Patienten eine Verbesserung um mindestens 1 NYHA-Klasse und bei 44% um mindestens 2 NYHA-Klassen. In der anfänglichen Placebogruppe waren es nach 40 Wochen Mavacamten 73% mit einer Verbesserung um 1 NYHA-Klasse und 35% um 2 NYHA-Klassen. Die Wirksamkeit war bei beiden Geschlechtern gleich gut. Es gab insgesamt nur drei Therapieabbrüche. Unterbrechungen wegen abnehmender linksventrikulärer Auswurffraktion waren in 12 Fällen erforderlich; 9 Patienten konnten die Therapie wieder aufnehmen und die Studie abschliessen
Die Auswertung zeigte auch Verbesserungen der Obstruktion des linksventrikulären Ausflusstrakts (LVOT), sowohl in Ruhe als auch unter Valsalva-Manöver, sowie des prognostischen Biomarkers NTproBNP und des hochsensitiven Troponin I. Die Lebensqualität verbesserte sich und blieb über die gesamte Studie hinweg auf hohem Niveau.
Quelle:
ESC-Kongress 2023, Session «Late-breaking science on valve disease and hypertrophic cardiomyopathy». 29. August, Amsterdam
Literatur:
1 Arbelo E et al.: 2023 Guidelines for the management of cardiomyopathies: Developed by the task force on the management of cardiomyopathies of the European Society of Cardiology (ESC). Eur Heart J 2023; (00): 1-124
2 Anderson RL et al.: Deciphering the super relaxed state of human β-cardiac myosin and the mode of action of mavacamten from myosin molecules to muscle fibers. Proc Natl Acad Sci U S A 2018; 115: E8143-52
3 Nag S et al.: The myosin mesa and the basis of hypercontractility caused by hypertrophic cardiomyopathy mutations. Nat Struct Mol Biol 2017; 24: 525-334
4 Desai MY et al.: Myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy. J Am Coll Cardiol 2022; 80: 95-108
5 Desai MY et al.: Dose-blinded myosin inhibition in patients with obstructive hypertrophic cardiomyopathy referred for septal reduction therapy: outcomes through 32 weeks. Circulation 2023; 147: 850-63
6 Desai MY et al.: Mavacamten in patients with hypertrophic cardiomyopathy referred for septal reduction week 56 results from the VALOR-HCM randomized clinical trial. JAMA Cardiol 2023; Aug 28: e233342 [online ahead of print]
Kurzfachinformation:
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind auf-gefordert, den Verdacht einer neuen oder schwerwiegenden Neben-wirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe «Unerwünschte Wirkungen».
CAMZYOS® (Mavacamten). WWH: Kann Herzinsuffizienz aufgrund systolischer Dysfunktion auslösen. Echokardiografische Untersuchungen der LVEF vor und während Anwendung erforderlich. Behandlungsbeginn bei LVEF <55% nicht empfohlen. Behandlungsunterbruch bei LVEF <50% oder Verschlechterung des klinischen Zustands. Vorsicht bei gleichzeitiger Gabe von bestimmten CYP450-Inhibitoren und -Induktoren wegen Herzinsuffizienzrisiko geboten. I: Behandlung erwachsener Patienten mit symptomatischer (NYHA II-III) obstruktiver hypertropher Kardiomyopathie zur Verbesserung der körperlichen Leistungsfähigkeit und assoziierter Symptome. D: 2,5 mg, 5 mg, 10 mg oder 15 mg 1x/d. Die empfohlene Initialdosis beträgt 5 mg 1x/d, die Maximaldosis beträgt 15 mg 1x/d. Die Initiierung oder Auftitrierung von CAMZYOS® bei Patienten mit LVEF <55% ist nicht empfohlen. Eine regelmässige Bewertung des LVEF und des LVOT-Gradienten unter Valsalva ist für eine sorgfältige Titration erforderlich, um eine LVEF ≥50% aufrechtzuerhalten und einen angemessenen Ziel-Valsalva-LVOT-Gradienten zu erreichen. Für Titrationshinweise während der Initiierungs- und Erhaltungsphase, Dosisanpassungen bei gleichzeitiger Gabe anderer Arzneimittel und bei Behandlungsunterbruch siehe Fachinformation. Bei LVEF <50% während der Behandlung mit CAMZYOS®, muss die Behandlung unterbrochen werden. KI: Überempfindlichkeit gegen Wirkstoff oder Hilfsstoffe. Schwangerschaft. W/VM: Mavacamten verringert LVEF und kann Herzinsuffizienz durch systolische Dysfunktion auslösen. Asymptomatische LVEF-Reduktion, interkurrente Erkrankungen (z.B schwere Infektionen) und Arrhythmien bei der Dosierung berücksichtigen. Regelmässige Beurteilung des klinischen Zustands vor und während der Behandlung mit CAMZYOS®. IA: Bei Initiierung, Absetzen oder Dosisanpassung einer gleichzeitigen Anwendung mit starkem CYP2C19-Inhibitor wird Dosisanpassung von Mavacamten und/oder zusätzliche klinische Kontrolle empfohlen. Diese sollten in Betracht gezogen werden bei moderatem oder schwachem CYP2C19- oder starkem CYP3A4-Inhibitor. Bei Absetzen oder Dosisreduktion der gleichzeitigen Behandlung mit starkem CYP2C19- oder CYP3A4-Induktor, werden zusätzliche klinische Kontrollen empfohlen. Diese sollten in Betracht gezogen werden bei Initiierung oder Dosiserhöhung des Induktors. Intermittierende Gabe von CYP2C19-Hemmer oder starkem CYP2C19-Induktor oder starkem CYP3A4-Hemmer oder -Induktor nicht empfohlen. UAW: Schwindel, Herzinsuffizienz, systolische Dysfunktion (LVEF < 50%). P: Hartkapseln zu 2,5 mg, 5 mg, 10 mg oder 15 mg: 28. (B). ZI: Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Ausführliche Informationen siehe Arzneimittel-Fachinformation unter www.swissmedicinfo.ch. (V001)
Publireportage, organisiert und finanziert von Bristol-Myers Squibb
CV-CH-2300061 09.2023