Pulmonalvenenstenosen nach Ablationsbehandlung von Vorhofflimmern
Autor:
Dr. Thomas Sturmberger
Interne 2
Kardiologie, Angiologie & Interne Intensivmedizin
Ordensklinikum Linz
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die kathetergestützte Pulmonalvenenisolation (PVI) ist in der Behandlung von Vorhofflimmern eine etablierte Therapieoption. In zahlreichen Studien konnte die Effektivität dieser Methode bewiesen werden. Sie führt zur Reduktion der Vorhofflimmerepisoden, zu einem Mortalitätsbenefit bei Patienten mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) und zur Verbesserung der Lebensqualität.
Keypoints
-
Ursache für das Entstehen von Pulmonalvenenstenose (PVS) nach einer Ablation im Bereich der Pulmonalvenen sind thermische Schäden.
-
Bei Symptomen wie Dyspnoe, Husten, Hämoptysen und Leistungseinschränkung ca. 3–5 Monate nach einer Ablation sollte an eine PVS gedacht werden.
-
Die Diagnosestellung erfolgt mittels CT.
-
Bei symptomatischen, signifikanten PVS sollte eine interventionelle Revaskularisation an einem Zentrum durchgeführt werden.
-
Der Stentimplantation sollte wegen der signifikant niedrigeren Restenose-Rate der Vorzug gegenüber einer Ballondilatation gegeben werden.
Entsprechend der Studienlage ist die Katheterablation zur Behandlung von Vorhofflimmern in den europäischen Guidelines mit unterschiedlichen Empfehlungsgraden etabliert.1 Eine invasive Intervention geht aber unweigerlich auch mit Komplikationen einher, sodass bei diesen Therapieformen nicht nur die Effektivität, sondern auch die Sicherheit der Methode ins Kalkül gezogen werden muss. Die Komplikationsrate der PVI hängt naturgemäß von der Erfahrung des Zentrums ab und liegt insgesamt bei etwa 5,5%, wobei Blutungen die mit Abstand häufigste Komplikation sind.2 Eine seltene Komplikation der PVI stellt die Pulmonalvenenstenose (PVS) dar.
Zu Beginn der PVI waren Pulmonalvenenstenosen noch häufiger, da frühere Techniken fokale und segmentale Areale distal der venösen Ostien involvierten und zu einer Prävalenz bis 42% führten.3
PVS treten bei Kryoballonverfahren und bei Radiofrequenztherapie auf
Durch die technische Weiterentwicklung mit zirkumferentieller Ablation und atrialer Isolation konnte die Inzidenz der PVS auf 0,32%–3,4% gesenkt werden. Ursache der PVS ist der thermische Schaden, der durch die Ablationsbehandlung gesetzt wird.4 Daher wird diese Komplikation sowohl beim Kryoballonverfahren (Kälte) als auch bei der Radiofrequenztherapie (Hitze) beobachtet.
Am häufigsten sind die linksseitigen Pulmonalvenen betroffen, wobei bisher keine definitive Erklärung dieses Phänomens beschrieben wurde. Möglicherweise spielen der kleinere Diameter der unteren PV links, die relativ kraniale Ausrichtung des Ostiums der oberen PVlinksund die anatomische Nähe zur Coumadin-Ridge, welche eine Ablation näher am Ostium bedingt, eine Rolle.
K. Tokutake et al. konnten zeigen, dass es sowohl anatomische als auch prozedurale Prädiktoren für das Auftreten von PVS bei der Anwendung der Kryoballontechnik gibt. Eine horizontale Einmündung der Lungenvenen in den linken Vorhof, das nichtkoaxiale Platzieren des Kryoballons und eine damit verbundene größere Ballon-Kontakt-Ratio begünstigen das Auftreten von PVS.5
Typischerweise treten Symptome etwa 3–5 Monate nach der Prozedur auf. Die Symptome sind eher unspezifisch mit Hämoptysen, Dyspnoe, Husten und eingeschränkter Leistungsbreite, sodass die Diagnosestellung oftmals verzögert wird. Hochgradige PVS können zu einer venösen Kongestion und zu Pulmonalembolien führen.
CT zur Diagnostik
Bei vorliegendem Verdacht auf eine PVS sollte eine CT, eventuell mit 3D-Rekonstruktion (Abb. 1), durchgeführt werden. Sollte sich die Verdachtsdiagnose bestätigen, empfiehlt sich anschließend ein Lungenperfusions- und -ventilationsscan, um Perfusionsausfälle (Mismatch) im korrespondierenden Bereich der Lunge erfassen zu können. Patienten und Patientinnen mit milder bis moderater PVS <70% sind zumeist asymptomatisch. Im Falle signifikanter Stenosen >70% mit entsprechenden Symptomen sollte eine Therapie erfolgen, wobei chirurgische und kathetergestützte Verfahren zur Verfügung stehen.
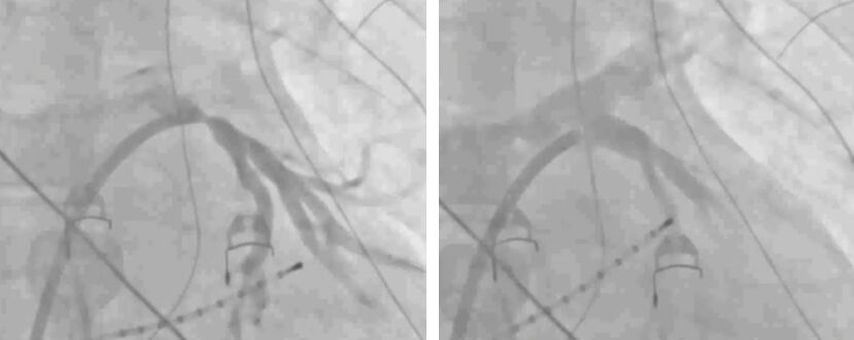
Perkutane Revaskularisation der PVS
In der Literatur gibt es vereinzelte Fallberichte über thorakoskopische Lobektomie als Therapieoption einer PVS mit völlig divergenten Ergebnissen, sodass primär eine perkutane Revaskularisation erfolgen sollte. Hierfür steht die Ballondilatation mit oder ohne Stentimplantation zur Verfügung (Abb. 2). Es liegen wenige, kleine Studien vor, welche die RestenoseRate beider Methoden geprüft haben. Stellvertretend wird hier die größte prospektive Beobachtungsstudie von E. Fender et al. angeführt, in die 124 Patienten und Patientinnen mit schwerer, symptomatischer PVS eingeschlossen wurden. Bei 113 Patienten und Patientinnen wurden 92 Pulmonalvenen mit Ballondilatation und 86 Pulmonalvenen mit Stentimplantation behandelt. Bei einer technischen Erfolgsrate von 94% traten bei 4 (3,5%) Patienten und Patientinnen schwere Komplikationen und bei 15 Patienten und Patientinnen (13,3%) leichte Komplikationen auf. Nach 3 Jahren kam es zu einer Restenose-Rate von 49% nach Ballondilatation und von 25% nach Stentimplantation (Abb. 3). Die Hazard-Ratio zeigt ein erhöhtes Risiko für das Auftreten von Restenosen nach Ballondilatation versus Stentimplantation (Hazard-Ratio: 2,77; 95% CI: 1,72-4,45; p<0,001).6
Abb. 2: Perkutane Revaskularisation durch Ballondilatation mit oder ohne Stentimplantation
Der Vorteil einer Stentimplantation gegenüber einer Ballondilatation wird auch in weiteren Studien und Fallberichten bestätigt.7–8
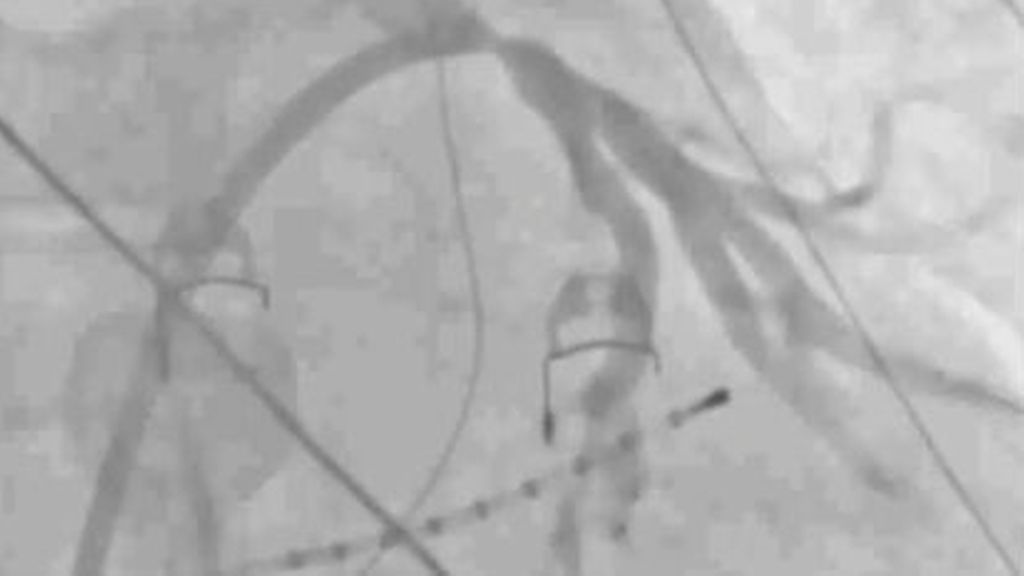
An Komplikationen werden Tamponaden, transiente ST-Strecken-Hebungen, meist infolge von Luftembolien, Hämoptysen und Stentdislokationen angeführt. Um Letztere zu verhindern, werden Stentgrößen ≥9 mm empfohlen, die zudem mit einer geringeren Restenose-Rate einhergehen (Abb. 4). In einer retrospektiven Analyse war die Implantation von koronaren Drug-eluting Stents (DES) mit einer 3-fach höheren Restenose-Rate im Vergleich zu Bare-metal-Stents (BMS) verbunden. Ursächlich scheint der zu kleine Stentdiameter der erhältlichen DES zu sein, die lediglich zu einer maximalen Größe von 6 mm überexpandiert werden können, sodass DES keine Anwendung in der Behandlung von PVS finden. Bezüglich des Einsatzes von „drug-eluting“ Ballons auf diesem Gebiet gibt es derzeit keine aussagekräftige Datenlage. Unklar und völlig uneinheitlich ist auch die antithrombotische Behandlung nach erfolgter Stentimplantation. Im größten Register wurden eine OAK und Clopidogrel, wenn verträglich, auf Dauer verordnet. Aber auch OAK auf Dauer mit Clopidogrel für 1 Jahr und Aspirin für 1 Monat wurden in einem anderen Register angeführt. Die postinterventionelle antithrombotische Medikation wird wohl bis zum Vorliegen weiterer Daten individuell an das Thrombose- und Blutungsrisiko angepasst werden.
Fazit
Das Auftreten von PVS nach Ablationsbehandlung von Vorhofflimmern ist eine seltene und wenig wahrgenommene Komplikation. Bei Symptomen wie Dyspnoe, Husten, Hämoptysen und Leistungseinschränkung, welche etwa 3–5 Monate nach einer Ablationsbehandlung auftreten, sollte an eine PVS gedacht werden. Die Diagnosestellung erfolgt einfach mittels CT. Im Falle von symptomatischen, signifikanten PVS sollte eine interventionelle Revaskularisation an einem Zentrum durchgeführt werden, wobei einer Stentimplantation aufgrund einer signifikant niedrigeren Restenose-Rate der Vorzug gegenüber einer Ballondilatation gegeben werden sollte. Ursächlich für das Entstehen von PVS sind thermische Schäden, die durch die Ablation im Bereich der Pulmonalvenen gesetzt werden. Neuere nichtthermische Verfahren wie die „Pulsed Field Ablation“ (PFA) sollten somit bei Patienten und Patientinnen mit behandelten oder unbehandelten PVS und neuerlicher Indikation für eine Ablationsbehandlung in Erwägung gezogen werden.
Literatur:
1 Hindricks G, Potpara T et al.: 2020ESCGuidelinesfor thediagnosisand managementofatrialfibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J 2020; 00: 1-125 2 Ngo L et al.: Institutional Variation in 30-Day Complications Following Catheter Ablation of Atrial Fibrillation. J Am Heart Assoc 2022; 11(4): e022009 3 Chen SA et al.: Initiation of atrial fibrillation by ectopic beats originating from the pulmonary veins: electrophysiological characteristics, pharmacological responses, and effects of radiofrequency ablation. Circulation 1999; 100(18): 1879-86 4 Taylor GW et al.: Pathological effects of extensive radiofrequency energy applications in the pulmonary veins in dogs. Circulation 2000; 101(14): 1736-42 5Tokutake Ket al.: Anatomical and procedural factors of severe pulmonary vein stenosis after cryoballoon pulmonary vein ablation. JACC Clin Electrophysiol 2019; 5(11): 1303-15 6 Fender EA et al.: Severe pulmonary vein stenosis resulting from ablation for atrial fibrillation: presentation, management, and clinical outcomes. Circulation 2016; 134(23): 1812-21 7 Ogawa T et al.: Pulmonary vein angioplasty for pulmonary vein stenosis after ablation therapy for atrial fibrillation - areport of 7 cases. Circ J 2022; 86(8): 1229-36 8 Schoene K et al.: Acquired pulmonary vein stenosis after radiofrequency ablation for atrial fibrillation: single-center experience in catheter interventional treatment. JACC Cardiovasc Interv 2018; 11(16): 1626-32
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...