Stressechokardiografie bei Patienten mit hypertropher Kardiomyopathie
Autorin:
Dr. med. Helene Hammer
HerzGefässZentrum Zürich/Hirslanden Klinik Im Park
8038 Zürich
E-Mail: helene.hammer@hirslanden.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Stressechokardiografie ist ein wichtiges Tool im klinischen Management von Patienten mit hypertropher Kardiomyopathie (HCM). Die häufigste Indikation für diese Untersuchung ist die Suche nach einer latenten Obstruktion im linksventrikulären Ausflusstrakt (LVOT), die auf dem dynamischen SAM-Phänomen des anterioren Mitralsegels beruht. Die Suche nach einer latenten Obstruktion ist wichtig, da sich die Behandlung von Patienten mit und ohne Obstruktion grundlegend unterscheidet.
Keypoints
-
Die Stressechokardiografie trägt bei HCM-Patienten zum pathophysiologischen Verständnis der Symptomatik bei, hilft bei der Entwicklung von Therapiestrategien, bei der Risikostratifizierung und bei der prognostischen Einschätzung.
-
Die häufigste Indikation für eine Stressechokardiografie ist die Suche nach einer latenten Obstruktion im LVOT.
-
Faktoren, die eine LVOT-Obstruktion begünstigen, sind nebst den anatomischen Gegebenheiten (Septumhypertrophie, elongierte Mitralsegel, Papillarmuskelanomalien etc.) auch Zustände mit niedriger Vor- und Nachlast sowie erhöhter Kontraktilität.
-
Der Belastungstest sollte stets physikalisch und nicht mit Dobutamin durchgeführt werden.
-
Der Nachweis einer myokardialen Ischämie ist häufig, prognostisch ungünstig und in der Regel auf eine mikrovaskuläre Zirkulationsstörung und nicht auf eine stenosierende koronare Herzkrankheit zurückzuführen.
Die hypertrophe Kardiomyopathie (HCM) ist die häufigste vererbbare Herzmuskelerkrankung und führt in der Regel zu einer asymmetrischen Verdickung des linksventrikulären Myokards, wobei gelegentlich auch der rechte Ventrikel von der Hypertrophie betroffen sein kann. Die Diagnose wird ab einer Wanddicke von mindestens 15mm (bei positiver Familienanamnese ab 13mm) gestellt, die nicht durch andere Erkrankungen, wie zum Beispiel eine schwere Aortenstenose oder eine unzureichend therapierte arterielle Hypertonie, erklärt werden kann.1 Die «klassische» hypertrophe Kardiomyopathie ist eine genetische Erkrankung, die auf einer Genmutation eines Sarkomerproteins basiert. Die Prävalenz der HCM liegt bei 1:500 und der Erbgang ist autosomal-dominant. Die Abgrenzung zu sogenannten «Phänokopien» (z.B. infiltrative Erkrankungen wie kardiale Amyloidose; Speichererkrankungen wie Morbus Fabry oder Morbus Danon) ist sowohl aus prognostischen als auch therapeutischen Aspekten von entscheidender Bedeutung.
Die klinische Präsentation reicht von völliger Beschwerdefreiheit über Thoraxschmerzen, Dyspnoe, Palpitationen, Schwindel und Synkopen bis hin zur manifesten Herzinsuffizienz und zum plötzlichen Herztod. Pathophysiologisch zeigt sich ein komplexes Zusammenspiel zwischen diastolischer Dysfunktion, Mikrozirkulationsstörung und Ischämie. Eine wesentliche Rolle kann zudem eine dynamische Obstruktion des linksventrikulären Ausflusstraktes (LVOT) mit konsekutiver Mitralinsuffizienz spielen, die medikamentös (Betablocker, Verapamil, Disopyramid) angegangen werden kann, jedoch gelegentlich invasiver septaler Reduktionstherapien (septale Alkoholablation, chirurgische Myektomie) bedarf.2 Eine solche kann bei circa zwei Dritteln aller HCM-Patienten entweder bereits in Ruhe oder unter Belastung nachgewiesen werden. Da sich die Therapiestrategie der Patienten mit Obstruktion von derjenigen bei Patienten ohne Obstruktion grundlegend unterscheidet, muss die Differenzierung dieser Patientengruppen sorgsam erfolgen. Hierbei spielt die Stressechokardiografie eine entscheidende Rolle.
Die dynamische Obstruktion des linksventrikulären Ausflusstraktes – das SAM-Phänomen
Von einer linksventrikulären Ausflusstraktobstruktion spricht man, wenn Gradienten im LVOT von ≥30mmHg gemessen werden können, wobei eine relevante Obstruktion ab ≥50mmHg vorliegt. Dieser Cut-off gilt insbesondere auch für die Indikationsstellung zu septalen Reduktionstherapien für Patienten, die trotz maximal ausgebauter medikamentöser Therapie symptomatisch bleiben.
Die LVOT-Obstruktion ist auf ein Zusammenspiel zwischen dem hypertrophierten Septum und einer anterioren, gegen das Septum gerichteten Bewegung des anterioren Mitralklappensegels in der Systole zurückzuführen (SAM, «systolic anterior motion»), welche ihrerseits durch Zug- und Schubkräfte des Blutstroms im LVOT verursacht wird (Abb. 1A). Begünstigend sind dabei morphologische Aspekte (dickes Septum, elongierte Mitralsegel, Papillarmuskelanomalien), aber auch funktionelle Gesichtspunkte (z.B. schlechter Füllungszustand bei Dehydratation, Vasodilatation u.a. bei Therapie mit ACE-Hemmern/ATII-Blockern, Inotropika wie Dobutamin und hyperdyname Zustände wie Inflammation). Die LVOT-Obstruktion ist im Gegensatz zur Aortenstenose oder einer subvalvulären Membran, die einer fixen Obstruktion entsprechen, ein dynamisches Phänomen und kann in ihrer Ausprägung von Tag zu Tag oder manchmal sogar von Stunde zu Stunde variieren.
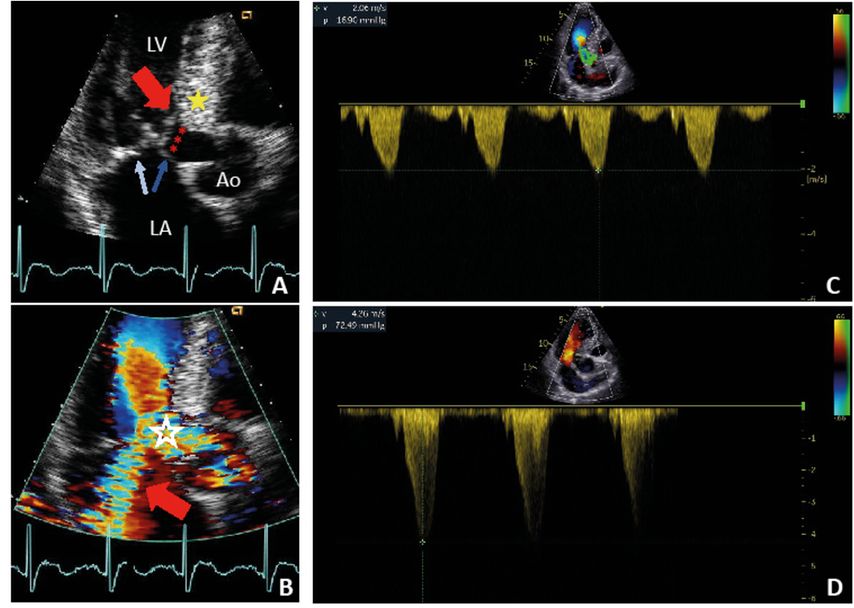
Abb. 1:
A) Apikaler 3-Kammer-Blick, Systole. LV: linker Ventrikel; LA: linker Vorhof; Ao: Aorta. Rote Sterne: «systolic anterior motion» (SAM) des vorderen Mitralsegels; roter Pfeil: SAM «septal Contact»/«site of obstruction»; gelber Stern: hypertrophiertes Septum; hellblauer Pfeil: posteriores Mitralsegel; dunkelblauer Pfeil: anteriores Mitralsegel
B) Apikaler 3-Kammer-Blick, Systole, Farb-Doppler. Weisser Stern: Flussbeschleunigung/Aliasing; roter Pfeil: typisch nach posterior gerichtete höhergradige Mitralinsuffizienz
C) CW-Doppler durch den linksventrikulären Ausflusstrakt in Ruhe. Maximaler Gradient liegt bei 17mmHg (nicht relevant)
D) CW-Doppler durch den linksventrikulären Ausflusstrakt unter Belastung. Typisches «Dagger-shaped»-Spektrum mit spätsystolischem Peak. Gradient liegt bei 72mmHg, damit Nachweis einer relevanten LVOT-Obstruktion
Indikation zur Stressechokardiografie und Sicherheitsaspekte
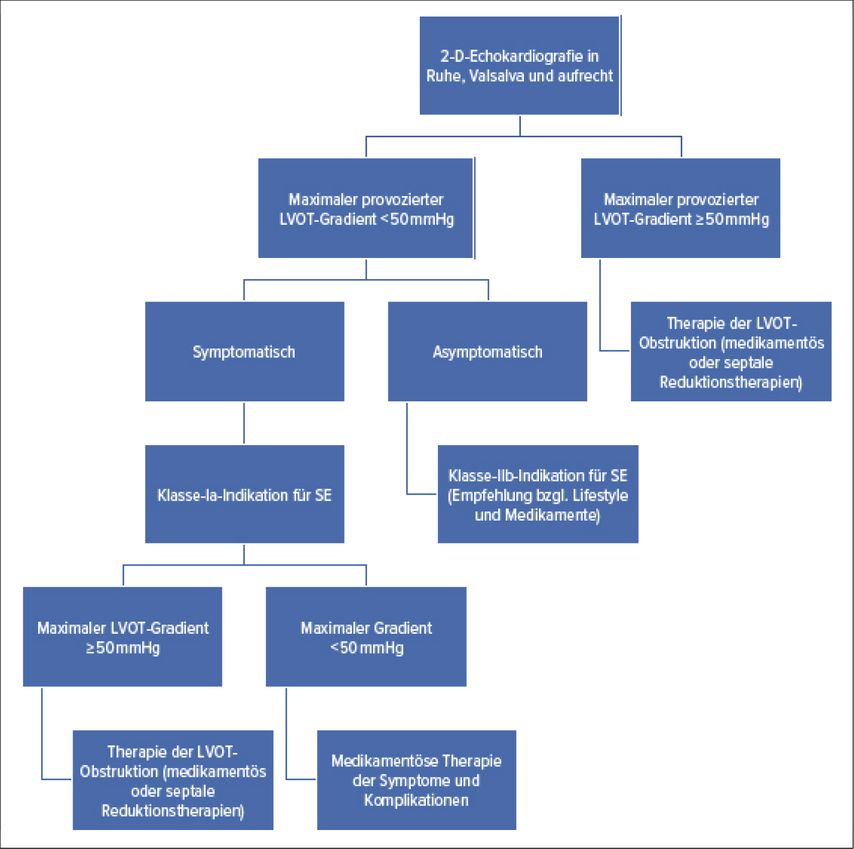
Für das klinische Management des Patienten ist es wesentlich, die Symptomatik pathophysiologisch zu verstehen, insbesondere aus therapeutischen Gesichtspunkten (Abb. 2). Am Anfang steht die Ruhe-Echokardiografie, wobei nebst der Morphologie sowie der systolischen und diastolischen Funktion auch die Gradienten im linksventrikulären Ausflusstrakt (LVOT) beurteilt werden müssen. Sollte hier keine relevante Flussbeschleunigung nachweisbar sein (Gradienten <50mmHg), so empfiehlt es sich, den Patienten in eine aufrechte Lage zu bringen oder ein Valsalva-Manöver durchführen zu lassen, um den venösen Rückstrom zum Herzen und damit die ventrikuläre Füllung sowie die Cavumgrösse zu reduzieren und eine allfällige LVOT-Obstruktion zu demaskieren. Ist der Patient symptomatisch und sind die Gradienten im LVOT trotz o.g. Provokationsmanöver <50mmHg, so ist im nächsten Schritt die physikalische Stressechokardiografie indiziert (Klasse-Ia-Indikation). Da sich das therapeutische Management grundlegend unterscheidet, ist es entscheidend, Patienten mit Obstruktion von denen ohne Obstruktion abzugrenzen (s.o.). Aber auch bei asymptomatischen Patienten kann eine Stressechokardiografie durchgeführt werden, sollte der Nachweis einer dynamischen LVOT-Obstruktion relevant sein für das weitere Vorgehen, z.B. in Bezug auf die Wahl eines Antihypertensivums, sportliche Aspekte etc. (Klasse-IIb-Indikation).1 Der Nachweis einer LVOT-Obstruktion ist auch prognostisch wertvoll, da Patienten mit latenter, d.h. unter Stress, aber nicht in Ruhe nachweisbarer Obstruktion ein doppelt so hohes Risiko haben, im Krankheitsverlauf eine relevante Funktionseinschränkung zu entwickeln wie Patienten ohne Obstruktion.3 Zudem sollte die Indikation zur Stressechokardiografie bei Patienten mit Synkope niederschwellig gestellt werden, wenn die Anamnese und die Untersuchungsbefunde die Ätiologie des Bewusstseinsverlustes (DD arrhythmogen) nicht hinreichend erklären können.
Abb. 2: Anleitung zum Einsatz der physikalischen Stress-Echokardiografie und therapeutische Implikationen. LVOT: linksventrikulärer Ausflusstrakt; SE: Stress-Echokardiografie
Eine Stressuntersuchung ist bei HCM-Patienten risikoarm. Anders als vor 20 Jahren, als die Richtlinien wegen der Befürchtung, es könnten Arrhythmien oder ein hämodynamischer Kollaps auftreten, vor Belastungstests bei HCM-Patienten warnten, weiss man heute, dass schwere Komplikationen selten sind und die Rate bei lediglich 0,04% liegt.
Durchführung und Caveats
Beim Grossteil der HCM-Patienten wird eine Stressechokardiografie zur Suche nach einer latenten LVOT-Obstruktion veranlasst, wobei aber natürlich zusätzliche Aspekte, wie diastolische Dysfunktion, pulmonale Drucksteigerung und Ischämie (s.u.), untersucht werden können.
Idealerweise ist der Patient während der Echokardiografie möglichst aufrecht. Die aufrechte Position reduziert den venösen Rückstrom und dank des kontinuierlichen Imagings lässt sich feststellen, zu welchem Zeitpunkt das SAM-Phänomen auftritt, und es bleibt auch Zeit für zusätzliche Messungen (systol. RV- über RA-Gradient, LV-Inflow, Tissue-Doppler etc.), falls dies erwünscht ist. Alternativ kann der Patient unmittelbar nach dem physikalischen Stresstest (z.B. auf dem Laufband) echokardiografiert werden; die maximalen Gradienten korrelieren gut mit den Messungen unter maximaler Belastung auf dem Ergometer. Ein medikamentöser Stresstest mit Dobutamin wird nicht empfohlen, da Dobutamin die Cavumgrösse verkleinert und auch bei «gesunden» Probanden eine LVOT-Obstruktion provozieren kann, welche keinerlei klinische Implikationen hat.
Unter physikalischem Stress nimmt die Kontraktilität des linken Ventrikels zu, was das SAM-Phänomen induzieren bzw. verstärken und zur Flussbeschleunigung im LVOT führen kann. Parallel dazu kommt es durch die Bewegung des anterioren Mitralklappensegels in Richtung Septum zu einer Lücke zwischen den Mitralsegeln und einer typischerweise nach posterior gerichteten Mitralklappeninsuffizienz, die in der Regel bei relevanter Obstruktion mittelschweren bis schweren Grades ist (Abb. 1B). Diese beiden Mechanismen, einerseits der reduzierte Blutauswurf durch den Ausflusstrakt in Richtung Körperkreislauf und andererseits die relevante Mitralinsuffizienz mit pulmonalem Blutrückstau, führen dazu, dass Symptome wie Dyspnoe, Throraxschmerzen, Schwindel und Synkopen auftreten können.
Die Quantifizierung der LVOT-Obstruktion erfolgt durch die Bestimmung der Flussgeschwindigkeit im linksventrikulären Ausflusstrakt mittels CW-Doppler. Mithilfe der Bernoulli-Formel kann daraus der Druckgradient kalkuliert werden (Abb. 1C und 1D). Der Fluss im LVOT muss äusserst sorgfältig von der Mitralklappeninsuffizienz abgegrenzt werden, was, insbesondere unter Stressbedingungen, technisch häufig eine Herausforderung darstellt. Beides sind systolische Signale, wobei die Mitralinsuffizienz bereits frühsystolisch auftritt und eine Glockenform hat im Vergleich zum spätsystolischen Peak im LVOT (= «dagger-shape»). Die Flussgeschwindigkeiten der Mitralklappeninsuffizienz sind höher, sodass bei Kontamination die LVOT-Obstruktion schnell überschätzt werden kann.
Ischämiesuche
Betrachtet man die Gesamtheit aller kardiologischen Patienten, ist die häufigste Indikation für eine Stressechokardiografie die Frage nach einer myokardialen Ischämie. Auch bei HCM-Patienten kann eine Ischämie auf diese Weise oder mit alternativen nicht invasiven bildgebenden Verfahren (SPECT, MRI etc.) gesucht werden. Allerdings ist ein Ischämienachweis bei hypertrophem Herzen selten auf das Vorliegen einer koronaren Herzkrankheit zurückzuführen. Vielmehr spielen hier andere Mechanismen bei der Ischämieentstehung eine Rolle. Hierzu gehören u.a. ein «supply-demand mismatch», myokardiale Brücken und Anomalien im Bereich der intramyokardialen Arteriolen, die von Proliferations- und Hypertrophieprozessen mit Lumeneinengung betroffen sind und zu einer relevanten mikrovaskulären Zirkulationsstörung führen können.
Auch wenn sich die Stressechokardiografie für die Diagnose einer koronaren Herzkrankheit nicht gut eignet, hat der Ischämienachweis bei Patienten mit hypertropher Kardiomyopathie durchaus eine prognostische Relevanz. Patienten mit induzierbaren regionalen Wandbewegungsstörungen oder gar Abfall der systolischen linksventrikulären Funktion haben nachweislich ein höheres Risiko für kardiovaskuläre Ereignisse und eine höhere Mortalität.4,5 Sollte eine Koronardiagnostik bei einem hypertrophen Herzen erwünscht sein, sollte gemäss Vortestwahrscheinlichkeit vorgegangen werden. Bei hohem kardiovaskulärem Risikoprofil empfiehlt sich direkt eine Koronarangiografie. Hingegen eignet sich bei niedrigem Risiko eine Koronar-CT zum Ausschluss einer relevanten Plaques-Last.
Literatur:
1 Elliott PM et al.: 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy. The Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J 2014; 35: 2733-92 2 Maron MS et al.: Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation 2006; 114: 2232-9 3 Rowin EJ et al.: Role of exercise testing in hypertrophic cardiomyopathy. JACC Cardiovasc Imaging 2017; 10: 1374-86 4 Peteiro J et al.: Prognostic value of exercise echocardiography in patients with hypertrophic cardiomyopathy. J Am Soc Echocardiogr 2012; 25: 182-9 5 Ciampi Q et al.: The Stress Echo Study. Prognostic value of reduced heart rate reserve during exercise in hypertrophic cardiomyopathy. J Clin Med 2021; 10: 1347
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...