Tafamidis zur Behandlung der kardialen Transthyretin-Amyloidose
Autor:
Dr. René Rettl
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin II
Medizinische Universität Wien
E-Mail: rene.rettl@meduniwien.ac.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Zulassung von Tafamidis zur Behandlung der Transthyretin-Amyloidose mit Kardiomyopathie (ATTR-CM) galt als großer Hoffnungsschimmer für Betroffene, da Tafamidis mit einer Verringerung der kardiovaskulär bedingten Hospitalisierungen und der Gesamtmortalität im Vergleich zu Placebo einhergeht. Trotz des unbestrittenen klinischen Nutzens liegen heutzutage noch einige Unklarheiten in Hinblick auf das therapeutische Monitoring vor.
Keypoints
-
Bei der kardialen Transthyretin-Amyloidose handelt es sich um eine infiltrative Kardiomyopathie, die auf zunehmende Ablagerungen von Transthyretin-bedingten Amyloidfibrillen im Herzmuskel zurückzuführen ist.
-
Die Transthyretin-Amyloidose geht mit einer schlechten Prognose einher.
-
Eine spezifische Therapie mit Tafamidis ist mit einer Verringerung der kardiovaskulär bedingten Hospitalisierungen und der Gesamtmortalität assoziiert (vs. Placebo).
-
Neue echokardiografische Erkenntnisse weisen darauf hin, dass Tafamidis einer Krankheitsprogression der linksatrialen und linksventrikulären longitudinalen Herzfunktion entgegenwirken kann.
-
Die serielle Echokardiografie mit 2D-STE und insbesondere die Bestimmung des linksventrikulären GLS könnten ein valides Tool zur Überwachung des Therapieverlaufs sein.
Komplexe Pathophysiologie
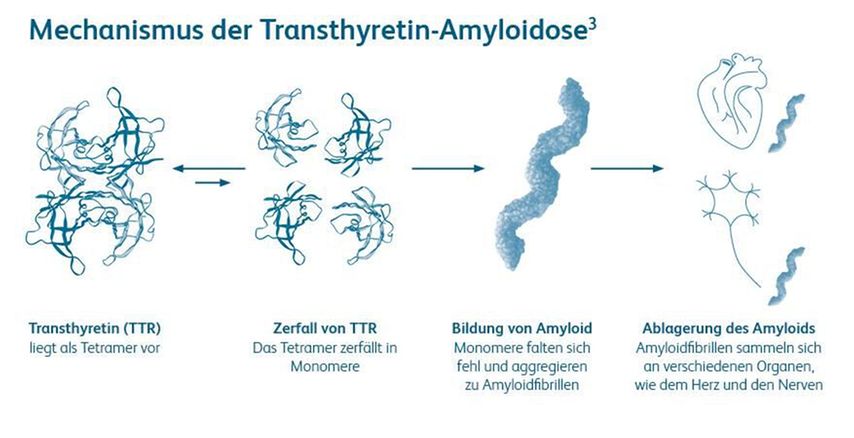
Als Amyloide werden fehlgefaltete Proteine mit charakteristischer Cross-β-Struktur bezeichnet, welche sich aufgrund enzymatischer Umwandlungsprozesse als unlösliche Komplexe in Form von Amyloidfibrillen im Extrazellulärraum verschiedener Organe ablagern und so zu deren Dysfunktion und zur Erkrankung Amyloidose führen.1 Die Internationale Amyloidosegesellschaft listet derzeit über 30 Proteine, deren molekulare Eigenschaften das Potenzial besitzen, in vivo Amyoidfibrillen zu formen.2 Einer der häufigsten Amyloidosesubtypen, welche sich auch kardial manifestieren können, ist die Transthyretin-Amyloidose, deren Pathogenese von Transthyretin (TTR), einem hepatisch synthetisierten Transportprotein für Vitamin A und Schilddrüsenhormone, dominiert wird.3 Pathophysiologisch steht dabei die zunehmende Destabilisierung des tetrameren TTR mit anschließender Dissoziation in dessen Monomere im Mittelpunkt, was zugleich als geschwindigkeitsbestimmender Schritt im Rahmen des amyloidogenen Prozesses gesehen wird. Die TTR-Monomere formen aufgrund pathologischer Faltungsprozesse in weiterer Folge Amyloidfibrillen, welche in das umliegende Gewebe diffundieren und im Falle der ATTR-CM das extrazelluläre Myokard infiltrieren, weshalb es sich hierbei um den Prototyp einer infiltrativen Kardiomyopathie handelt (Abb. 1).3 Zudem lässt sich eine nicht erblich bedingte, altersassoziierte Wildtypform (ATTRwt), deren pathophysiologische Vorgänge noch nicht vollständig geklärt sind, von der selteneren autosomal-dominant vererbbaren (ehemals hereditären) Form (ATTRv) abgrenzen, bei der Punktmutationen im TTR-Gen zur Destabilisierung des TTR beitragen.4
Abb. 1: Pathomechanismus der Transthyretin-Amyloidose (mit freundlicher Genehmigung von Pfizer Corporation Austria Ges.m.b.H.)
Vielfältiges klinisches Erscheinungsbild
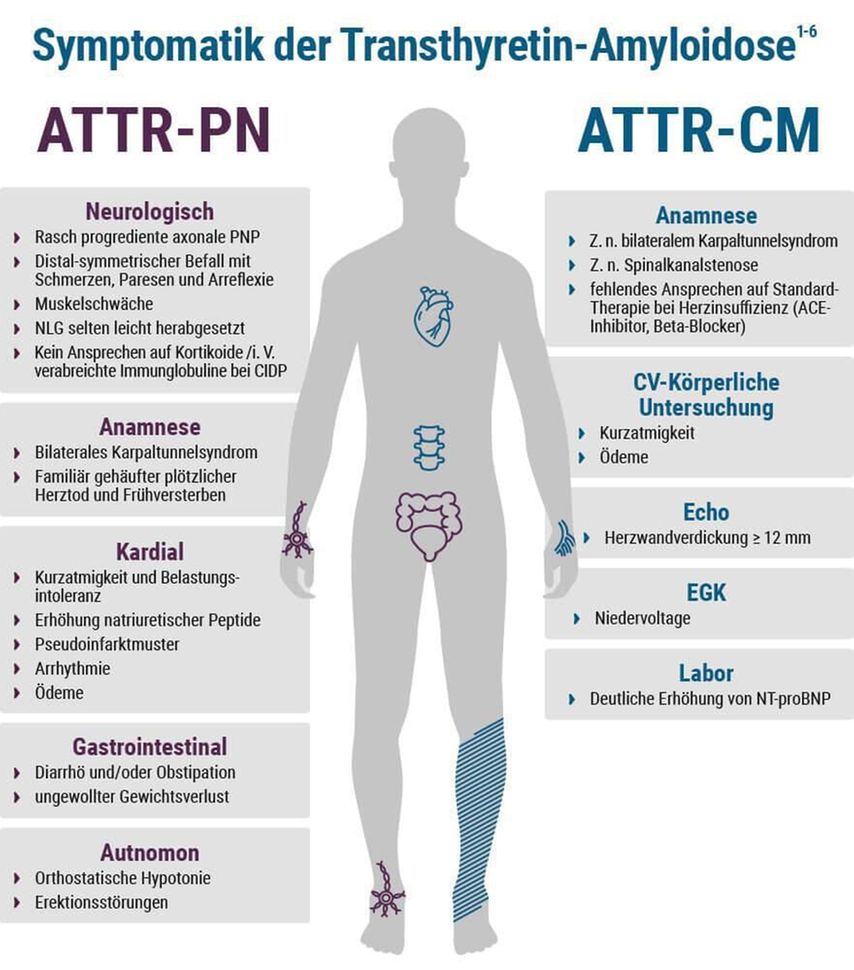
Die klinische Präsentation der Patienten hängt naturgemäß davon ab, welche Organsysteme von den Amyloidplaques betroffen sind, wobei sich TTR-bedingte Amyloidablagerungen überwiegend im Herz und/oder peripheren Nervensystem manifestieren (Abb. 2).5 Die Infiltration des Herzmuskels resultiert in einer progressiven biventrikulären Hypertrophie, welche mit einer erhöhten myokardialen Steifigkeit mit begleitender diastolischer und systolischer Funktionseinschränkung einhergeht.6 Klinisch präsentieren sich betroffene Patienten häufig mit Symptomen der globalen Herzinsuffizienz, die meist mit dem Auftreten von Belastungsdyspnoe, Pleuraergüssen und Beinödemen sowie einer Hepatomegalie, Aszites und einem erhöhten Jugularvenendruck assoziiert sind.5 Des Weiteren können Amyloidablagerungen in den Herzkranzgefäßen Angina-pectoris-Symptome triggern.5 Einlagerungen im Reizleitungssystem können einerseits Schwindel, Synkopen, Vorhofflimmern bzw. -flattern als auch das Auftreten eines AV-Blocks begünstigen, sich anderseits aber auch als lebensbedrohliche ventrikuläre Arrhythmien manifestieren.5 Ein zusätzlicher Befall des autonomen Nervensystems kann zu autonomen Störungen wie der orthostatischen Hypotonie, der erektilen Dysfunktion und der gastrointestinalen Dysmotilität führen, während Ablagerungen im peripheren Nervensystem durch das Auftreten einer Polyneuropathie sowie das Karpaltunnelsyndrom gekennzeichnet sind.7
Abb. 2: Klinisches Erscheinungsbild und Symptomatik der Transthyretin-Amyloidose (mit freundlicher Genehmigung von Pfizer Corporation Austria Ges.m.b.H.)
Diagnostische Herausforderung
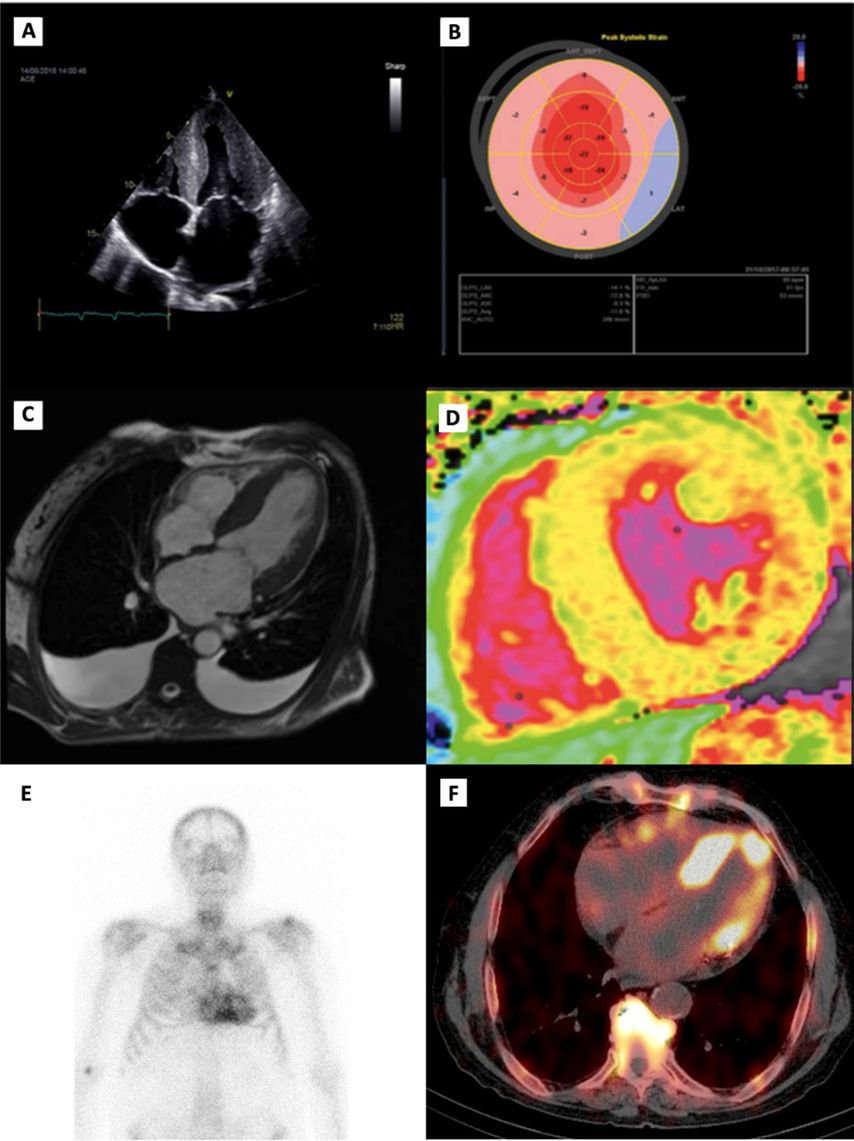
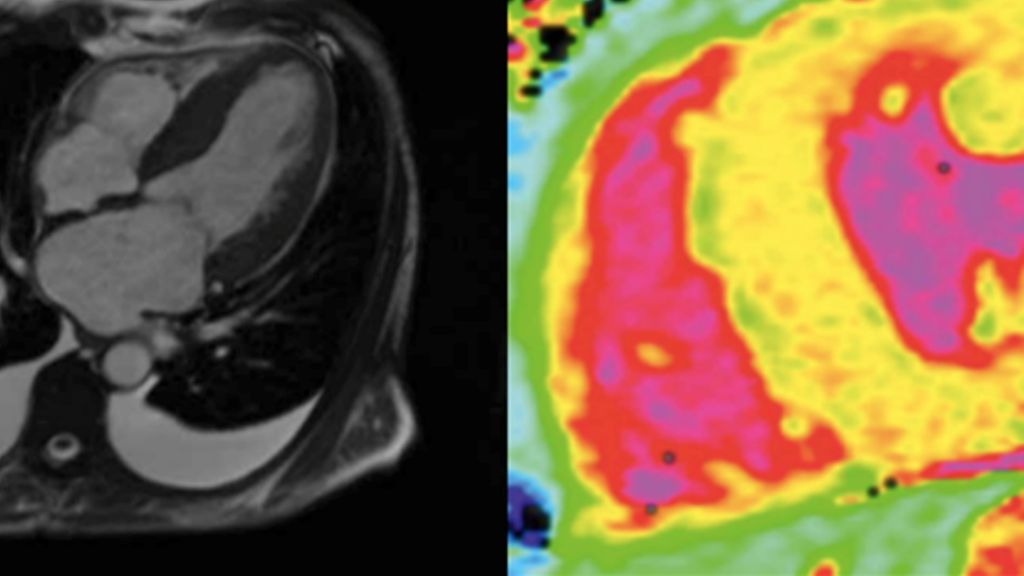
Der wichtigste Schritt bei der Diagnosestellung einer ATTR-CM liegt darin, die Erkrankung differenzialdiagnostisch überhaupt in Betracht zu ziehen. Hierbei können neben der klinischen Präsentation der Patienten auch laborchemische Veränderungen im Sinne einer Erhöhung der kardialen Biomarker NT-proBNP und Troponin T sowie EKG-Veränderungen (z.B. QRS-Niedervoltage) schon erste Hinweise für das Vorliegen einer ATTR-CM liefern.8 Die weitere Abklärung wird primär von bildgebenden Verfahren dominiert, wobei die Echokardiografie aufgrund ihrer breiten Verfügbarkeit eine zentrale Rolle einnimmt. Zu den sogenannten „red flags“, die auf eine ATTR-CM hinweisend sein können, zählen die biventrikuläre Verdickung, insbesondere im Bereich des Septums, dilatierte Vorhöfe mit einem hypertrophen interatrialen Septum sowie das Vorliegen von Perikard- und/oder Pleuraergüssen. (Abb. 3A).9 Mittels des Speckle-Tracking-Verfahrens können Strain-Analysen zur Bestimmung des globalen longitudinalen Strains (GLS) durchgeführt werden, wobei das typische Muster eines basal reduzierten sowie apikal erhaltenen longitudinalen Strains („apical sparing“) eine diagnostische Schlüsselrolle einnimmt (Abb. 3B).9 Des Weiteren bietet die kardiale Magnetresonanztomografie die Möglichkeit, mittels kontrastmittelgestützter „Late enhancement“-Aufnahmen und T1-Mapping-Sequenzen myokardiale Amyloidablagerungen in der extrazellulären Matrix zu quantifizieren, wodurch eine zuverlässige differenzialdiagnostische Abgrenzung zu anderen hypertrophen Erkrankungsformen erfolgen kann (Abb.3 C–D).10, 11 Die wichtigste nicht invasive bildgebende Untersuchungsmethode zur Diagnose einer ATTR-CM stellt jedoch die planare Ganzkörperknochenszintigrafie mit radioaktiven Tracern dar (z.B. 99mTc-DPD). Damit kann das Vorliegen einer kardialen Beteiligung im Rahmen einer Amyloidose semiquantitativ anhand des visuellen Peruginiscores beurteilt werden (Abb. 3E).12 Hingegen erlaubt die quantitative SPECT/CT („single photon emission computed tomography“/„computed tomography“) durch Bestimmung des „standardized uptake value“ (SUV) eine umfassende Quantifizierung der myokardialen Amyloidlast und birgt bei serieller Anwendung das Potenzial zur Observierung des Erkrankungs- bzw. Therapieverlaufs (Abb. 3F).13 Neben den bildgebenden Verfahren bildet die Serum- und Harnanalyse eine weitere diagnostische Säule, im Rahmen derer das Vorliegen von Paraprotein in den entsprechenden Immunfixationen sowie eine pathologische Kappa-/Lambdaratio im Serum hinweisend auf eine leichtkettenassoziierte Amyloidose (AL-Amyloidose) sein kann, welche differenzialdiagnostisch jedenfalls in Betracht gezogen werden sollte.14 Aufgrund des breiten Spektrums an diagnostischen Möglichkeiten ist heutzutage eine korrekte Diagnosefindung in den meisten Fällen auch ohne Endomyokardbiopsie möglich. Bei unklaren Befundkonstellationen oder speziellen Fragestellungen gilt die Herzmuskelbiopsie jedoch nach wie vor als Goldstandard in der Amyloidosediagnostik.14
Abb. 3: Bildgebende Verfahren zur Diagnostik einer Transthyretin-Amyloid-Kardiomyopathie (ATTR-CM): Bilder A und B zeigen echokardiografische Charakteristika der ATTR-CM: A zeigt einen 4-Kammer-Blick mit dem Vollbild einer ATTR-CM mit Linksventrikelhypertrophie und vergrößerten Vorhöfen. In B ist eine Strainanalyse des linken Ventrikels mit dem für die ATTR-CM typischen „apical sparing“ zu sehen. Die Bilder C–D zeigen magnetresonanztomografische Charakteristika der ATTR-CM: C zeigt einen 4-Kammer-Blick mit dem Vollbild einer ATTR-CM. D zeigt eine „native T1 map“ in der kurzen Achse mit stark erhöhten myokardialen T1-Zeiten (hellgelb bis rötlich), welche typisch für eine ATTR-CM sind. In den Bildern E–F sind nuklearmedizinische Aufnahmen dargestellt: In E ist eine Knochenszintigrafie mit ausgeprägter myokardialer Traceranreicherung zu sehen. F zeigt eine SPECT/CT mit deutlichem Traceruptake im linken Ventrikel. Quelle: Dr. Rettl
Therapeutischer Ansatz
Da die Dissoziation des TTR-Tetramers in seine Monomere einen der wichtigsten pathophysiologischen Schritte bei der ATTR-CM darstellt, gilt die Stabilisierung des Tetramers als valider therapeutischer Ansatz. Tafamidis fungiert mittels kleiner Moleküle als kinetischer Stabilisator und wirkt somit der Bildung von Amyloidfibrillen und dessen Ablagerungen im Herzmuskel entgegen. Dabei konnten im Rahmen der Phase-III-Zulassungsstudie (ATTR-ACT) nicht nur signifikante Vorteile hinsichtlich dekompensationsbedingter Hospitalisierungen (52,3% vs. 60,5%) und der Gesamtmortalität (29,5% vs. 42,9%) im Vergleich zur Placebogruppe erzielt werden, sondern auch klinische Vorteile in Bezug auf die Leistungsfähigkeit und Lebensqualität in der Behandlungsgruppe erfasst werden.15 Aufgrund der vielversprechenden Ergebnisse wurde Tafamidis Anfang 2020 von der Europäischen Arzneimittelagentur (EMA) zur Behandlung der Wildtyp- und varianten Form der ATTR-CM zugelassen, wodurch sich eine bisher unheilbare Erkrankung zu einer erstmals behandelbaren wandelte.
Therapeutisches Monitoring
Auch wenn der klinische Nutzen von Tafamidis basierend auf den Ergebnissen der Zulassungsstudie unbestritten ist, bestehen noch einige Unklarheiten hinsichtlich geeigneter bildgebender Verfahren, die zur Überwachung des Therapieverlaufs Anwendung finden könnten. Aufgrund dessen wurden im Rahmen einer explorativen Studie der Klinischen Abteilung für Kardiologie an der Medizinischen Universität Wien die Tafamidis-induzierten kardiostrukturellen und -funktionellen Veränderungen mittels zweidimensionaler (2D) Speckle-Tracking-Echokardiografie (STE) beleuchtet, um echokardiografische Bildgebungsparameter zu identifizieren, die sich zur Überwachung des Therapieverlaufs eignen könnten. Im Rahmen der Studie unterzogen sich insgesamt 109 ATTR-CM-Patienten einer seriellen Echokardiografie mit 2D-STE. In weiterer Folge wurden in einem Cross-over-Studiendesign Patienten, die mit Tafamidis 61mg behandelt wurden (n=62), mit einer historischen Kontrollkohorte, welche Tafamidis 20mg erhielt (n=21), sowie mit einer historischen, therapienaiven Kontrollkohorte (n=54), die einen natürlichen Krankheitsverlauf durchmachte, verglichen. Dabei fanden sich im Vergleich zur therapienaiven Kohorte, die deutliche Anzeichen einer Krankheitsprogression aufwies, positive Auswirkungen einer Therapie mit Tafamidis 61 mg im Hinblick auf den linksatrialen „reservoir strain“ (LASr) und den linksventrikulären GLS, was sich auch in klinischen Parametern (6-Minuten-Gehtest, NT-proBNP) widerspiegelte. Hingegen konnten mittels Tafamidis 20 mg zwar positive Auswirkungen auf den LASr, jedoch keine signifikanten Vorteile in Bezug auf den linksventrikulären GLS und den klinischen Status erzielt werden. Es konnte im Rahmen der Studie gezeigt werden, dass Tafamidis 61 mg bei ATTR-CM-Patienten einer Krankheitsprogression im Hinblick auf die linksatriale und linksventrikuläre longitudinale Funktion entgegenwirken kann, was mit signifikanten klinischen Vorteilen im Vergleich zum natürlichen Krankheitsverlauf einhergeht. Zudem konnte demonstriert werden, dass die serielle Echokardiografie mit 2D-STE und insbesondere die Bestimmung des linksventrikulären GLS zur Überwachung des Therapieverlaufs geeignet sein könnte.
Zusammenfassung
Bei der ATTR-CM handelt es sich um eine immer häufiger diagnostizierte, infiltrative Kardiomyopathie, welche durch zunehmende Ablagerungen von Amyloidfibrillen im Herzmuskel bedingt ist und unbehandelt oft mit einer schlechten Prognose einhergeht. Reges Forschungsinteresse sowie auch zunehmende Awareness der jeweiligen Fachgesellschaften führten in den letzten Jahren zu weitreichenden Entwicklungen hinsichtlich diagnostischer Effizienz und therapeutischer Optionen. Standen noch vor wenigen Jahren keine spezifischen Wirkstoffe zur Verfügung, so wandelte sich die ATTR-CM von einer unheilbaren Erkrankung zu einer behandelbaren, deren therapeutisches Monitoring in den wissenschaftlichen Fokus gerückt ist.
Literatur:
1 Meinhardt J, Fändrich M: Struktur von Amyloidfibrillen. Pathologe 2009; 30(3): 175-81 2 Eisenberg D, Jucker M: The amyloid state of proteins in human diseases. Cell 2012; 148(6): 1188-1203 3 Gertz MA et al.: Diagnosis, prognosis and therapy of transthyretin amyloidosis. J Am Coll Cardiol 2015; 66(21): 2451-66 4 Damy T et al.: Prevalence and clinical phenotype of hereditary transthyretin amyloid cardiomyopathy in patients with increased left ventricular wall thickness. Eur Heart J 2016; 37(23): 1826-34 5 González-López E et al.: Clinical characteristics of wild-type transthyretin cardiac amyloidosis: Disproving myths. Eur Heart J 2017; 38(24): 1895-1904 6 González-López E et al.: Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J 2015; 36(38): 2585-94 7 González-López E et al.: Diagnosis and treatment of transthyretin cardiac amyloidosis. Progress and hope. Rev Española Cardiol English Ed 2017; 70(11): 991-1004 8 Bonderman D et al.: Diagnosis and treatment of cardiac amyloidosis: an interdisciplinary consensus statement. Wien Klin Wochenschr 2020; 132(23-24): 742-61 9 Binder C et al.: Mechanisms of heart failure in transthyretin vs. light chain amyloidosis. Eur Heart J Cardiovasc Imaging 2019; 20(5): 512-24 10 Duca F et al.: Cardiac magnetic resonance T1 mapping in cardiac amyloidosis. JACC Cardiovasc Imaging 2018; 11(12): 1924-6 11 Rettl R et al.: Tafamidis treatment delays structural and functional changes of the left ventricle in patients with transthyretin amyloid cardiomyopathy. Eur Hear J Cardiovasc Imaging 2022; 23(6):767-80 12 Perugini E et al.: Noninvasive etiologic diagnosis of cardiac amyloidosis using 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol 2005; 46(6): 1076-84 13 Rettl R et al.: Quantification of myocardial amyloid deposition in tafamidis-treated patients with transthyretin amyloid cardiomyopathy. Eur Heart J 2021; 42(1) 14 Gillmore JD et al.: Nonbiopsy diagnosis of cardiac transthyretin amyloidosis. Circulation 2016; 133(24): 2404-12 15 Maurer MS et al.: Tafamidis treatment for patients with transthyretin amyloid cardiomyopathy. N Engl J Med 2018; 379(11): 1007-16
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...