Update Herzinsuffizienz: HFrEF, HFpEF und HFmrEF – was gibt es Neues?
Autor:
Dr. med. Tobias Höfflinghaus
Leiter Kardiologie
Stadtspital Zürich Waid
Leiter Herzinsuffizienzprogramm
Stadtspital Zürich
Vorstandsmitglied Arbeitsgruppe Herzinsuffizienz der Schweizerischen Gesellschaft für Kardiologie
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Syndrom Herzinsuffizienz kann in der Endphase sämtlicher Herzerkrankungen auftreten. Dementsprechend sind die Ursachen, Abklärungen und Therapiemöglichkeiten sehr vielfältig. Dieser Artikel fokussiert speziell auf die Neuentwicklungen bei Herzinsuffizienz und deren klinische Anwendbarkeit im Alltag.
Keypoints
-
Die Häufigkeit der Herzinsuffizienz ist zunehmend und es steht eine Vielzahl an Abklärungs- und Therapiemöglichkeiten zur Verfügung.
-
Bei Verdacht sollte daher frühzeitig eine kardiologische Abklärung erfolgen, um reversible Ursachen zu beseitigen und eine gezielte Therapie gemäss Herzinsuffizienz-Subtyp zu ermöglichen.
-
Idealerweise werden Betroffene in ein Herzinsuffizienzprogramm eingeschlossen. Spezialisten können dann gemeinsam mit der Grundversorgerpraxis zu einer optimalen Patientenversorgung beitragen.
Die Unterteilung der Herzinsuffizienz anhand der linksventrikulären Pumpfunktion hat sich als praktisch erwiesen, da in den meisten grossen Studien zur Therapie nur für die Herzinsuffizienz mit eingeschränkter Pumpfunktion (HFrEF) eine Wirksamkeit nachgewiesen werden konnte. Dementsprechend bestehen hier vielfältige Therapieoptionen. Wurden die gleichen Studien bei Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF) durchgeführt, zeigte bis vor Kurzem keine Therapie einen überzeugenden Nutzen. Hier kam es in den letzten Jahren jedoch zu wichtigen Neuentwicklungen. Zusätzlich besteht ein Grauzonenbereich für die Herzinsuffizienz mit mild reduzierter Pumpfunktion (HFmrEF).
Epidemiologische Situation
Die Herzinsuffizienz ist generell auf dem Vormarsch und führt häufig zur Hospitalisation und einer hohen Mortalität. Der demografische Wandel mit zunehmender Alterung der Bevölkerung begünstigt diese Entwicklung ebenso wie Spätfolgen von arterieller Hypertonie, Herzklappenerkrankungen und koronarer Herzkrankheit (KHK).1 Circa 10% der Bevölkerung über 75Jahre haben eine Herzinsuffizienz.2 Seltener kommt es zu einer (akuten) Herzinsuffizienz aufgrund einer Myokarditis oder im Rahmen eines akuten Herzinfarktes. Die Prognose ist abhängig von Symptomatik, Einschränkung der Herzfunktion, Hospitalisationen, Blutdruck, Rekompensierbarkeit u.v.m. Häufige Komorbiditäten wie eine Niereninsuffizienz verschlechtern die Prognose deutlich. Unbehandelt besteht eine hohe Mortalität, die durch pharmakologische und andere Massnahmen relevant reduziert werden kann. Trotzdem sterben circa 50% der Patientinnen und Patienten innerhalb von 5 Jahren.
Ursachen der Herzinsuffizienz
Häufig führen Spätschäden von Myokardinfarkt, arterieller Hypertonie, Klappenvitien u.Ä. zu einer späteren Pumpschwäche (durch ungünstiges ventrikuläres Remodeling) oder zu einer Störung der diastolischen Funktion (durch zunehmende Fibrosierung des Myokards). Beides kann auch in Kombination auftreten. Dem Gesetz der kommunizierenden Röhren entsprechend, können pathologische Druckverhältnisse der linken Herzhälfte direkte Auswirkungen auf das pulmonal-arterielle System sowie den rechten Ventrikel und Vorhof haben und somit zu einer Rechtsherzinsuffizienz führen. Zusätzlich kommt es zu einer Aktivierung des Renin-Angiotensin-Aldosteron-Systems und des Sympathikus. Dies führt zu einer zunehmenden Volumen- und Natriumretention sowie zur Vasokonstriktion mit einer weiteren Verschlechterung der Herzinsuffizienz.
Symptomatik der Herzinsuffizienz
Kann das Herz keine optimale Organperfusion gewährleisten, treten Beschwerden auf. Bei einem Vorwärtsversagen stehen klassische Symptome wie eine schnellere Ermüdbarkeit und Leistungsintoleranz im Vordergrund, während bei einem Rückwärtsversagen Dyspnoe, Beinödeme oder auch eine Inappetenz auftreten können. Häufiger ist eine Kombination aus beidem. Bei Multimorbidität oder hohem Lebensalter bestehen oft unspezifische Symptome wie Müdigkeit, Schwäche und Gebrechlichkeit.
Abklärungsschritte
Bei typischen Symptomen und Beschwerden sollten als nächster Schritt eine Bestimmung der natriuretischen Peptide oder eine Echokardiografie erfolgen.2 Liegt das NT-proBNP unter dem Cut-off von 125pg/ml, ist eine Herzinsuffizienz mit hoher Wahrscheinlichkeit ausgeschlossen. Mit der Echokardiografie kann einerseits in vielen Fällen eine direkte ätiologische Einordnung stattfinden (z.B. hochgradiges Klappenvitium, Hinweise auf eine KHK), und andererseits entscheidet die linksventrikuläre Pumpfunktion über die weitere medikamentöse Therapie.
Differenzialdiagnosen
Viele Erkrankungen können eine Dyspnoe als Hauptsymptom haben. In der Grundversorgerpraxis werden oft akut infektiöse Ursachen wie eine Bronchitis diagnostiziert, wohingegen im Spital kardiale Ursachen häufig sind.3
Nicht selten ist Dyspnoe Ausdruck eines multifaktoriellen Problems aus einer kardialen Ursache in Kombination mit anderen Komorbiditäten wie COPD und einer zusätzlichen Dekonditionierung.
Erhöhte natriuretische Peptide können auch bei Niereninsuffizienz, höherem Lebensalter oder einer Lungenembolie auftreten, wohingegen bei Adipositas die Werte falsch niedrig sein können (ab einem BMI von 35kg/m2 sollten die BNP-Werte verdoppelt werden).4
Zuletzt kann Dyspnoe auch ein Symptom eines akuten Myokardinfarkts (Betagte, Diabetiker) sowie bei «small vessel disease» ein Angina-pectoris-Äquivalent sein.
Bestimmung der linksventrikulären Pumpfunktion zur Klassifikation der Herzinsuffizienz
In der Vergangenheit erfolgte eine Einteilung gemäss morphologischen und funktionellen Kriterien in Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF; LVEF >50% + zusätzliche Kriterien) und mit reduzierter Pumpfunktion (HFrEF; LVEF <40%). Nicht wenige Patienten haben jedoch eine LVEF im mild reduzierten Bereich (neu: HFmrEF; LVEF 40–50%) und befanden sich damit in einer Grauzone ohne klare Therapieempfehlungen.2
Im Krankheitsverlauf der Herzinsuffizienz bleibt die LVEF nicht statisch, sondern es gibt einerseits messbedingte Schwankungen (durch Volämie, Blutdruck, Herzfrequenz; Bildqualität; Untersucher-Abhängigkeit) und andererseits kann sich die Pumpfunktion durch eine ausgebaute Herzinsuffizienztherapie deutlich verbessern.5 Zusätzliche kardiale Ereignisse wie ein Myokardinfarkt oder ein neues Klappenvitium können ebenso wie eine medikamentöse Malcompliance die Situation verschlechtern. Eine fehlende Verbesserung oder weitere Verschlechterung der LVEF korrelieren mit einer schlechten Prognose.5
Charakteristika der einzelnen Subtypen
Pathophysiologisch führt bei HFrEF eine Schädigung der Kardiomyozyten zu einer sterilen Inflammation, bei HFpEF besteht durch verschiedene metabolische Risikofaktoren wie z.B. Diabetes mellitus, Adipositas oder arterielle Hypertonie eine chronische systemische Inflammation, die zur Hypertrophie, Fibrose und zu einer gestörten diastolischen Funktion führt (pathophysiologisch führen also die Komorbiditäten zum Herzproblem).6 Auf Proteomebene zeigen sich unterschiedliche Proteinsignaturen bei allen Herzinsuffizienz-Subtypen für Signaltransduktion, Strukturproteine, Mediatoren u.a.,7 sodass diese Unterscheidung biologisch messbar und plausibel ist.
Bei HFrEF ist die kardiovaskuläre Mortalität deutlich höher als bei HFmrEF und HFpEF, bei denen die Patienten häufiger an nicht kardialen Problemen sterben.
Die KHK ist prävalenter in der HFrEF- und HFmrEF-Gruppe, hingegen sind bei HFpEF ältere Patient:innen, häufiger Vorhofflimmern, arterielle Hypertonie und viele nicht kardiale Komorbiditäten anzutreffen. An selteneren Ursachen sind in der HFrEF-Gruppe verschiedene Formen der Kardiomyopathien mit infektiösen/inflammatorischen, genetischen oder metabolischen Ätiologien und in der HFpEF-Gruppe restriktive Kardiomyopathien wie eine kardiale Amyloidose zu finden.5
Weiterführende Diagnostik
Das Grundprinzip der erweiterten Diagnostik ist das Auffinden potenziell behandelbarer Ursachen der Herzinsuffizienz.
Die KHK ist häufig und sollte daher bei jeder Neudiagnose evaluiert werden. Das Ruhe-EKG ist häufig unspezifisch. Eine Ergometrie ist aufgrund der niedrigen Sensitivität und Spezifität zum Ausschluss einer KHK ungenügend. Falls begleitend eine Angina pectoris besteht, sollte direkt eine invasive Koronarangiografie stattfinden, anderenfalls kommen bildgebende Verfahren wie Stress-Echokardiografie, Koronar-CT, Myokardszintigrafie oder ein kardiale Magnetresonanztomografie zur Anwendung. Die klinische Situation bestimmt jeweils den nächsten diagnostischen Schritt. Das Herz-MRI ist ideal, um eine KHK (Narbe, Ischämie, Viabilität) oder seltenere Formen der Herzinsuffizienz wie eine Amyloidose, Sarkoidose oder Myokarditis zu suchen und die Herzanatomie und -funktion sehr präzise zu evaluieren.
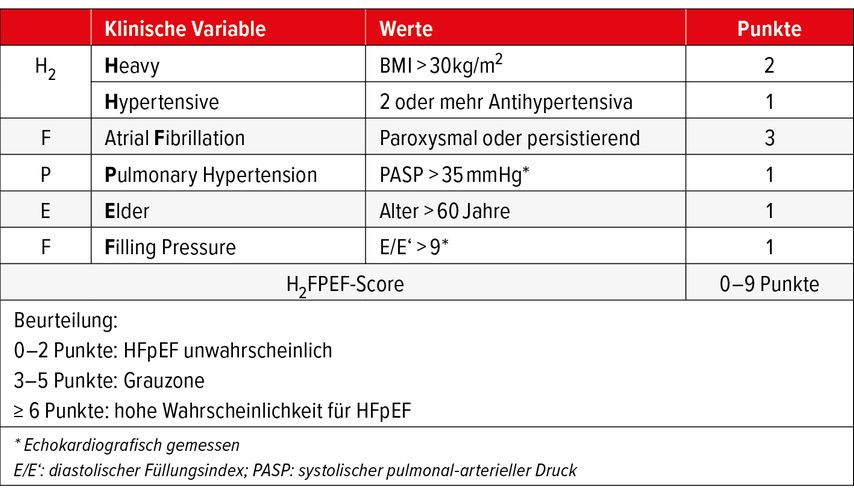
Bei unklarer Dyspnoe und uneindeutigen Befunden für eine HFpEF kann der H2FPEF-Score8 (Tab. 1) die diagnostische Sicherheit erhöhen. Neben wenigen klinischen Parametern ist zusätzlich eine Echokardiografie nötig. Im Direktvergleich war der H2FPEF-Score dem aufwendigeren HFA-PEFF-Score9 deutlich überlegen.10
Medikamentöse Behandlung
HFrEF
Für die HFrEF ist eine Behandlung mit ACE-Hemmern oder Angiotensinrezeptor-Neprilysin-Inhibitoren (ARNI), Betablockern, Aldosteronantagonisten (MRA) und SGLT2-Inhibitoren bestens belegt und etabliert. Zusätzlich werden Diuretika nach Bedarf verordnet.2
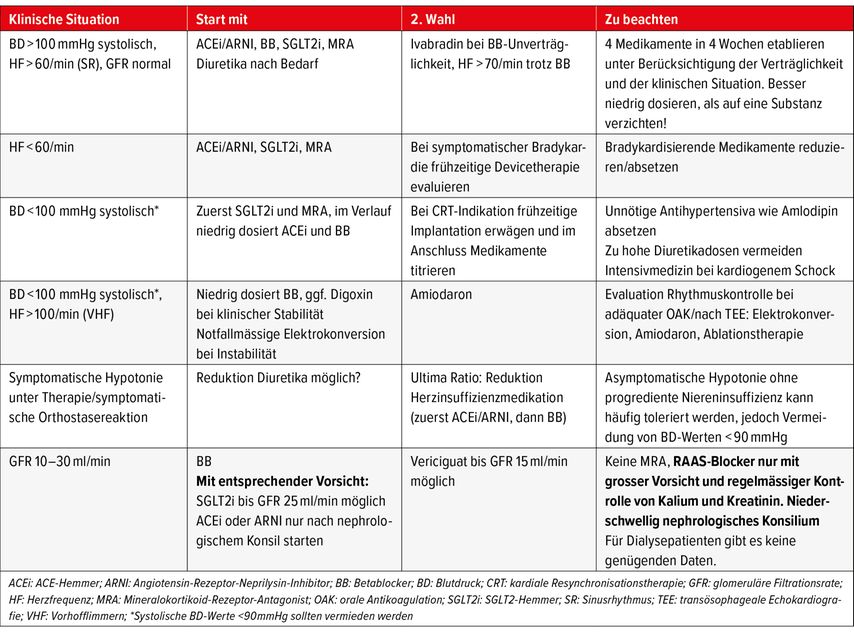
Früher wurde ein sequenzieller und dadurch zeitraubender Therapieaufbau empfohlen. Neu sollen die Medikamente frühzeitig kombiniert und schneller auftitriert (d.h. alle 4 Medikamente innerhalb von 4 Wochen etabliert) werden. Hierbei ist zu beachten, dass nicht alle Patienten dafür geeignet sind und immer eine individuelle Einschätzung erfolgen muss. Vor Therapiebeginn sollten als Basisparameter Blutdruck (im Liegen und im Stehen) und Puls, Nierenfunktion, NT-proBNP und EKG (Sinusrhythmus oder Vorhofflimmern) erfasst werden11 (Tab. 2).
Tab. 2: Entscheidungshilfe bei verschiedenen klinischen Szenarien (adaptiert u.a. nach Mc Donagh et al., 2021; Rosano et al., 2021)2, 11
Zur Verhinderung einer erneuten Hospitalisation wegen Herzinsuffizienz kann bei optimal therapierten und stabilisierten Patienten mit niedrigen BNP-Spiegeln eine Therapie mit Vericiguat disuktiert werden (Limitatio des Bundesamts für Gesundheit BAG beachten).12
HFpEF
Für die HFpEF waren bis vor Kurzem viele Medikamentenstudien enttäuschend: ACE-Hemmer, ARNI, Sartane, Betablocker oder MRA brachten keinen überzeugenden Nutzen.2 Neu konnten für die Klasse der SGLT2-Inhibitoren signifikante Verbesserungen der kombinierten Endpunkte Mortalität und Rehospitalisationsrate gezeigt werden: Die EMPEROR-Preserved-Studie zeigte mit Empagliflozin13 eine relative Risikoreduktion von 21% (absolute Risikoreduktion: 3,3%; p<0,001) und die DELIVER-Studie mit Dapagliflozin14 eine relative Risikoreduktion von 18% (absolute Risikoreduktion: 3,1%; p<0,001) – jeweils verglichen mit Placebo. Während bei HFrEF die SGLT2-Hemmer in den Studien ebenfalls die Mortalität (sekundärer Endpunkt) signifikant reduziert haben, ist dies bei HFpEF nicht der Fall: Hier ist die Senkung der Hospitalisationsrate signifikant, jedoch nicht die Reduktion der Mortalität.
HFmrEF
Die Studienlage bei HFmrEF ist schwieriger zu beurteilen: Grosse randomisierte Studien fehlen aktuell (noch). Die Empfehlungen bezüglich einer Therapie mit ACE-Hemmern, Sartanen, ARNI, Betablockern und MRA basieren überwiegend auf Subanalysen grosser Studien und haben lediglich Empfehlungen der Klasse IIb, Level of Evidence C (= geringe Studienevidenz, überwiegend Expertenmeinung).2
In einer gepoolten Analyse von Sacubitril-Valsartan in der PARADIGM- (HFrEF) und der PARAGON-Studie (HFpEF) fand sich ein signifikantes Therapieansprechen ebenfalls in der HFmrEF-Studienpopulation.15 Hierbei ist für ARNI die Limitatio des BAG zu beachten.
Kleinere (Register-)Studien zeigen ein gutes Therapieansprechen auf ACE-Hemmer und Betablocker16 (möglichst hoch dosiert) sowie MRA.17
SGLT2-Inhibitoren können unabhängig von der linksventrikulären Pumpfunktion verschrieben werden: In einer gepoolten Analyse von Jhund et al.mit Patienten der Studien DELIVER (HFpEF) und DAPA-HF (HFpEF und HFmrEF) konnte über das gesamte Spektrum der LVEF ein konsistenter Effekt von Dapagliflozin bezüglich der Reduktion von Mortalität und Herzinsuffizienz-Hospitalisationen gezeigt werden.18
Diuretische Strategien bei Dekompensation
Schleifendiuretika sind bei Dekompensation und Stauungszeichen ein wichtiger Pfeiler der Therapie (ESC-Empfehlung Klasse IA). Die initiale Dosis muss hoch genug gewählt werden (ein- bis zweifache Tagesdosis an Schleifendiuretika als initiale intravenöse Furosemiddosis19) und frühzeitig sollte über eine ergänzende Therapie mit einem Thiaziddiuretikum wie Metolazon,20 SGLT2-Hemmer21 oder Acetazolamid22 entschieden werden. Zur Rekompensation scheint es keinen relevanten Unterschied zwischen Torasemid und Furosemid zu geben.23
Im Spitalsetting sollte neben dem diuretischen Effekt auch initial die Natriumausscheidung im Urin monitorisiert werden und die Diuretika sollten entsprechend gesteuert werden, um den begleitenden Salzexzess zu beheben.19
Nach einer Dekompensation muss die optimal verträgliche und wirksame Diuretikadosis gefunden werden. Nicht selten sind Betroffene nach einer Hospitalisation überdiuretisiert. Dies kann sich in allgemeiner Schwäche, (orthostatischer) Hypotonie, starkem Durstgefühl oder einer aggravierten Niereninsuffizienz äussern. Häufig kann bei ausgebauter Herzinsuffizienztherapie, klinischer Stabilität und guter Schulung auf Diuretika verzichtet werden und es genügt, diese nur situativ einzusetzen.
Nicht medikamentöse Behandlung
Zur Korrektur von Klappenvitien stehen herzchirurgische und zunehmend interventionelle Verfahren für die Aorten-, Mitral- und neu auch Trikuspidalklappe zur Verfügung. Bei HFrEF sollten ein implantierbarer Cardioverter/Defibrillator (ICD) oder eine kardiale Resynchronisationstherapie diskutiert werden. Das Gleiche gilt für eine Ablationstherapie bei Vorhofflimmern.2
Die aortokoronare Bypassoperation ist bei schwerer KHK und HFrEF einer optimierten pharmakologischen Therapie überlegen.24 Dieser Nutzen ist für interventionelle Revaskularisationsmassnahmen auch bei nachgewiesener Viabilität nicht belegt.25
Idealerweise werden Betroffene in ein interdisziplinäres Herzinsuffizenzprogramm eingeschlossen2 (ESC-Empfehlung Klasse IA). Neben der Patientenschulung kann die Herzinsuffizienztherapie optimiert sowie bei klinischer Verschlechterung niederschwellig reagiert werden.
In den ersten 30 Tagen nach einer Hospitalisation ist die Mortalität am höchsten, insbesondere wenn die Patienten lange hospitalisiert waren oder einen komplizierten Verlauf hatten. Daher sollte nach Austritt eine Kontrolle in der Herzinsuffizienzsprechstunde innerhalb von 7 bis 10 Tagen organisiert werden.
In der STRONG-HF-Studie26 hatte eine Hochintensitätsbehandlung (unabhängig von der linksventrikulären Funktion) mit zügiger Medikamententitration innerhalb von 14 Tagen nach Spitalaufenthalt und häufigen Kontrollen in der Herzinsuffizienzsprechstunde über 180 Tage einen signifikanten Vorteil im Vergleich zur Standardtherapie bezüglich Rehospitalisation und Tod (15,2% vs. 23,3%; p=0,0021). Die Anzahl unerwünschter Nebenwirkungen wie Hypotonie war in der Hochintensitätsgruppe zwar höher, schwere Nebenwirkungen waren jedoch gleich häufig wie in der Standardgruppe.
Eine strikte Natriumrestriktion reduziert die Rate von Ereignissen wie Hospitalisationen und Notfallbesuchen oder die Gesamtmortalität nicht,27 Salz- und Flüssigkeitsexzesse sollten aber vermieden werden.2
Ausblick in die Zukunft und offene Fragen
Im Sommer 2023 wird es eine Aktualisierung der europäischen Herzinsuffizienz-Richtlinien geben, die u.a. den Stellenwert der Diuretikatherapie und Empfehlungen bezüglich der SGLT2-Hemmer näher beschreiben werden.
Literatur:
1 BFS aktuell: Todesursachenstatistik 2019. www.statistik.ch 2 Mc Donagh T et al.: 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021, 42: 3599-726 3 Berliner D et al.: The differential diagnosis of dyspnea. Dtsch Ärztebl Int 2016; 113: 834-45 4 Maisel A et al.: State of the art: using natriuretic peptide levels in clinical practice. Eur J Heart Fail 2008, 10; 824-39 5 Savarese G et al.: Heart failure with mid-range or mildly reduced ejection fraction. Nature Rev Cardiol 2022; 19: 100-16 6 Simmonds S et al.: Cellular and molecular differences between HFpEF and HFrEF: a step ahead in an improved pathophysiological understanding. Cells 2020; 9:242 7 Adamo L et al.: Proteomic signatures of heart failure in relation to left ventricular ejection fraction. JACC 2020; 76: 1982-94 8 Reddy Y et al.: A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation 2018; 138: 861-70 9 Pieske B et al.: How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J 2019; 40: 3297-317 10 Reddy Y et al.: Diagnosis of heart failure with preserved ejection fraction among patients with unexplained dyspnea. JAMA Cardiol 2022; 7: 891-9 11 Rosano G et al.: Patient profiling in heart failure for tailoring medical therapy. A consensus document of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2021; 23: 872-81 12 Armstrong P et al.: Vericiguat in patients with heart failure and reduced ejection fraction. N Engl J Med 2020; 382: 1883-93 13 Anker S et al.: Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med 2021; 385: 1451-61 14 Solomon S et al.: Dapagliflozin in heart failure with mildly reduced or preserved ejection fraction. N Engl J Med 2022; 387: 1089-98 15 Solomon S et al.: Angiotensin-Neprilysin inhibition in heart failure with preserved ejection fraction. N Engl J Med 2019; 381,1609-20 16 Straw S et al.: Guideline-directed medical therapy is similarily effective in heart failure with mildly reduced ejection fraction. Clin Res Cardiol 2023; 112: 111-22 17 Enzan N et al.: Spironolactone use is associated with improved outcomes in heart failure with mid-range ejection fraction. ESC Heart Failure 2020; 7: 336-44 18 Jhund P et al.: Dapagliflozin across the range of ejection fraction in patients with heart failure: a patient level, pooled meta-analysis of DAPA-HF and DELIVER. Nature Med 2022; 28: 1956-64 19 Mullens W et al.: The use of diuretics in heart failure with congestion — a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2019; 21: 137-55 20 Trulls JC et al.: Combining loop with thiazide diuretics for decompensated heart failure: the CLOROTIC trial. Eur Heart J 2023; 44: 411-21 21 Voors A et al.: The SGLT2 inhibitor empagliflozin in patients hospitalized for acute heart failure: a multinational randomized trial. Nat Med 2022; 28: 568-74 22 Mullens W et al.: Acetazolamide in acute decompensated heart failure with volume overload. N Engl J Med 2022; 387: 1185-95 23 Mentz R et al.: Effect of torsemide vs furosemide after discharge on all-cause mortality in heart failure: the TRANSFORM-HF randomized clinical trial. JAMA 2023; 329: 214-23 24 Velazquez E et al.: Coronary-artery bypass surgery in patients with ischemic cardiomyopathy. N Engl J Med 2016; 374: 1511-20 25 Perera D et al.: Percutaneous revascularization for ischemic left ventricular dysfunction. N Engl J Med 2022; 387: 1351-60 26 Mebazaa A et al.: Safety, tolerability and efficacy of up-titration of guideline-directed medical therapies for acute heart failure (STRONG-HF): a multinational, open-label, randomised, trial. Lancet 2022; 400: 1938-52 27 Ezekowitz J et al.: Reduction of dietary sodium to less than 100 mmol in heart failure (SODIUM-HF): an international, open-label, randomised, controlled trial. Lancet 2022; 399: 1391-400
Das könnte Sie auch interessieren:
ESC gibt umfassende Empfehlung für den Sport
Seit wenigen Tagen ist die erste Leitlinie der ESC zu den Themen Sportkardiologie und Training für Patienten mit kardiovaskulären Erkrankungen verfügbar. Sie empfiehlt Training für ...
ESC-Guideline zur Behandlung von Herzvitien bei Erwachsenen
Kinder, die mit kongenitalen Herzvitien geboren werden, erreichen mittlerweile zu mehr 90% das Erwachsenenalter. Mit dem Update ihrer Leitlinie zum Management kongenitaler Vitien bei ...
Inclisiran bei Patienten mit Statinintoleranz wirksam und sicher
Eine Analyse statinintoleranter Patienten aus dem Phase III Studienprogramm ORION zeigt, dass Inclisiran die LDL-Cholesterinspiegel kardiovaskulärer Hochrisikopatienten, die kein Statin ...