Antibiotikaresistenz und neue Antibiotika
Bericht:
Dr. Corina Ringsell
Redaktorin
Review:
Prof. Dr. med. Nina Khanna
Universität und Universitätsspital Basel
E-Mail: nina.khanna@usb.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Resistenzen gegen Antibiotika sind ein zunehmendes Problem und waren 2019 weltweit für rund 1,3 Millionen Todesfälle unmittelbar verantwortlich.1 Wie die Epidemiologie in der Schweiz aussieht, welche Massnahmen nötig sind, um Antibiotikaresiszenzen zu vemeiden, und auf welchen neuen Medikamenten nun die Hoffnungen liegen, erläuterte Prof. Dr. med. Nina Khanna, Universität und Universitätsspital Basel.
Keypoints
-
Antibiotikaresistenzen nehmen weltweit zu.
-
Um «Multiple drug resistant»- (MDR)-Pathogene zu verhinden oder zu bekämpfen, braucht es vielschichtige Konzepte.
-
Antibiotic Stewardship ist essenziell.
-
Trotz der Fortschritte in der Entwicklung neuer antimikrobieller Substanzen ist es schwierig, Wirkstoffe mit selektiver Wirkung gegen MDR-Erreger zu finden.
-
Aktuell besteht ein «unmet medical need» für neue Medikamente gegen resistente gramnegative Erreger.
-
Es bedarf effizienter Entwicklungspfade für traditionelle und nichttraditionelle antibak-terielle Wirkstoffe bei Herstellungs-, klinischen Versuchs- und Zulassungsverfahren.
-
Schwierigkeiten treten auf beim optimalen Studiendesign, bei der Auswahl und Rekrutierung der relevanten Zielpopulation.
Die Infektiologin leitete ihren Vortrag mit dem Fall einer 84-jährigen Patientin ein, die mit einem septischen Schock von einer geriatrischen Klinik ins Universitätsspital Basel überwiesen wurde. Die empirische Therapie mit Piperacillin und Tazobactam brachte keine Verbesserung. In der Blutkultur wurde der Carbapenemase-produzierende Erreger Klebsiella pneumoniae nachgewiesen. Das Antibiogramm ergab Resistenzen gegen alle getesteten Antibiotika ausser Cotrimoxazol. In der molekularen Abklärung wurden mehrere Carbapenemasen/ESBL-Typen nachgewiesen. Die Patientin verstarb innerhalb der nächsten vier Stunden. In einem solchen Fall stelle sich die Frage, ob es eine Veränderung in der Epidemiologie gibt, sagte Khanna. Die Patientin sei nicht im Ausland gewesen, habe die meiste Zeit ihres Lebens zu Hause und die letzten Monate im geriatrischen Spital verbracht.
In einer Studie aus dem Jahr 2023 konnte gezeigt werden, dass bei lediglich 62% der Fälle mit Carbapenemase-produzierenden Bakterien ein eindeutiger Zusammenhang mit einem Endemiegebiet hergestellt werden konnte, häufig auch keine wirkliche Verbindung.2
Epidemiologie in der Schweiz
2015 wurden in der Schweiz mehr als 7100 Fälle von Infektionen mit antibiotikaresistenten Bakterien erfasst, davon führten 276 zum Tod.3 Khanna stellte Daten von ANRESIS (www.anresis.ch) vor, die die aktuelle Situation in der Schweiz zeigen. Hier hat sich in den vergangenen 20 Jahren der Anteil der Fluorchinolon-resistenten E.coli (FQR-E.coli) fast verdoppelt (20%), der Anteil der „extended spectrum“-Cephalosporin-resistenten E.coli (ESCR- E.coli) hat sich gar verfünffacht (12–15%). Dagegen sind die Prozente der resistenten grampositiven Keime wie der Penicillin-resistenten S.pneumoniae (PNSP) und der Methicillin-resistenten Staphylococcus aureus (MRSA) leicht gesunken. Vancomycin-resistente Enterokokken (VRE) liegen auf einem niedrigen Niveau mit kleinen Peaks.4
Bei den Carbapenem-resistenten Erregern ist K. pneumoniae aktuell der häufigte Vertreter mit einer höheren Rate in der Westschweiz, vor allem Genf, und in der Gegend um Zürich.5
Ursachen von Antibiotikaresistenzen und Massnahmen dagegen
Ursachen für das Entstehen von Antibiotikaresistenzen sind vor allem:
-
zu häufige/inkorrekte Verordnung von Antibiotika
-
falsche Einnahme durch die Patient:innen
-
unnötige Anwendung von Antibiotika in der Landwirtschaft
-
nicht adäquate Infektionsprävention und -kontrolle im Gesundheitswesen
-
mangelnde Hygienemassnahmen
-
fehlende Diagnostik, um die Erreger zu identifizieren
So vielfältig wie die Ursachen für Antibiotikaresistenzen sind auch die Massnahmen, um ihnen vorzubeugen. Khanna ging in ihrem Vortrag dabei auf zwei besonders wichtige Aspekte ein: «Antibiotic Stewardship» und die Entwicklung neuer Substanzen.
Antibiotic Stewardship
Unter Antibiotic Stewardship (ABS) versteht man den rationalen und verantwortungsvollen Einsatz von Antibiotika mit dem Ziel, die Patient:innen bestmöglich zu behandeln und gleichzeitig zu verhindern, dass Selektionsprozesse und Resistenzen bei den Bakterien auftreten.
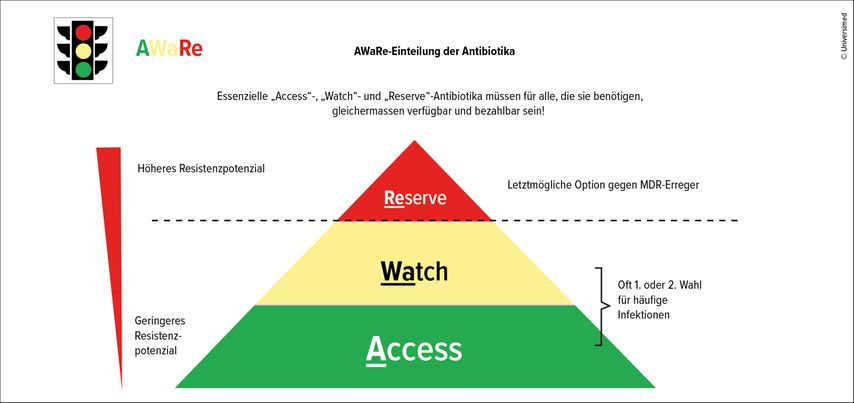
Eine Untersuchung in 76 Ländern zeigte jedoch, dass von 2000 bis 2015 der Antibiotikaverbrauch um etwa 65% zugenommen hat, vor allem in Ländern mit niedrigem und mittlerem Einkommen.6 Um die Auswahl von geeigneten Substanzen zu erleichtern, hat die Weltgesundheitsorganisation WHO mit dem AWaRe-Schema die verfügbaren Antibiotika klassifiziert (Abb. 1). «Access» umfasst Substanzen mit einem geringen Resistenzrisiko, in «Watch» finden sich Antibiotika, die auch oft im Spital eingesetzt werden, während «Reserve» Medikamente mit hohem Resistenzpotenzial beinhaltet, die ausgewählten Fällen als letzte Option vorbehalten sind. Für die häufigsten Infektionen sollten gemäss WHO nur Medikamente der ersten beiden Gruppen eingesetzt werden, vor allem aus «Access».7 Ob dies so umgesetzt wird, hat eine europäische Studie untersucht. Sie zeigte nicht nur, dass es europaweit grosse Unterschiede im Antibiotikagebrauch gibt, sondern auch, dass in bestimmten Ländern ein besonders hoher Anteil an «Access»-Antibiotika verordnet wird, zum Beispiel in Dänemark und Frankreich.7
Bevor man ein Antibiotikum anwendet, sollte man sich immer fragen, ob es überhaupt indiziert ist, betonte die Infektiologin. So sei etwa bei einer unkomplizierten Otitis media, Bronchitis, Sinusitis, Pharyngitis, bei asymptomatischen Bakteriurien und unkomplizierten Harnwegsentzündungen kein Antibiotikum nötig.8 Dennoch würden bei diesen Beschwerden auch in der Schweiz noch immer viel zu oft Antibiotika verordnet, sagte sie.9
«Sind Antibiotika aber indiziert, dann sollte man sich genau überlegen, welches in welcher Dosis am besten geeignet ist», betonte Khanna. Es sollte möglichst oral und so kurz wie nötig verabreicht werden.
Multiresistente Erreger und neue Medikamente
Die WHO hat die Liste von Bakterien, für die dringend neue Antibiotika benötigt werden, aktualisiert.10 Aktuell gehören die Carbapenemase-resistenten Erreger Acinetobacter baumannii und die Enterobacterales in die Gruppe mit der höchsten Priorität («critical»). In der Gruppe mit Priorität «high» sind unter anderem Enterococcus faecium und Staphylococcus aureus zu finden. Pseudomonas aeroginosa wurde aus der Gruppe mit der höchsten Priorität in diese niedrigere Gruppe eingeordnet.10
Im klinischen Alltag betreffen die häufigsten resistenzerzeugenden Mutationen gramnegative Bakterien, welche β-Lactamasen produzieren.11 «Für die Enterobacterales sind dies vor allem Penicillinasen (z.B. TEM 1, SHV 1), ESBL wie CTX-M (>90% aller ESBL-Typen), AmpC und Carbapenemasen», erklärte Khanna.
ESBL: „extended spectrum β-lactamases“
ESBL-positive Erreger sind Carbapenem-sensitiv und sprechen fast immer auf Nitrofurantoin und Fosfomycin, oft auch auf Cotrimoxazol und Ciprofloxacin an.12 ESBL-E.coli und -K.pneumoniae haben sich in den vergangenen 20 Jahren in Europa stark ausgebreitet und machen bis zu 50% der invasiven Isolate aus.13
Natürlich könne man ESBL-positive Bakterien mit Carbapenemen behandeln, sagte die Infektiologin. Das Ziel sei jedoch, diese einzusparen. Daher werden neue Wirkstoffe entwickelt. Schon recht weit sind die Kombinationen Cefepim/Taniborbactam, Cefepim/Enmetazobactam und Sublactam/Durlobactam (jeweils Phase III).
Carbapenemase-produzierende Bakterien
Anhand eines Fallberichts stellte Khanna die Resistenzprobleme bei Carbapenemase-produzierenden Erregern dar. Der Patient war, bevor er in die Schweiz gekommen war, in Polen wegen einer Urosepsis hospitalisiert worden, wo eine Infektion mit K. pneumoniae festgestellt worden war. Im Universitätsspital Basel wurde der Mann zunächst empirisch mit Ertapenem i.v. behandelt und eine Urinkultur angelegt. Die molekulare Abklärung zeigte, dass es sich um einen Metallo-β-Lactamase-produzierenden (MBL-)Stamm des Bakteriums handelte, der gegen sämtliche getesteten Antibiotika resistent war. Die Leitlinien der IDSA (Infectious Diseases Society of America) und der ESCMID (European Society of Clinical Microbiology and Infectious Diseases) empfehlen in solchen Fällen Cefiderocol oder Ceftazidim/Avibactam plus Aztreonam.14,15
Cefiderocol umgeht die Resistenzmechanismen, indem es anders als β-Laktam-Antibiotika nicht nur den Porinkanal nutzt, um in die Bakterienzelle einzudringen, sondern auch deren Eisen-Transportsystem. In der Zelle bindet es an penicillinbindende Proteine (PBP) und wirkt so bakterizid. Es kann nicht durch β-Laktamasen abgebaut werden und verhindert seinen Transport aus der Zelle durch Modifikation der Effluxpumpe. Cefiderocol wirkt gegen die drei Erreger mit der höchsten Priorität in der WHO-Liste, Pseudomonas, Acinetobacter und Enterobacterales.16
In einer Studie mit 150 Teilnehmenden wurde die Substanz mit der besten verfügbaren Therapie verglichen. Dabei zeigte sich zwar, dass Cefiderocol ebenso gut wirkte wie die jeweilige Vergleichsbehandlung, aber zu mehr Todesfällen führte (34% vs. 18%).17 In einer Fallserie am Universitätsspital Basel konnte dies jedoch nicht beobachtet werden. Auch andere Studien zeigten keine vermehrten Todesfälle unter Cefiderocol.18
Im von Khanna vorgestellten Fall erwies sich der Erreger allerdings auch als resistent gegen Cefiderocol. Einzig Fosfomycin und Tigecyclin waren noch wirksam. Daraufhin wurde ein Synergietest für Ceftazidim/Avibactam und Aztreonam vorgenommen, der einen «Fractional Inhibitory Concentration Index» (FICI) von 0,06 ergab. Bei einem FICI ≤0,5 geht man von einer Synergie aus. Die Kombination wäre daher eine Alternative gewesen. Es wurde aber die Therapie mit Fosfomycin eingeleitet.
Ein besonderes Problem: Carbapenem-resistenter Acinetobacter baumannii
Dieser Erreger ist laut Khanna derzeit in der Schweiz noch nicht weit verbreitet. Sein Management sei jedoch komplex, sagte sie. Einerseits sei es oft schwierig, zwischen einer Kolonisation und einer Infektion zu unterscheiden, häufig entstünden aus einer Kolonisation aber auch Infektionen. Andererseits hat A. baumannii multiple Resistenzmechanismen entwickelt, unter anderem MBL und verschiedene Carbapenemasen. Einen einheitlichen Behandlungsstandard gibt es derzeit nicht. Die Leitlinien empfehlen Ampicillin-Sulbactam, alternativ zum Beispiel Tigecyclin oder Polymyxine.14,15
Ein neues Medikament enthält die Kombination Sulbactam-Durlobactam. Es wurde in der ATTACK-Studie mit Colistin bei schweren A.-baumannii-Pneumonien verglichen. Die Kombination war Colistin nicht unterlegen, sie ging im Gegenteil mit höheren klinischen Heilungsraten, besserem mikrobiologischem Outcome und geringerer Nephrotoxizität einher.19 In den USA ist das Medikament bereits zugelassen, in der Schweiz noch nicht.
Vancomycin-resistente Enterokokken
Bei der Vancomycinresistenz verändert sich die Struktur der Bakterienzellwand, weshalb die Substanz nicht mehr binden kann.20 Vancomycin-resistente Enterokokken (VRE) hätten zwar eine geringe Pathogenität, könnten aber bei Risikopersonen, etwa bei Immungeschwächten oder Patient:innen auf der Intensivstation, schwere Infektionen verursachen, betonte die Infektiologin. Ausserdem würden in der Schweiz zunehmend VRE isoliert, die eine geringere Empfindlichkeit gegen Daptomycin aufweisen. In solchen Fällen werde die Therapie mit Linezolid empfohlen, erklärte sie.
Was aktuell in der Pipeline ist
«Leider muss man sagen, dass die Pipeline relativ leer ist», sagte Khanna. Derzeit sind 76 antimikrobielle Substanzen in unterschiedlichen Phasen der Entwicklung. Davon richten sich 41 gegen Pathogene mit der höchsten Priorität in der WHO-Liste, 16 gegen Mykobakterien, 15 gegen Clostridium difficile und 4 sind Breitspektrumwirkstoffe.21
Besonders interessant ist laut Khanna eine neue Kombination gegen MBL-produzierende P. aeruginosa, Cefepim/Zidebactam. Das Besondere seien die starke Hemmung der β-Lactamase und die antibakterielle Wirkung durch die hohe Bindungsaffinität an das PBP2-Protein.22
Quelle:
SGAIM-Frühjahrskongress, 29. bis 31. Mai 2024, Basel
Literatur:
1 Antimicrobial Resistance Collaborators: Lancet 2022; 399(10325): 629-55 2 Vock I et al.: Infect Control Hosp Epidemiol 2023; 44(12): 1959-65 3 Gasser M et al.: Lancet Infect Dis 2019; 19(1): 17-8 4 https://www.bag.admin.ch/bag/de/home/krankheiten/infektionskrankheiten-bekaempfen/antibiotikaresistenzen/wie-entwickelt-sich-die-antibiotikaresistenzlage---.html#-2042803317 5 www.anresis.ch/antibiotic-resistance/resistance-data-human-medicine 6 Klein EY et al.: PNAS 2018; 115(15): E3463-70 7Moja L et al.: Clin Microbiol Infect 2024: 30 Suppl 2: S1-51 8 www.biham.unibe.ch/research/tools_to_facilitate_shared_decision_making/index_eng.html 9 Glinz D et al.: J Antimicrob Chemother 2017; 72(11): 3205-12 10 www.who.int/publications/i/item/9789240093461 11 Peleg AY et al.: N Engl J Med 2010; 362: 1804 13 12 Jacoby GA et al.: N Engl J Med 2005; 352: 380 13 Antimicrobial resistance in the EU/EEA (EARS-Net): www.ecdc.europa.eu/sites/default/files/documents/AER-antimicrobial-resistance.pdf 14 Tamma PD et al: Clin Infect Dis 2024: ciae403 (doi: 10.1093/cid/ciae403) 15 Mical P et al.: Clin Microbiol Infect 2022; 28(4): 521-47 16 Wang H, Palasik BN: Ther Adv Urol 2022; doi: 10.1177/17562872211065570 17 Bassetti M et al.: Lancet Infect Dis 2021; 21: 226-40 18 Zingg S et al.: Open Forum Infect Dis 2020; 7(6): ofaa185 19 Kaye KS et al.: Lancet Infect Dis 2023; 23(9): 1072-84 20 Murray BE: N Engl J Med 2000; 342: 710-21 21 Butler MS et al.: Antimicrob Agents Chemother 2022; 66(3): e0199121 22 Dubey D et al.: Ann Clin Microbiol Antimicrob 2023; 22(1): 55
Das könnte Sie auch interessieren:
Management of chronic insomnia according to the latest European guidelines
Insomnia is among the most prevalent sleep disorders, affecting up to one third of adults and 6–10% with chronic forms. The 2023 European Insomnia Guidelines1 emphasize that insomnia is ...
Kognitive und soziale Folgen eines Schlaganfalls
Jährlich erleiden in der Schweiz rund 249 von 100000 Menschen einen Schlaganfall, dessen Folgen weit über die akute medizinische Versorgung hinausreichen. Neben motorischen ...
Gesundheitsbelastungen und Gefährdungen durch Schicht- und Nachtarbeit
Schicht- und Nachtarbeit führen durch Schlafverlust und zirkadiane Desynchronisation zu einem erhöhten Risiko für vielfältige Gesundheitsprobleme. Dazu gehören verbreitete somatische ...