Cardiomyopathies: mise à jour
Auteur:
Dr méd. Federico Moccetti
Oberarzt mbF
Kardiologie, Interventionelle Kardiologie
Luzerner Kantonsspital, Luzern
E-mail: federico.moccetti@luks.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Cette mise à jour se limite à trois cardiomyopathies pertinentes pour la pratique, à savoir la cardiomyopathie hypertrophique, l’amyloïdose cardiaque et l’insuffisance cardiaque à fraction d’éjection préservée (HFpEF). La dernière semble à première vue être un diagnostic qui devrait plutôt être classé dans la catégorie «insuffisance cardiaque», mais il existe des chevauchements avec les cardiomyopathies, et la procédure diagnostique ainsi que les pièges/risques d’erreur de diagnostic sont les mêmes que ceux des cardiomyopathies.
Keypoints
-
La cardiomyopathie hypertrophique n’est pas rare, la plupart des patients sont âgés de 50 à 70 ans. Le mavacamten, un nouveau médicament, s’est avéré prometteur dans les premières études cliniques.
-
L’amyloïdose cardiaque est plus fréquente qu’on ne le supposait auparavant. Le diagnostic est devenu plus simple à poser et plusieurs causes peuvent être traitées.
-
Le diagnostic de HFpEF peut cacher d’autres causes de dyspnée, telles que l’amyloïdose cardiaque, les valvulopathies (sténose aortique, insuffisance mitrale), la coronaropathie (accompagnée d’une dyspnée équivalente d’angor), la péricardite constrictive, la cardiomyopathie restrictive ou d’autres cardiomyopathies.
-
Il est donc essentiel de reconnaître les «red flags» (cf Tab.1).
Cardiomyopathie hypertrophique
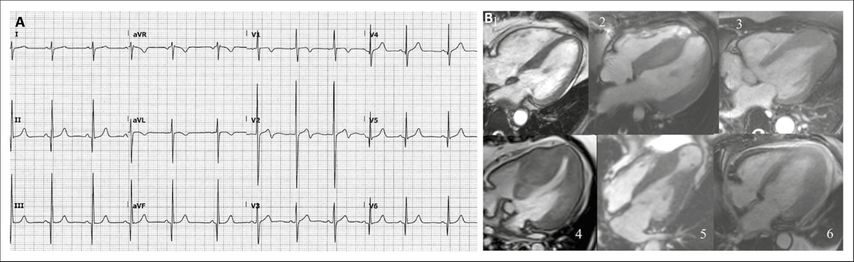
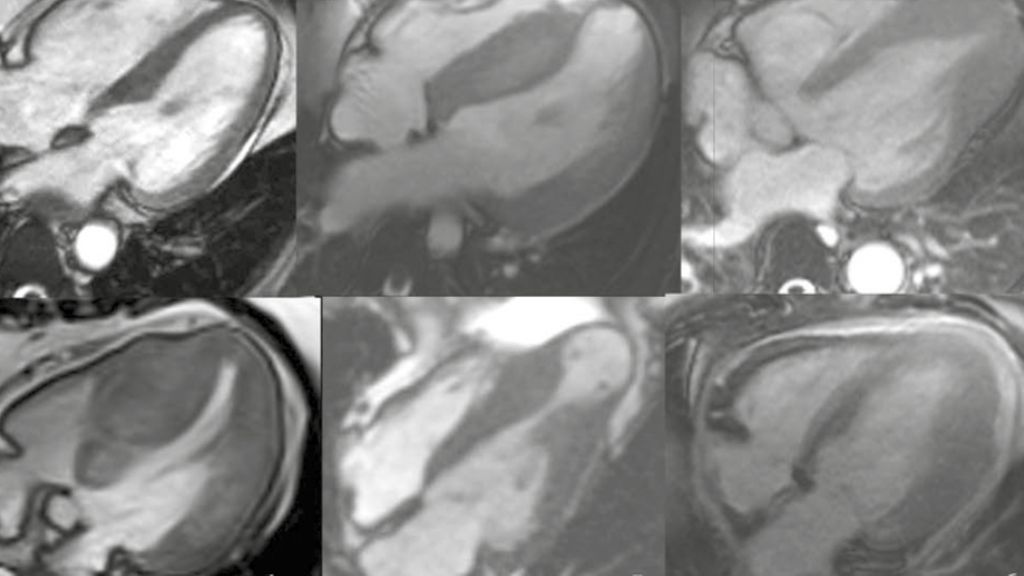
La cardiomyopathie hypertrophique (CMH) est due à des mutations sur les gènes qui codent pour l’appareil contractile. Il en résulte des myofibrilles qui ne sont pas disposées normalement, mais sont désorganisées («in disarray»), entraînant des cardiomyocytes hypertrophiques. Sur le plan macroscopique, cette hypertrophie cellulaire peut prendre différentes formes en fonction du stade de la maladie et de la localisation anatomique (prédominante sur le septum ou uniquement apicale) (Fig.1). L’une des idées fausses les plus répandues est que la CMH se manifeste déjà dans l’enfance/au début de l’âge adulte. Bien qu’il s’agisse d’une maladie génétique, le phénotype (hypertrophie) et les symptômes associés n’apparaissent qu’à l’âge adulte (seconde moitié de la vie) chez la majorité des patients.
Fig. 1: A) ECG avec signes d’hypertrophie; B) IRM de différentes formes de CMH: 1) cœur normal en comparaison; 2) CMH, sans obstruction de la voie d’éjection; 3) CMH, forme apicale; 4) CMH, avec obstruction de la voie d’éjection (CMHO); 5) CMH, avec obstruction médioventriculaire, avec anévrisme apical; 6) CMH, avec hypertrophie, particulièrement au niveau de la paroi antérolatérale
Les 3 principaux symptômes et complications de la CMH sont les suivants: dyspnée, syncope et mort subite d’origine cardiaque. La mort subite d’origine cardiaque est heureusement devenue rare grâce aux traitements modernes, au dépistage et à l’utilisation dûment choisie de défibrillateurs (DAI).
Les 3 principales causes de dyspnée chez les patients atteints de CMH sont les suivantes: obstruction de la voie d’éjection et/ou dysfonction diastolique du ventricule hypertrophique et «rigide». Chez certains patients, une interaction peut également avoir lieu entre le septum hypertrophique, étroitement juxtaposé sur le plan anatomique, et le feuillet mitral antérieur, ce qui peut conduire à une insuffisance mitrale (SAM, «systolic anterior movement»).
L’utilisation de bêtabloquants et d’antagonistes du calcium (et plus rarement de médicaments inotropes négatifs) permet de réduire l’obstruction de la voie d’éjection et le SAM. Si le traitement médicamenteux ne suffit pas, le septum hypertrophique peut être éliminé physiquement (soit par myectomie chirurgicale, soit par ablation septale non chirurgicale).
Au cours des deux dernières années, plusieurs études cliniques ont démontré des résultats positifs en cas d’utilisation du mavacamten chez les patients très symptomatiques atteints de CMH. Le mavacamten est un médicament inotrope négatif puissant. L’étude VALOR-HCM a été menée sur des patients souffrant de dyspnée sévère et dont le stade de la maladie était tel qu’ils se qualifiaient pour une myectomie non chirurgicale ou chirurgicale (n=112, 60ans, 49% de femmes; classe NYHA III–IV pour 93% d’entre eux). Après 16 semaines de traitement par le mavacamten ou le placebo, 63% des patients du groupe sous mavacamten ont présenté une réduction de la dyspnée ≥1 classe NYHA (contre 21% dans le groupe sous placebo). Le gradient d’obstruction de la voie d’éjection a également pu être réduit à des valeurs nettement plus faibles: 14mmHg sous mavacamten contre 46mmHg sous placebo. À la fin de l’étude, seuls 18% des patients du groupe sous mavacamten se sont qualifiés pour une myectomie chirurgicale ou non chirurgicale (contre 77% dans le groupe sous placebo).1
Amyloïdose cardiaque
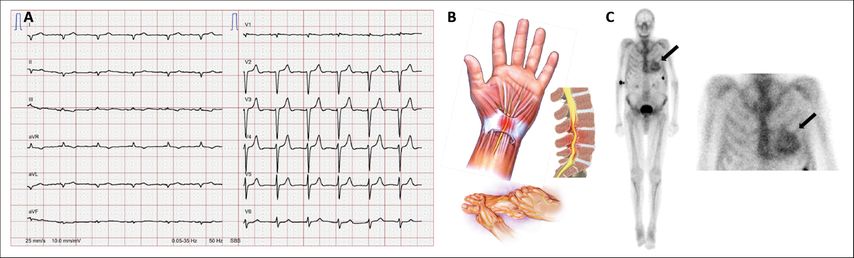
Dans le cas de l’amyloïdose cardiaque, il s’agit d’un dépôt de protéines dans le myocarde. Les deux principales formes sont l’amyloïdose AL, généralement en cas de myélome multiple, et lamyloïdose à transthyrétine (ATTR). La transthyrétine est une protéine de transport de la tyroxine et du rétinol (vitamine A). La protéine étant mal repliée, celle-ci se dépose de manière pathologique dans le myocarde. Le principal symptôme est la dyspnée, les «red flags» sont la basse tension sur l’ECG (généralement une basse tension périphérique dans les dérivations des extrémités) ou un aspect de pseudo-infarctus à l’ECG (Fig. 2A). Ceci est particulièrement suspect lorsque l’échocardiographie montre une hypertrophie myocardique («beaucoup de muscle, peu de débit»). Les «red flags» cliniques et anamnestiques sont le syndrome du canal carpien (bilatéral), la sténose du canal rachidien et la polyneuropathie (Fig. 2B).
Alors que le diagnostic et le traitement de l’amyloïdose AL n’ont pas beaucoup évolué, et reposent sur le diagnostic ainsi que le traitement du myélome multiple, des progrès ont été réalisés pour l’amyloïdose ATTR. Le diagnostic, qui nécessitait auparavant souvent une biopsie, a été considérablement simplifié par la possibilité de recourir à la scintigraphie. Il est possible d’utiliser à cet effet des traceurs qui sont souvent employés pour la scintigraphie osseuse (Tc-PYP ou Tc-DPD). L’examen est simple, il suffit d’injecter le traceur radioactif par voie veineuse et de réaliser des images dans le dispositif caméra. L’accumulation du traceur radioactif dans le myocarde (Fig. 2C) permet de diagnostiquer une amyloïdose ATTR avec une sensibilité et une spécificité élevées. La pose du diagnostic a également une conséquence thérapeutique depuis quelques années: si les critères sont remplis, le tafamidis peut être administré. Ce médicament stabilise le tétramère de transthyrétine et empêche toute protéine mal repliée (et donc son accumulation dans le myocarde). L’étude ATTR-ACT menée sur 440 patients (randomisés pour recevoir du tafamidis ou un placebo) a mis en évidence une réduction relative de 30 % de la mortalité et de 32 % des hospitalisations.2
Fig. 2: A) ECG en cas d’amyloïdose cardiaque avec basse tension périphérique et «aspect de pseudo-infarctus»; B) plusieurs «red flags» de l’amyloïdose; C) scintigraphie au DPD-technétium avec accumulation du traceur dans le myocarde, typique de l’amyloïdose ATTR
HFpEF
L’insuffisance cardiaque à fraction d’éjection préservée (HFpEF) a bénéficié d’une grande attention ces dernières années. Alors qu’aucun médicament testé pour cette maladie n’a pu démontrer un bénéfice pendant des décennies, l’étude EMPEROR-Preserved a donné pour la première fois un résultat positif en 2021: l’empagliflozine, un inhibiteur de SGLT2, est le premier médicament pour lequel une réduction des hospitalisations liées à une insuffisance cardiaque a été démontrée en cas de HFpEF.3
Des études épidémiologiques montrent que la HFpEF n’est pas rare et qu’elle est probablement aussi fréquente que l’insuffisance cardiaque à fraction d’éjection réduite (HFrEF) dite «ordinaire».4
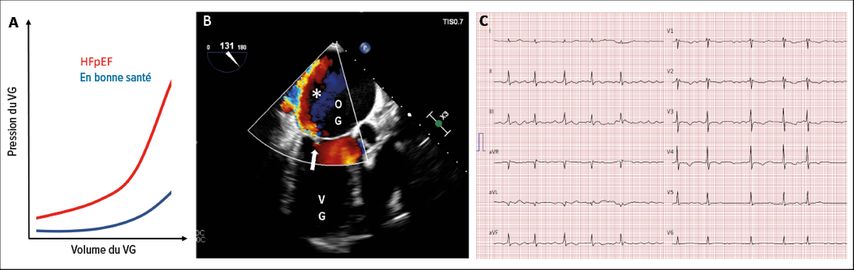
Comme pour la CMH et l’amyloïdose cardiaque, un patient atteint de HFpEF se présente à votre cabinet avec une dyspnée ou une intolérance à l’effort. Outre l’anamnèse et l’examen clinique (notamment une auscultation minutieuse), l’ECG, le dosage du BNP et l’échocardiographie sont essentiels au diagnostic. Selon notre expérience et les directives actuelles5, les outils diagnostiques mentionnés ci-dessus ne suffisent cependant pas toujours pour le diagnostic. En effet, après l’anamnèse, l’ECG, le dosage du BNP, un éventuel examen pneumologique et l’échocardiographie, il n’est souvent pas encore clair si l’on peut poser le diagnostic de HFpEF. Le cas échéant, le cathétérisme cardiaque droit permet de clarifier la situation (Fig.3A). Cet examen peut être réalisé en ambulatoire par voie veineuse (généralement la veine cubitale dans notre clinique). En cas de HFpEF, la PAPO ou «pression d’occlusion», à savoir la pression qui existe dans l’oreillette gauche et par conséquent dans les poumons pendant tout le cycle cardiaque, est beaucoup trop élevée. Cela peut déjà être le cas au repos ou, comme dans environ la moitié des cas, seulement à l’effort.
Une dyspnée associée à une fraction d’éjection préservée est synonyme de HFpEF? Pas toujours!
L’association d’une dyspnée et d’une fraction d’éjection préservée à l’échocardiographie est fréquente, ce qui a conduit à l’utilisation courante du terme HFpEF dès qu’un patient présente les deux. Cela comporte le risque que le diagnostic de HFpEF soit utilisé comme mot fourre-tout pour différents problèmes cardiovasculaires et pneumologiques. Comme pour les cardiomyopathies, il est donc important de veiller aux «red flags». Dans ma pratique clinique quotidienne, j’ai déjà suivi plusieurs patients pour lesquels on avait classé le diagnostic comme HFpEF, mais chez lesquels un examen approfondi a révélé une toute autre cause pour les symptômes.
Citons l’exemple d’une patiente de 61 ans qui, après plusieurs mois de dyspnée progressive, a dû être hospitalisée en raison d’une décompensation cardiaque. Après une recompensation par diurétiques, l’échocardiographie a révélé une fraction d’éjection du ventricule gauche de 65%, aucun trouble de la mobilité de la paroi ni aucune malformation. Le diagnostic de HFpEF a été posé. Peu de temps après, le médecin de famille de la patiente nous a contactés pour nous demander comment nous expliquerions le souffle systolique de 3/6. La nouvelle échocardiographie réalisée dans le cadre de notre consultation n’a mis en évidence aucune insuffisance mitrale, mais l’examen transœsophagien a finalement révélé une insuffisance mitrale sévère avec un jet extrêmement excentré le long de la paroi de l’oreillette (qui ne pouvait pas être vu lors de l’examen transthoracique; Fig. 3B). Après la reconstruction chirurgicale de la valve mitrale, la patiente ne souffrait plus de dyspnée. Ce cas illustre comment d’autres diagnostics peuvent être classés à tort comme HFpEF.
Fig. 3: A) Rapport pression-volume du ventricule gauche (VG) chez les personnes en bonne santé et chez les patients atteints de HFpEF. En cas de HFpEF, même une petite augmentation de volume dans le ventricule «rigide» provoque une augmentation considérable de la pression, qui est transmise à l’oreillette gauche et aux vaisseaux pulmonaires, ce qui entraîne une dyspnée. B) Examen transœsophagien de la patiente de l’exemple de cas, chez laquelle le jet d’insuffisance (*) fortement excentré de la valve mitrale (flèche) est visible (OG: oreillette gauche; VG: ventricule gauche). C) ECG de la patiente de l’exemple de cas
Connaître et reconnaître les «red flags» (Tab. 1) permet souvent de poser le bon diagnostic et d’administrer un traitement correct.
Littérature:
1 Olivotto I et al.; Lancet 2020; 396: 759-69 2 Maurer MS et al.; ATTR-ACT Study Investigators: N Engl J Med 2018; 379: 1007-16 3 Anker SD et al.; EMPEROR-Preserved Trial Investigators: N Engl J Med 2021; 385: 1451-61 4 Owan TE et al.: N Engl J Med 2006; 355: 251-9 5 Pieske B et al.: Eur Heart J 2019; 40: 3297-317
Das könnte Sie auch interessieren:
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Technologies avancées et existantes dans la gestion du diabète
Même si le terme «traitement» est compris dans le nom de la conférence, la 18th International Conference on Advanced Technologies & Treatments for Diabetes (ATTD) constitue le rendez- ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...