Diagnostic, complications et traitement
Auteur:
PD DDr Nicolas Dominik Verheyen
Klinische Abteilung für Kardiologie
Universitätsklinik für Innere Medizin und Universitäres Herzzentrum
Medizinische Universität Graz
E-mail: nicolas.verheyen@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La cardiomyopathie hypertrophique (CMH) d’origine sarcomérique touche jusqu’à 0,6% de la population normale et est nettement sous-diagnostiquée. La présence de CMH avec dyspnée d’effort ou syncopes doit évoquer chez les patient·es atteint·es de CMH une obstruction de la chambre de chasse du ventricule gauche («left ventricular outflow tract obstruction», LVOTO). Le diagnostic n’est souvent possible que par des manœuvres de provocation pendant l’échocardiographie. Outre les méthodes thérapeutiques établies comme l’ablation septale à l’alcool ou la myectomie, nous pourrions bientôt disposer d’un nouveau principe actif, le mavacamten, dans le traitement de la LVOTO.
Keypoints
-
En cas de suspicion de CMH, il convient de réaliser un arbre généalogique.
-
L’IRM cardiaque est essentielle pour confirmer le diagnostic et établir un pronostic.
-
En présence de dyspnée d’effort et de syncope, il est recommandé de rechercher une obstruction de la voie d’éjection.
-
La myectomie et l’ablation septale à l’alcool sont sûres et efficaces entre des mains expérimentées.
-
L’intérêt du mavacamten, inhibiteur de la myosine, dont les données sont prometteuses pour le traitement de l’obstruction de la voie efférente, n’est pas encore clair sur le plan clinique.
Diagnostic de la CMH
La CMH est une maladie génétique à transmission autosomique dominante. Elle affecte le muscle cardiaque de manière isolée et entraîne une hypertrophie et une fibrose myocardiques. L’évolution de la maladie peut être considérablement hétérogène d’une personne à l’autre, même en présence d’une mutation identique, le spectre allant d’une évolution asymptomatique tout au long de la vie à une insuffisance cardiaque terminale à l’enfance.
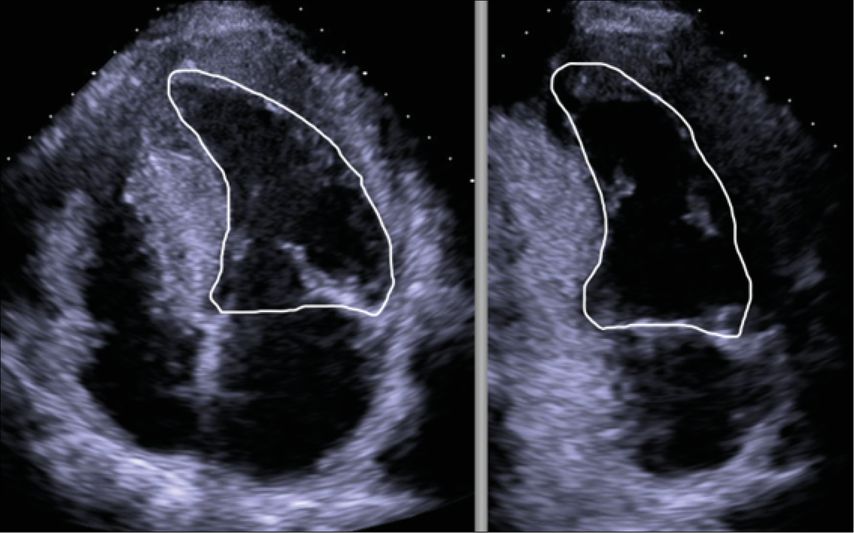
La CMH manifeste est unanimement définie au niveau international comme une hypertrophie ventriculaire gauche qui n’est pas expliquée par les conditions de charge, avec une épaisseur de paroi d’au moins 15 mm dans au moins un segment myocardique.1,2 S’il est établi qu’une mutation sarcomérique est responsable de la maladie, soit chez le patient index, soit dans la famille, la valeur seuil est de 13mm. Au plus tard en présence d’une épaisseur de paroi d’au moins 17mm, une CMH doit être envisagée chez les patients hypertendus. L’épaisseur de paroi peut être mesurée par échocardiographie, tomodensitométrie (TDM) ou imagerie par résonance magnétique (IRM). Pour exclure d’autres cardiomyopathies susceptibles de «phénocopier» une CMH d’origine sarcomérique (p.ex. amylose cardiaque ou cardiomyopathie hypertensive), il convient de réaliser au minimum un arbre généalogique systématique, une IRM cardiaque et une analyse génétique en plus du diagnostic cardiologique de base. Les panels de CMH courants comprennent au minimum les 8 gènes sarcomériques recommandés (dont les plus importants, MYBPC3 et MYH7) ainsi que TTR et GLA afin d’exclure une amylose héréditaire à transthyrétine et une maladie de Fabry. Ce panel diagnostique est associé à un taux de réussite très élevé (30–60%) par rapport à d’autres panels de cardiomyopathie (p.ex. pour la cardiomyopathie dilatée) pour ce qui est d’une mutation responsable de la maladie. Parmi les autres «red flags» pour la CMH, on note l’hypertrophie septale régionale, le phénotype de «reverse curve» (Fig. 1) et des antécédents familiaux positifs de CMH ou de mort subite d’origine cardiaque. En présence d’un phénotype hypertrophique, une CMH d’origine sarcomérique est probable et une analyse génétique est particulièrement utile. L’IRM cardiaque joue souvent un rôle décisif dans l’établissement du diagnostic et du pronostic, d’une part parce que l’hypertrophie régionale peut être mesurée plus précisément qu’avec une échocardiographie et d’autre part parce qu’elle permet d’identifier et de quantifier les zones de fibrose. La CMH se caractérise par une fibrose spécifique dans les points d’insertion ventriculaires ou par des zones d’hypertrophie prononcée. Ainsi, l’IRM cardiaque est également idéale pour distinguer les diagnostics différentiels fréquents, comme le syndrome du cœur d’athlète ou les cardiomyopathies de surcharge, sans fibrose ou associées à d’autres types de fibrose.
Fig. 1: Phénotype de «reverse curve». Prédominance d’une convexité médio-septale inférieure de la paroi myocardique en direction de la cavité ventriculaire gauche, ce qui lui donne une forme pointue ou en demi-lune3
Complications
Il existe essentiellement trois complications fréquentes de la CMH. Parallèlement à l’apparition d’une insuffisance cardiaque structurelle «classique», il existe un risque accru d’arythmies supraventriculaires et ventriculaires pouvant entraîner jusqu’à la mort subite, ainsi que de LVOTO. Le risque individuel de mort subite d’origine cardiaque à 5 ans peut être évalué à l’aide du calculateur de risque de l’ESC, qui tient compte de l’âge, des paramètres échocardiographiques, ainsi que des antécédents médicaux et familiaux. En présence d’un risque calculé de 6% ou plus, l’implantation d’un DAI en prévention primaire est recommandée (classe IIA). Dans la zone grise entre 4% et 6%, il s’agit d’une indication de classe IIB, et la quantification de la fibrose à l’IRM cardiaque peut apporter une contribution significative dans le processus décisionnel.
La LVOTO concerne les deux tiers environ des patient·es atteint·es de CMH envoyé·es vers des centres tertiaires, mais le nombre réel de cas est probablement plus élevé. Une LVOTO se définit comme une obstruction sous-valvulaire, associée à un mouvement systolique antérieur («systolic anterior motion», SAM) de la valve mitrale et à un gradient maximal mesuré entre le ventricule gauche et l’aorte ascendante d’au moins 30mmHg. Le gradient est mesuré par échocardiographie au moyen d’un Doppler à onde continue (CW). Les principaux symptômes sont la dyspnée d’effort et les (pré)syncopes liées à l’effort. À l’auscultation, on observe un souffle systolique au-dessus du foyer d’Erb, qui augmente avec la manœuvre de Valsalva. La LVOTO est un phénomène dynamique qui résulte généralement d’une interaction entre l’hypertrophie septale, une contractilité ventriculaire hyperdynamique et l’allongement du voile mitral au fil du temps (Fig. 2). Des anomalies de l’appareil de soutien de la valve mitrale, comme la dislocation apicale du muscle papillaire, sont également associées à la LVOTO. En dehors des facteurs cardiaques, la précharge et la postcharge jouent un rôle essentiel. La LVOTO et les troubles correspondants sont aggravés par des circonstances qui diminuent la précharge ou la postcharge, p.ex. les efforts brusques comme dans certains sports ou activités quotidiennes, la déshydratation (transpiration, consommation d’alcool, diarrhée) ou l’hypotension postprandiale. Certains médicaments, comme la nitroglycérine (contre-indiquée en cas de LVOTO), les inhibiteurs de l’ECA, les sartans, les diurétiques et les bêtabloquants vasodilatateurs, peuvent également entraîner une aggravation significative.
Fig. 2: Évolution temporelle de l’obstruction de la chambre de chasse du ventricule gauche (LVOTO) dans la cardiomyopathie hypertrophique. Du début au milieu de la systole, le voile mitral, généralement allongé, est poussé dans une position oblique par rapport à la voie efférente (poussée hydrodynamique). Dans le contexte d’une fonction ventriculaire hyperdynamique, il existe un effet Venturi entre le milieu et la fin de la systole, dans lequel des vecteurs de flux différents au-dessus et en dessous du voile mitral créent une aspiration sur le voile mitral en direction de la voie efférente du ventricule gauche. Cela provoque le déplacement visible du voile mitral vers le septum et rétrécit la voie efférente du ventricule gauche, phénomène également appelé mouvement systolique antérieur (SAM). En conséquence, le gradient intraventriculaire gauche augmente au cours de la systole (signal de flux caractéristique en poignard [«dagger-shaped»]). L’augmentation du gradient peut être provoquée par des manœuvres de provocation, comme la manœuvre de Valsalva, le fait de se lever rapidement d’une position accroupie ou une échocardiographie de stress
La possibilité d’influencer la LVOTO par les facteurs externes décrits ci-dessus permet aux patient·es de s’adapter à la maladie dans leur vie quotidienne, p.ex. en mangeant plutôt de petites quantités, en évitant les efforts physiques et en s’hydratant suffisamment. Beaucoup adaptent (inconsciemment) leur mode de vie aux «besoins» de la LVOTO de sorte qu’ils ne se rendent souvent pas compte de l’ampleur réelle de leur limitation. Il est probable que du fait de cette adaptation, les taux de NT-proBNP sont souvent légèrement élevés seulement, voire normaux, en présence d’une LVOTO significative. En raison de la dynamique de la LVOTO, les manœuvres de provocation pendant l’échocardiographie revêtent une importance particulière et permettent de réduire soit la précharge (manœuvres de Valsalva), soit la postcharge (ergométrie et mesure du gradient immédiatement après un effort maximal, mesure du gradient immédiatement après un lever rapide). La mesure du gradient dans le battement post-extrasystolique peut également être utile. Pour le diagnostic de la LVOTO, le gradient maximal mesuré est utilisé.
Activité sportive en cas de CMH
La CMH est une cause fréquente de mort subite d’origine cardiaque chez les athlètes de compétition. Toutefois, les directives européennes actuelles en matière de cardiologie du sport ont relativisé la théorie courante depuis des décennies selon laquelle le sport de compétition serait généralement déconseillé aux patient·es atteint·es de CMH.4 Sur la base de données probantes désormais plus claires, le sport de compétition n’est plus déconseillé qu’aux patient·es atteint·es de CMH qui présentent des facteurs de risque. Ces facteurs de risque incluent la présence d’une insuffisance cardiaque, la survie à une mort subite d’origine cardiaque, une syncope inexpliquée, un risque calculé de mort subite cardiaque à 5ans ≥4%, un gradient intraventriculaire gauche ≥30mmHg et des arythmies d’effort ou une chute de pression artérielle à l’effort.
Traitement
Le traitement repose en première ligne sur l’optimisation médicamenteuse, suivie d’un traitement invasif si une LVOTO symptomatique persiste avec un gradient maximal ≥50mmHg (Fig. 3). Les bêtabloquants cardiosélectifs constituent le premier choix, suivis du vérapamil ou du diltiazem. Les deux médicaments ne doivent être combinés que dans des cas particuliers. La première étude randomisée et contrôlée sur les bêtabloquants dans la CMH, qui date de 2021 (!), a démontré que le métoprolol permettait de réduire le gradient intraventriculaire gauche d’environ 30mmHg en moyenne, ce qui est toutefois insuffisant pour contrôler les symptômes chez un très grand nombre de patient·es.5 Si une LVOTO symptomatique persiste malgré le traitement médicamenteux, il existe des traitements invasifs de réduction septale (TRS) établis, comme la réduction septale non chirurgicale (RSNC) par instillation d’alcool et la myectomie cardio-chirurgicale. Les deux types d’intervention sont efficaces si les patient·es sont correctement sélectionné·es et permettent généralement une réduction significative, voire l’élimination de la LVOTO. En ce qui concerne le risque péri-procédural, il convient de mentionner en particulier le risque de bloc AV nécessitant la pose d’un stimulateur cardiaque (risque à 30 jours de 10% dans le cas de la RSNC et de 5% dans le cas de la myectomie).
Fig. 3: Schéma thérapeutique en cas de cardiomyopathie hypertrophique avec obstruction de la chambre de chasse du ventricule gauche (LVOTO) (d’après Ommen et al., 2020)1
Perspective: mavacamten
L’arrivée sur le marché du mavacamten permettrait une avancée considérable dans le traitement médicamenteux. Le mavacamten, un inhibiteur sélectif de la myosine cardiaque, a un effet inotrope négatif chez les patient·es atteint·es de CMH et de LVOTO et réduit le gradient intraventriculaire gauche en plus du traitement par bêtabloquants. Dans l’étude randomisée et contrôlée EXPLORER-HCM, le mavacamten a également montré une amélioration de la consommation maximale d’oxygène (VO2max) au test de spiroergométrie de 1,4ml/kg/min après 30 semaines, ce qui peut être considéré comme cliniquement pertinent.6 Dans une autre étude, plus de 80% des patient·es présentant une LVOTO et ayant une indication de TRS n’avaient plus d’indication de TRS après 16 semaines de traitement par le mavacamten.7 Les effets à long terme et surtout les coûts du traitement ne sont pas encore connus.
Littérature:
1 Ommen SR et al.: Circulation 2020; 142: e558-e631 2 Elliott PM et al.: Eur Heart J 2014; 35: 2733-79 3 Binder J et al.: Mayo Clin Proc 2006; 81: 459-67 4 Pelliccia A et al.: Eur Heart J 2021; 42: 17-96 5 Dybro AM et al.: J Am Coll Cardiol 2021; 78: 2505-17 6 Olivotto I et al.: Lancet 2020; 396: 759-69 7 Desai MY et al.: J Am Coll Cardiol 2022; 80: 95-108
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...