Nouvelle norme dans le MM récemment diagnostiqué, nouvelle stratégie dans la GVH, test IDH1 pour la LMA
Compte-rendu:
Dre Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Il va sans dire que les données révolutionnaires de l’étude PERSEUS sur le daratumumab-VRd chez les patient·es admissibles à une greffe ont constitué l’un des points forts du congrès de l’ASH sur le myélome multiple. De nombreuses autres données intéressantes ont également été présentées, notamment sur la maladie du greffon contre l’hôte et la leucémie myéloïde aiguë. Vous trouverez un extrait dans l’article suivant.
Myélome multiple
Daratumumab-VRd, nouvelle norme pour l’admissibilité à la greffe
Malgré l’existence de nombreux nouveaux schémas thérapeutiques, le myélome multiple (MM) reste une maladie incurable. Les patient·es plus jeunes reçoivent une transplantation autologue de cellules souches après un traitement d’induction par bortézomib, lénalidomide et dexaméthasone (VRd), ainsi qu’un traitement de consolidation par VRd après la transplantation de cellules souches, suivi d’un traitement d’entretien par lénalidomide (R). L’étude de phaseIII PERSEUS évaluait si l’ajout de daratumumab (D) par voie sous-cutanée à toutes les phases du traitement pouvait améliorer le pronostic des patient·es.1
Au total, 709patient·es atteint·es d’un myélome multiple récemment diagnostiqué et admissibles à une transplantation ont été réparti·es aléatoirement pour recevoir un traitement d’induction de 4cycles de D-VRd versus VRd, suivi d’une transplantation et d’un traitement de consolidation de 2cycles de D-VRd versus VRd, suivi d’un traitement d’entretien par D-R versus R. Le traitement d’entretien dans le bras daratumumab pouvait être arrêté après une rémission complète (RC) de ≥24mois et une maladie résiduelle mesurable (MRM) négative pendant 12mois, puis repris en cas de perte de la RC. Chez les patient·es présentant une MRM positive, D-R, versus R dans le bras témoin, a été administré jusqu’à la progression de la maladie. Le critère d’évaluation principal de l’étude était la survie sans progression (PFS).
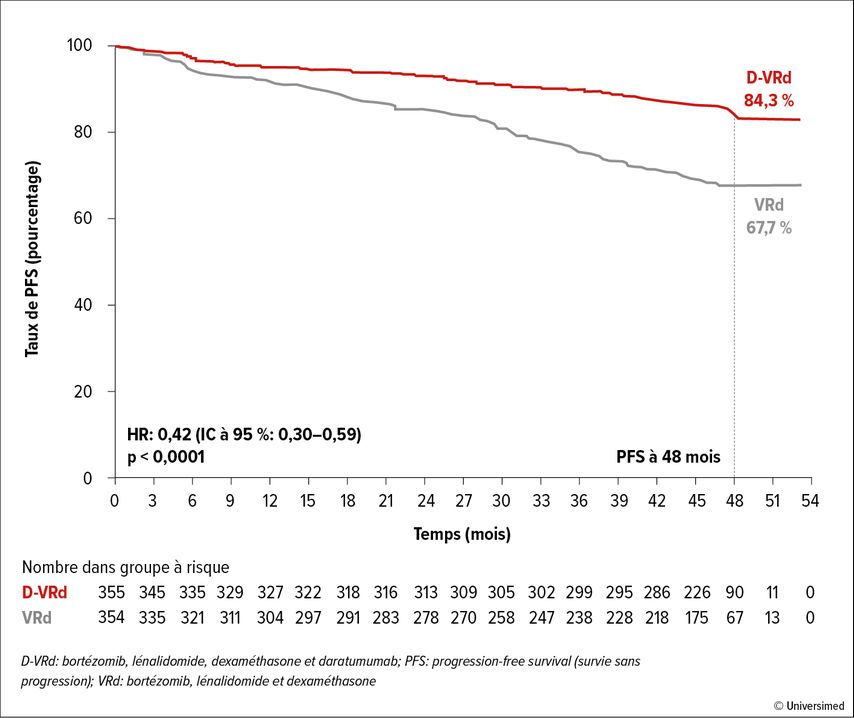
Après un suivi médian de 47,5mois, la PFS médiane n’avait pas encore été atteinte dans les deux bras de l’étude. Le taux de PFS à48 mois était de 84,3% versus 67,7% (Fig. 1). Le risque de progression ou de décès a été réduit de 58% avec l’ajout du daratumumab (HR: 0,42; IC à 95%: 0,30–0,59; p<0,0001). L’avantage en termes de PFS a été confirmé dans des analyses de sous-groupes pour toutes les cohortes de patient·es cliniquement pertinentes examinées. Au moins une rémission complète (RC/RCs) a été obtenue chez 87,9% des patient·es avec le daratumumab versus 70,1%sans daratumumab (p<0,0001). Une MRM négative avec une sensibilité de 10-5 a été rapportée chez 75,2% versus 47,5% et avec une sensibilité de 10-6 chez 65,1% versus 32,2% des patient·es. Une MRM négative durable (10-5) sur ≥12mois a été obtenue chez 64,8% versus 29,7% des patient·es, et 64% ont arrêté le traitement comme prévu par le protocole.
Fig.1: Étude PERSEUS, PFS sous D-VRd vs VRd chez les patient·es atteint·es de myélome multiple récemment diagnostiqué admissibles à une transplantation de cellules souches. Modifié d’après Sonneveld P et al.1
Selon les résultats de l’étude randomisée de phaseIII PERSEUS, le D-VRd en traitement d’induction et de consolidation, suivi du D-R en traitement d’entretien, devrait être la nouvelle norme thérapeutique pour les patient·es atteint·es de myélome multiple récemment diagnostiqué et admissibles à une greffe, ont résumé les auteurs·rices.
MRM durablement négative sous schéma KRd
Des patient·es atteint·es de myélome multiple récemment diagnostiqué non admissibles à une transplantation autologue de cellules souches ont reçu du lénalidomide et de la dexaméthasone (Rd) ou du bortézomib, du melphalan et de la prednisone (VMP) de manière standard en 2018, lors du lancement de l’étude EMN20. Afin d’optimiser le traitement, l’étude de phaseIII a évalué le carfilzomib (56mg/m2 une fois par semaine) en plus du Rd (KRd) chez des patient·es avec un bon niveau de forme ou un niveau de forme intermédiaire.2Pour l’étude EMN20, ayant été arrêtée prématurément en raison de l’introduction du daratumumab plus Rd en première ligne, seulement 82patient·es ont pu être recruté·es au total. Sur les participants, 42 ont reçu le schéma KRd et, en fonction de la MRM (sensibilité de 10-5), Rd (MRM négative) ou KRd (MRM positive) jusqu’à la progression de la maladie. Dans le bras de contrôle, 40participants ont reçu Rd jusqu’à la progression de la maladie. Les critères d’évaluation principaux de l’étude étaient le taux de MRM après deux ans de traitement et la PFS.
Les patient·es inclus·es avaient un âge médian de 73–74ans et présentaient un risque élevé (ISS III) dans 30–33% des cas et un risque cytogénétique élevé dans 22% des cas. Au final, une réponse ≥RC (au moins une rémission complète) a été relevée chez 52% des patient·es dans le bras KRd et chez 5% dans le bras Rd (p=0,0002). Une MRM négative a été observée chez 50% des patient·es versus 0% à 1an, chez 60% des patient·es versus 0% à 2ans et chez 40% des patient·es versus 0% aux deux dates d’évaluation. Cela s’est répercuté sur la PFS, avec un taux de PFS à 2ans de 81% versus 48%. Au suivi médian, la PFS médiane n’avait pas été atteinte dans le bras KRd et était de 20,9mois dans le bras contrôle. En ce qui concerne la sécurité, les réductions de dose ont été plus fréquentes dans le bras KRd, comme on pouvait s’y attendre. Les interruptions de traitement étaient comparables, avec 12% (KRd) et 15% (Rd).
En résumé, le schéma KRd (suivi de Rd) a permis d’atteindre des taux de MRM négative étonnamment élevés. La réponse s’est approfondie au cours du traitement et a été associée à un retard de la progression de la maladie. L’efficacité a été observée indépendamment de l’âge ou du risque cytogénétique, ce qui renforce l’utilisation d’une trithérapie efficace pour cette catégorie de patient·es.
L’évaluation gériatrique aide à choisir un traitement
L’étude de phaseIII à trois bras GEM2017FIT évaluait le traitement d’induction par 9cycles de VMP suivis de 9cycles de Rd versus 18cycles de KRd ou de daratumumab plus KRd (DaraKRd) chez des patient·es atteint·es de myélome multiple récemment diagnostiqué âgé·es de 80ans ou moins.3 Dans les bras de traitement sans daratumumab pendant la phase d’induction, les patient·es ont reçu un traitement de consolidation par 4cycles de DaraRd. Au cours de la phase d’entretien, les patient·es ayant une MRM négative et ceux·celles ayant une MRM positive ont été traité·es par daratumumab plus lénalidomide ou mis en observation. Le critère d’évaluation principal de l’étude était le taux de MRM négative après 18cycles, les critères d’évaluation secondaires étaient le taux de MRM négative après le traitement de consolidation ainsi que le statut de MRM pendant la phase d’entretien, la PFS, la survie globale (OS) et le profil de sécurité. L’état physique des patient·es a été déterminé sur la base de l’âge chronologique (≤80ans) et d’un questionnaire d’hématologie gériatrique (GAH; 0–94 points, un score plus faible étant plus avantageux).
Au total, 462patient·es ont été réparti·es aléatoirement dans l’un des trois bras de l’étude sur le traitement d’induction. L’âge médian des patient·es était de 72-73ans et 33-35% avaient 75ans ou plus. Le score GAH moyen se situait entre 18,25 et 19,35points. Au final, KRd (OR=2,68; p<0,0005) et DaraKRd (OR=0,395; p<0,0005) ont montré une probabilité plus élevée de MRM négative, avec une sensibilitéde10-5, après 18cycles d’induction par rapport à VMP-Rd. Les taux de MRM négative étaient de 75% (KRd) vs 84% (DaraKRd) vs 33% (VMP-Rd) avec une sensibilité de 10-5, et de 66% vs 79% vs 25% avec une sensibilité de 10-6. Une réponse a été observée chez 82% vs 88% vs 77% des patient·es, avec au moins une réponse complète chez 58% vs 61% vs 38%. Avec un suivi médian de 33mois, le taux de PFS à 30mois était de 83% vs 79% vs 73%. Le risque de progression a été réduit de 42% (HR=0,58; IC à 95%: 0,38–0,88; p=0,01) par rapport à KRd et de 43% (HR=0,57; IC à 95%: 0,37–0,89; p=0,01) par rapport à DaraKRd et VMP-Rd. Les patient·es qui ont arrêté le traitement au cours des 18cycles d’induction l’ont fait le plus souvent en raison d’une toxicité dans le bras KRd, d’une toxicité létale dans le bras DaraKRd et d’une progression de la maladie dans le bras VMP-Rd.
Une évaluation de sous-groupe concernant l’état général gériatrique a montré des taux de PFS à 30 mois de 76% (KRd) vs 88% (DaraKRd) vs 80% (VMP-Rd) chez les patient·es ayant un score GAH <20 et de 91% vs 71% vs 65% chez les patient·es ayant un score GAH >20.
Les auteurs·rices ont conclu que le score GAH permettrait de mieux prédire la probabilité de toxicité et de mortalité et pourrait ainsi aider à choisir entre un schéma thérapeutique par KRd ou par DaraKRd.
Maladie du greffon contre l’hôte: efficacité élevée et durable de l’axatilimab
La maladie chronique du greffon contre l’hôte est une complication hétérogène à médiation immunitaire de la transplantation allogénique de cellules souches et la principale cause de morbidité tardive. Il existe un grand besoin de nouveaux traitements qui soient bien tolérés et qui agissent rapidement et durablement. Le CSF-1R est une nouvelle approche de traitement ciblé, puisque les monocytes et les macrophages contrôlent l’inflammation et la fibrose dépendant du CSF-1R. L’axatilimab a été étudié à trois doses différentes (0,3mg/kg, q2w, 1,0mg/kg, q2w, et 3,0mg/kg, q4w) chez des patient·es présentant une maladie chronique du greffon contre l’hôte dans l’étude de phaseII AGAVE-201.4
L’étude AGAVE-201 portait sur 241patient·es âgé·es de 2ans et plus, ayant reçu ≥2 lignes de traitement systémique antérieures et présentant une maladie chronique du greffon contre l’hôte active. L’utilisation simultanée de corticostéroïdes, d’inhibiteurs de la calcineurine ou de mTOR était autorisée. Le critère d’évaluation principal était la réponse (ORR) au cours des 6 premiers cycles.
L’âge médian des patient·es était de 53ans et le diagnostic de maladie chronique du greffon contre l’hôte avait été posé en moyenne 4ans avant l’inclusion dans l’étude. Chez 54% des patient·es, ≥4organes étaient touchés. En moyenne, les patient·es avaient déjà reçu 4traitements systémiques antérieurs, dont le ruxolitinib (74%), l’ibrutinib (31%) et le bélumosudil (23%).
Le critère d’évaluation principal a été atteint avec l’axatilimab aux trois doses. L’ORR était de 74% (IC à 95%: 63–83) dans la cohorte recevant la dose de 0,1mg/kg, de 67% (IC à 95%: 55–77) avec la dose de 1,0mg/kg et de 50% avec la dose de 3,0mg/kg. Le temps de réponse médian était respectivement de 1,7, 1,9 et 1,4mois. La réponse a duré ≥12mois chez 60%, 60% et 53% des patient·es, respectivement. Les meilleurs taux de réponse ont été obtenus à la dose de 0,3mg/kg pour les organes dominés par la fibrose, y compris l’œsophage (78%), les articulations et les fascias (76%), les poumons (47%) et la peau (27%). La survie sans échec médiane (FFS) était de 17,3mois (IC à 95%: 14,2 à non atteint). Selon l’estimation des patient·es, 55% d’entre eux·elles ont bénéficié d’une amélioration cliniquement significative (≥7points) selon le score à l’échelle des symptômes de Lee modifiée (mLSS). L’amélioration s’est produite dans un délai médian de 1,5mois. Parmi les patient·es, 73% ont vu leur score cutané mLSS s’améliorer. Le profil de sécurité était également le plus avantageux avec la dose de 0,3mg/kg.
Les auteurs·rices ont conclu que l’axatilimab s’était révélé très efficace à la plus faible dose testée (0,3mg/kg, q2w). La qualité de vie a pu être significativement améliorée en ce qui concerne le fardeau des symptômes. Les effets secondaires étaient généralement de faible intensité et réversibles avec la faible dose. L’axatilimab pourrait donc représenter une nouvelle stratégie thérapeutique pour les patient·es atteint·es de maladie chronique du greffon contre l’hôte.
LMA: Le dépistage précoce de la mutation IDH1 permet une thérapie ciblée
La leucémie myéloïde aiguë (LMA) touche souvent des adultes âgés, dont environ la moitié ne sont pas admissibles à un traitement d’induction intensif standard. Environ 6 à 16% des patient·es chez qui une LMA a été diagnostiquée sont porteurs d’une mutation IDH1. Dans ce groupe, un traitement par ivosidénib plus substance hypométhylante (HMA) ou vénétoclax plus HMA est possible. Afin de mieux comprendre les schémas thérapeutiques, l’efficacité et la sécurité des traitements de première ligne, une grande étude en situation réelle a été lancée aux États-Unis. Les données de 283patient·es atteint·es de LMA récemment diagnostiquée ont pu être évaluées, dont 182 ont été traité·es par ivosidenib et 101, par vénétoclax, dans les deux cas en association avec l’HMA.5 Le délai pour le test de mutation IDH1 était de 7jours en moyenne, le délai entre le diagnostic et le début du traitement était de 14jours en moyenne pour l’ivosidénib plus HMA versus 20jours pour le vénétoclax plus HMA.
Au final, une réponse complète a été plus souvent obtenue avec le traitement par ivosidénib (RC: 42,9% vs 26,7%; p=0,007; RC+RCi/p: 63,2% vs 49,5%; p=0,025). Le délai médian avant la meilleure réponse était de 3,3mois pour le schéma à base d’ivosidénib et de 4,1mois pour le schéma à base de vénétoclax (p=0,02). Le traitement a permis la transition à une transplantation allogénique chez 11,5% versus 5,0% des patient·es (p=0,066). Après 6mois, 56,0% versus 39,6% des patient·es ne présentaient pas d’événements (HR: 0,773; p=0,044). L’incidence des effets indésirables de grade ≥3 spécifiés était comparable dans les 30jours, à l’exception de la neutropénie fébrile, plus fréquente sous vénétoclax (7,9% vs 1,6%; p=0,009).
L’efficacité du vénétoclax plus HMA pourrait avoir été influencée par des modifications de la dose. 41,6% des patient·es ont reçu le vénétoclax ≤7jours par cycle de 28jours, alors que seuls 22,8% des patient·es ont reçu les 28jours recommandés dans l’autorisation de mise sur le marché de la FDA.
Les auteurs·rices ont conclu que les soignants devraient effectuer un test de mutation précoce afin de s’assurer qu’un traitement par ivosidénib plus HMA peut être envisagé pour les patient·es atteint·es de LMA récemment diagnostiquée avec mutation IDH1.
Source:
65e congrès annuel de l’American Society of Hematology, 9-12 décembre 2023, San Diego, Californie, et en ligne
Littérature:
1 Sonneveld P et al.: Phase 3 randomized study of daratumumab (DARA) + bortezomib, lenalidomide, and dexamethasone (VRd) versus VRd alone in patients with newly diagnosed multiple myeloma (NDMM) who are eligible for autologous stem cell transplantation (ASCT): Primary results of the PERSEUS trial. ASH 2023; Abstr. #LBA-1 2 Bringhen S et al.: Carfilzomib-lenalidomide-dexamethasone (KRd) vs. lenalidomide-dexamethasone (Rd) in newly diagnosed fit or intermediate-fit multiple myeloma patients not eligible for autologous stem-cell transplantation (phase III EMN20 trial): Analysis of sustained undetectable minimal residual disease (MRD). ASH 2023; Abstr. #205 3 Mateos MV et al.: GEM2017FIT Trial: Induction therapy with bortezomib-melphalan and prednisone (VMP) followed by lenalidomide and dexamethasone (Rd) versus carfilzomib, lenalidomide and dexamethasone (KRd) plus/minus daratumumab (D), 18 cycles, followed by consolidation and maintenance therapy with lenalidomide and daratumumab: Phase III, multicenter, randomized trial for elderly fit newly diagnosed multiple myeloma (NDMM) patients aged between 65 and 80 years. ASH 2023; Abstr. #209 4 Wolff D et al.: Safety and efficacy of axatilimab at 3 different doses in patients with chronic graft-versus-host disease (AGAVE-201). ASH 2023; Abstr. #1 5 Smith BD et al.: A comparison of acute myeloid leukemia (AML) regimens: Hypomethylating agents combined with ivosidenib or venetoclax in newly diagnosed patients with IDH1 mutations: A real-world evidence study. ASH 2023; Abstr. #971
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...