«Palliative Care» et «End-of-Life Care»
Auteur·es:
PD Dre méd. Caroline Hertler
Stv. Ärztliche Leitung Kompetenzzentrum Palliative Care, Klinik für Radio-Onkologie, Universitätsspital Zürich
Hassan Naim
Oberarzt I.V., Kompetenzzentrum Palliative Care, Klinik für Radio-Onkologie, Universitätsspital Zürich
Correspondance:
E-mail: caroline.hertler@usz.ch
Les gliomes de haut grade se caractérisent par une évolution rapide et souvent agressive de la maladie. En raison de leur mortalité, ils constituent d’emblée une maladie palliative. Ils réunissent une maladie oncologique et une maladie neurologique, auxquelles les personnes concernées, leurs proches et les médecins doivent faire face. L’apparition précoce de déficits neurologiques telsque les déficits neurocognitifs, les aphasies et les symptômes neuropsychiatriques constitue un défi majeur pour la trajectoire de la maladie et la planification anticipée. Par conséquent, il faudrait initier le dialogue sur les souhaits très tôt et le poursuivre jusqu’à la fin de la vie. Une intégration précoce des soins palliatifs est donc particulièrement pertinente.
Keypoints
-
Les tumeurs cérébrales représentent un défi particulier, car il s’agit d’une maladie duale avec des symptômes oncologiques et neurologiques.
-
Les symptômes neurocognitifs et neuropsychiatriques précoces rendent la communication ainsi que le dialogue difficiles pour la planification anticipée.
-
La charge symptomatique complexe augmente au cours de la dernière phase de la vie et pèse sur les patient·es tout comme leurs proches.
-
Une intégration précoce des «Palliative Care» en tant que «Concurrent Care» est recommandée.
Les gliomes sont des tumeurs cérébrales primaires qui, en fonction de leur degré de malignité, sont classées des stades 1 à 4 selon la classification de l’OMS. Les gliomes de haut grade en particulier (glioblastomes) sont considérés comme incurables et s’accompagnent en outre d’une survie réduite de douze mois en moyenne à compter du diagnostic. En plus du traitement multimodal établi comprenant la chirurgie, la radiothérapie et la chimiothérapie, de nombreuses nouvelles approches expérimentales ont été développées ces dernières années afin de prolonger la survie globale des personnes atteintes, mais il n’existe aucun traitement curatif à ce jour.1,2
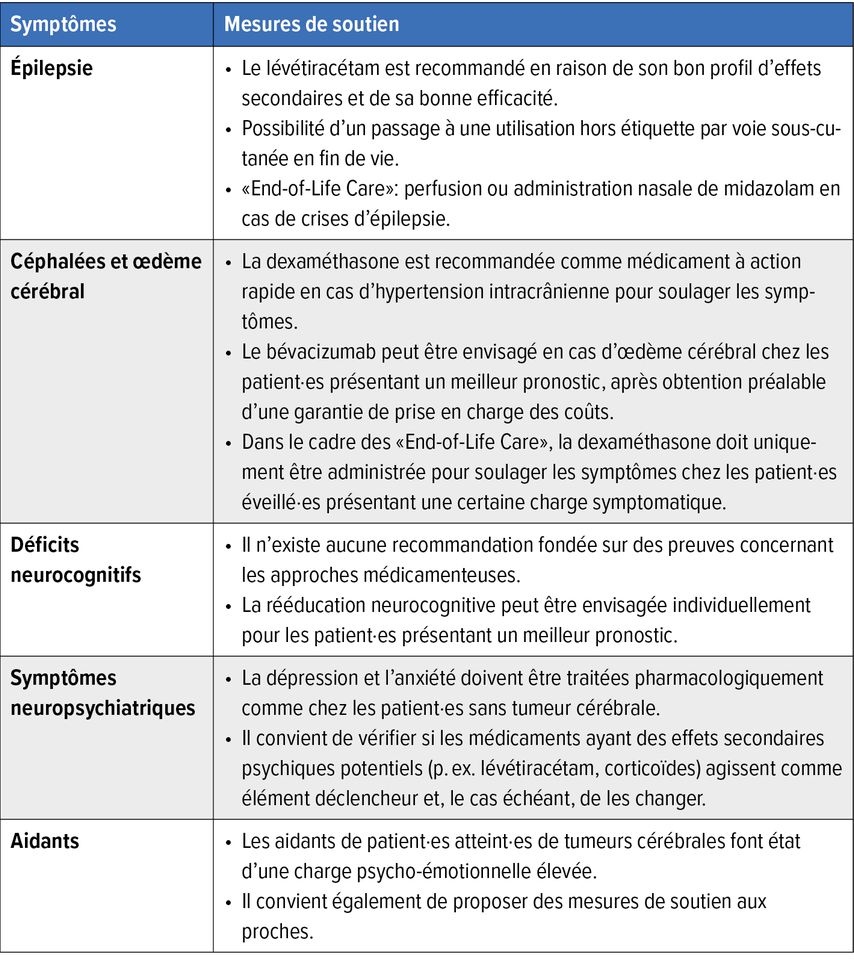
Outre l’évolution oncologique rapide, la morbidité élevée, surtout dans la dernière phase de la vie, représente une charge importante pour les personnes concernées et leurs proches.3 En plus des symptômes oncologiques généraux tels que la fatigue et le stress psychologique, les patient·es atteint·es de tumeurs cérébrales souffrent de symptômes neurologiques tels que des céphalées, des crises d’épilepsie et des déficits neurocognitifs (Tab. 1).4,5
Tab.1: Mesures de soutien de «Palliative Care» et d’«End-of-Life Care» pour les tumeurs cérébrales (modifié selon Koekkoek JAF et al.)10
Concepts de «Palliative Care» etd’«End-of-Life Care»
«Early Palliative Care»
Alors que les approches de «Palliative Care» sont issues du mouvement des hospices et des «End-of-Life Care», cette discipline est aujourd’hui établie en tant que mesure d’accompagnement et de soutien, y compris dans les phases précoces des maladies incurables ou des maladies aiguës engageant le pronostic vital. L’objectif de l’accompagnement palliatif parallèle, défini par l’American Society of Clinical Oncology (ASCO) en tant que «Concurrent Care»,6 est de soulager les symptômes dans les quatre dimensions suivantes: physique, psychique, sociale et spirituelle. Plusieurs grandes études oncologiques ont pu montrer une amélioration de la qualité de vie sans réduction de la survie globale grâce à l’intégration précoce des «Palliative Care» parallèlement aux thérapies ciblées sur la tumeur.7
Entre-temps, l’ASCO recommande d’inclure les «Palliative Care» dans le traitement dans les huit semaines suivant le diagnostic d’une maladie avancée.8 Cette recommandation a également été reprise par les sociétés de neuro-oncologie. L’European Association of Neuro-Oncology (EANO) a élaboré une directive spécifique aux tumeurs cérébrales sur le traitement palliatif et de soutien, qui souligne les défis particuliers de ce cancer à l’intersection de l’oncologie et de la neurologie.9,10 Dans ce contexte, la complexité de la planification anticipée chez les patient·es atteint·es de gliomes a été mise en évidence.
Advanced Care Planning (ACP)
La planification anticipée (ACP) permet aux personnes concernées de définir les objectifs thérapeutiques et les souhaits de traitement ainsi que ses limites, y compris la décision de réanimation. Des représentants thérapeutiques en cas d’incapacité de discernement sont également définis. Les proches doivent, dans la mesure du possible, être impliqués dans ces discussions. Les directives oncologiques recommandent d’aborder le sujet au plus tard lorsque la survie attendue est inférieure à un an.8 Chez les patient·es atteint·es de tumeurs cérébrales, les déficits neurocognitifs, neuropsychiatriques et communicatifs précoces, tels que les troubles du langage et de la parole, rendent cependant la planification anticipée difficile peu après le diagnostic. Un protocole ACP spécifique au glioblastome a été développé pour permettre un dialogue précoce sur ces questions. Les personnes concernées et leurs proches ont indiqué que le moment optimal pour une ACP se situait après la première radiochimiothérapie (environ neuf mois après le diagnostic).11 Comme jusqu’à 50% des patient·es atteint·es de tumeurs cérébrales présentent une capacité de discernement altérée au cours de la maladie, il est également souhaitable d’aborder le sujet plus tôt. Les proches ont indiqué qu’ils auraient souhaité une discussion sur l’ACP dès le diagnostic.11 Cela souligne la nécessité d’impliquer les proches et de les tenir informés.
Symptômes spécifiques aux tumeurs cérébrales au début et à la fin de la vie
Épilepsie
Les crises d’épilepsie font partie des symptômes diagnostiques les plus fréquents, jusqu’à 50% dans les gliomes de haut grade et jusqu’à 80% dans ceux de bas grade.12 Pour le traitement des crises d’épilepsie chez les patient·es atteint·es de tumeurs cérébrales, on recommande en premier lieu des antiépileptiques récents, non inducteurs enzymatiques et présentant un bon profil d’effets secondaires, comme le lévétiracétam. En cas de symptômes neuropsychiatriques, on préfère le brivaracétam, qui est moins souvent associé à des effets secondaires psychiatriques.13 Dans le cadre des «End-of-Life Care» et en cas de diminution de la vigilance ou de dysphagie, le passage à une utilisation hors étiquette par voie sous-cutanée peut se faire sans difficulté. Dans la phase terminale, la perfusion de midazolam, utilisée pour réduire l’anxiété, remplace généralement l’antiépileptique. Il est déconseillé de suspendre le traitement antiépileptique.14
Hypertension intracrânienne
Les tumeurs cérébrales peuvent entraîner un œdème cérébral accompagné de céphalées, de nausées et de vomissements suite à la croissance intracrânienne.15 En situation aiguë, l’œdème cérébral est traité par des corticoïdes, principalement la dexaméthasone, à des doses de 4mg à 16mg sur une courte période. Chez les patient·es dont l’état de santé général est bon et dont on peut s’attendre à ce qu’ils·elles se stabilisent, un traitement par l’anticorps anti-angiogénique bévacizumab peut être envisagé pour contrôler les symptômes, ce qui permet d’éviter les corticoïdes sur une période prolongée.16 En phase terminale, il faut discuter de la suspension des traitements anti-œdémateux, en particulier chez les patient·es somnolent·es, afin d’éviter une prolongation des souffrances.
Déficits neurocognitifs
Les déficits neurocognitifs constituent une particularité des maladies neuro-oncologiques et représentent un défi particulier pour les personnes concernées, leurs proches et l’équipe soignante. D’une part, ils rendent la communication des besoins ainsi que des souhaits plus difficile et affectent la qualité de vie des personnes concernées. D’autre part, la planification du traitement et le dialogue avec l’équipe soignante s’en trouvent complexifiés. Parfois, jusqu’à 90% des patient·es atteint·es de tumeurs cérébrales présentent des déficits de l’attention, des troubles du langage ou de la mémoire dès la pose du diagnostic, qui progressent souvent au cours de la maladie.17 De plus, ces déficits ne peuvent pas être améliorés de manière significative, que ce soit par des mesures pharmacologiques ou non pharmacologiques.18,19
Symptômes neuropsychiatriques
Les changements de la personnalité dus aux tumeurs sont une autre particularité en neuro-oncologie. Des symptômes neuropsychiatriques sont observés chez 67% des patient·es atteint·es de gliome,5 des troubles psychoaffectifs, tels que la dépression et les troubles anxieux, sont rapportés par 25% des personnes concernées.20 En principe, le traitement est le même que celui des patient·es sans tumeur. Les médicaments utilisés sont par exemple les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ou, plus récemment, la kétamine, qui présentent une bonne efficacité chez les patient·es atteint·es de tumeurs cérébrales.21 Les symptômes neuropsychiatriques doivent être activement recherchés et les proches doivent idéalement être impliqués dans les discussions. Cela est particulièrement vrai en cas de comportement dangereux pour autrui sous forme d’agressions et d’épisodes psychotiques.22
Soutien des proches
Les proches (aidants) jouent un rôle important dans le soutien des personnes concernées et font partie intégrante du système de traitement.23 Ils sont très sollicités par leur double fonction d’accompagnateur de patient·es neuro-oncologiques: ils doivent traiter l’information du cancer et de l’espérance de vie réduite, et gérer les changements de la personnalité et les déficits neurologiques de la personne concernée. Les proches de patient·es atteint·es de tumeurs cérébrales font également état d’une charge psycho-émotionnelle élevée et d’un besoin important de mesures de soutien.24–26
Récapitulatif
Les personnes atteintes de tumeurs cérébrales souffrent d’une maladie à la fois neurologique et oncologique, et présentent par conséquent une charge symptomatique élevée. Dans ce contexte, les options de «Palliative Care» en tant que «Concurrent Care», offrent un soutien aux personnes concernées et à leurs familles pour optimiser leur qualité de vie au fur et à mesure de l’évolution de la maladie. Une implication précoce est très utile, notamment en ce qui concerne la planification anticipée chez les personnes atteintes d’une tumeur cérébrale.
Littérature:
1 Gramatzki D et al.: Cancer 2016; 122(14): 2206-15 2 Weller M et al.: Nat Rev Dis Primers 2024; 10(1): 33 3 Walbert T, Khan M: J Neurooncol 2014; 117(2): 217-24 4 Forst DA: Continuum (Minneap Minn) 2020; 26(6): 1673-85 5 Zwinkels H et al.: Neurooncol Pract 2016; 3(4): 222-31 6Smith CB et al.: Am Soc Clin Oncol Educ Book 2017; 37: 714-23 7 Temel JS et al.: N Engl J Med 2010; 363(8): 733-42 8 Ferrell BR et al.: J Clin Oncol 2017; 35(1): 96-112 9 Pace A et al.: Lancet Oncol 2017; 18(6): e330-40 10 Koekkoek JAF et al.: Neuro Oncol 2023; 25(3): 447-56 11 Fritz L et al.: Neurooncol Pract 2022; 9(6): 496-508 12 Jo J et al.: Neurooncol Pract 2021; 8(1): 40-7 13 van der Meer PB et al.: Epilepsia 2021; 62(5): 1119-29 14 Koekkoek JA et al.: Support Care Cancer 2016; 24(4): 1633-8 15 Zoccarato M et al.: Front Oncol 2021; 11: 617966 16 Khan M et al.: BMC Cancer 2021; 21(1): 167 17 Tucha O et al.: Neurosurgery 2000; 47(2): 324-33; discussion 33-4 18 Laigle-Donadey F et al.: Neurooncol Adv 2019; 1(1): vdz043 19 Gehring K et al.: Neuro Oncol 2020; 22(1): 103-15 20 van der Meer PB et al.: J Neurooncol 2021; 153(1): 89-98 21van der Meer PB et al.: Neurooncol Pract 2023; 10(4): 335-43 22Boele FW et al.: Neuropsychiatr Dis Treat 2015; 11: 1413-20 23 Bayen E et al.: Support Care Cancer 2017; 25(1): 245-53 24Long A et al.: Neurooncol Pract 2016; 3(2): 105-12 25 Reinert C et al.: J Neurooncol 2018; 138(2): 407-15 26 Hertler C et al.: J Neurooncol 2020; 147(3): 663-9
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...