Prise en charge des patientes et des patients présentant une maladie de reflux et un œsophage de Barrett
Auteur:
Dr méd. Matthias Sauter
Leiter Gastroenterologie
Klinik für Innere Medizin
Spital Zollikerberg
8125 Zollikerberg
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La maladie de reflux gastro-œsophagien («gastroesophageal reflux disease», GERD) représente toujours la maladie bénigne du tractus gastrointestinal supérieur la plus fréquente en Occident. Ce sont 10 à 20% de la population occidentale qui souffrent de troubles de reflux, engendrant des coûts importants pour les systèmes de santé et de nombreuses absences au travail. Cet article décrit le diagnostic et le traitement de la GERD et la conduite à tenir en cas de troubles résistant au traitement. Vous trouverez ensuite un aperçu de la prise en charge de l’œsophage de Barret. Différentes directives existent; l’article récapitulatif présenté ici suit principalement les directives de la Société allemande de gastro-entérologie et des maladies digestives et métaboliques (DGVS)1,2 et les directives endoscopiques de la Société européenne d’endoscopie gastro-intestinale (ESGE).3
Keypoints
-
Chez les patients présentant une maladie de reflux, en fonction de la présence de symptômes d’alarme et de facteurs de risque de survenue d’un œsophage de Barrett, c’est l’endoscopie qui permettra de faire la différence entre un traitement probatoire et un diagnostic posé d’emblée.
-
Un traitement par IPP est sûr et efficace, mais doit être (sauf exceptions) limité dans le temps et prescrit à la posologie la plus faible possible.
-
Des mesures générales/des modifications du style de vie et d’autres médicaments complètent le traitement par IPP de la maladie de reflux.
-
En cas de troubles persistants et de grande souffrance, après le passage à un autre IPP et après avoir vérifié l’observance, un examen diagnostique fonctionnel est indiqué au moyen d’une manométrie œsophagienne et d’une pH-impédancemétrie de 24 heures.
-
L’œsophage de Barrett comme complication d’une GERD représente une précancérose facultative pour un carcinome de l’œsophage; en fonction de la longueur du segment et de la situation générale, un traitement par IPP a tout son sens et une surveillance est indiquée.
On distingue les symptômes typiques (brûlures d’estomac/renvois acides) des symptômes atypiques (laryngite, toux chronique, asthme) (Tab.1). Chez les sujets sains, on trouve également un reflux physiologique acide et un reflux non acide à la pH-métrie de 24 heures. On parle donc de maladie de reflux gastro-œsophagien («gastroesophageal reflux disease», GERD) lorsque le reflux provoque soit un symptôme gênant (symptôme léger 2x/semaine ou modéré 1x/semaine) soit des complications, telles que des strictures ou un œsophage de Barrett (classification de Montréal).
De nos jours, plusieurs entités sont rassemblées sous la dénomination de GERD:4
-
Œsophagite de reflux érosive
-
Maladie de reflux non érosive (NERD)
-
Hypersensibilité au reflux/œsophage hypersensible
-
Troubles fonctionnels de reflux/brûlures fonctionnelles de l’estomac
-
Manifestations extra-œsophagiennes
-
Complications de la GERD notamment l’œsophage de Barrett
Parmi les facteurs de risque d’une maladie de reflux, on compte le surpoids, une prédisposition génétique, l’âge, la présence d’une hernie hiatale, l’abus de nicotine, la grossesse et la présence d’une collagénose/sclérodermie.
Diagnostic
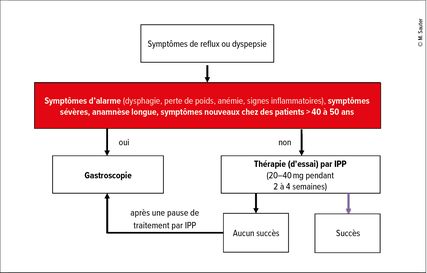
C’est l’anamnèse initiale qui permet de décider s’il faut essayer un traitement probatoire ou plutôt continuer la démarche diagnostique (Fig.1). En cas d’absence de symptômes d’alarme, il est possible d’instaurer un traitement d’essai temporaire par des inhibiteurs de la pompe à protons (IPP) à une dose standard. Dans cette situation, il est important d’avoir à l’esprit que la valeur clinique d’un premier traitement d’essai par des IPP est limitée (sensibilité d’environ 70%, spécificité d’environ 45% par rapport à «endoscopie plus pH-métrie»). Si, après une réponse à un traitement initial, une dose élevée d’IPP en traitement d’entretien est nécessaire pour obtenir la disparition des troubles (p.ex. 1 comprimé entier par jour), une endoscopie est recommandée. En présence de symptômes d’alarme, une endoscopie est d’emblée réalisée (même si un diagnostic différent n’est pas trouvé pour chaque patient présentant des symptômes d’alarme).
Chez les patients présentant des troubles de reflux chroniques sans autre symptôme d’alarme, dans certains cas, il est également indiqué de pratiquer une gastroscopie initiale, si certains facteurs de risque d’œsophage de Barrett sont présents (voir plus bas et Tab. 2).
Si l’on trouve une œsophagite de reflux à l’endoscopie, le diagnostic est confirmé; l’étendue de l’inflammation doit être documentée, p.ex. par la classification de Los-Angeles. Si l’endoscopie est exempte d’irritations, il s’agit soit d’une maladie de reflux non érosive, soit d’un autre diagnostic (p.ex. hypersensibilité au reflux, brûlures fonctionnelles). Une recherche diagnostique plus approfondie (c.-à-d. une manométrie/pH-métrie œsophagienne) est réservée aux patients présentant des symptômes réfractaires au traitement ou une inflammation persistante visible à l’endoscopie, malgré l’utilisation correcte d’un traitement par IPP (voir plus bas).
Traitement
Le traitement d’une maladie de reflux repose sur 4 piliers:
-
Mesures générales notamment réduction pondérale
-
IPP/antagonistes du récepteur H2
-
Autres médicaments
-
Mesures thérapeutiques chirurgicales/endoscopiques
Mesures générales
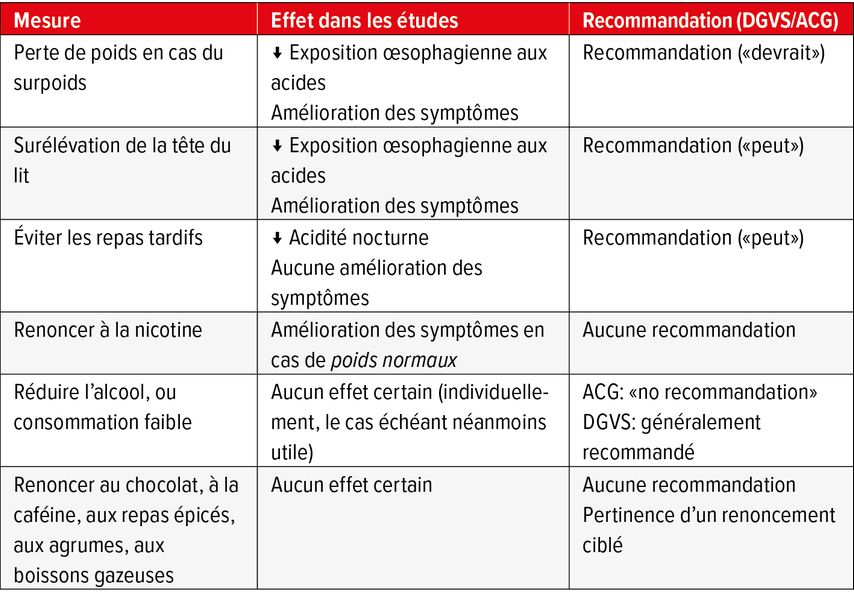
Parmi les mesures générales, on compte (Tab. 3):
-
La réduction pondérale: La présence d’un surpoids double le risque de GERD. Chez les patients en surpoids, la réduction pondérale réduit les symptômes et l’exposition de l’œsophage à l’acidité. Même si la perte pondérale est un thème difficile en pratique quotidienne, elle représente encore et toujours la principale recommandation d’une modification du style de vie.
-
La verticalisation du corps/repas du soir précoce: Ces mesures sont à recommander surtout en cas de troubles nocturnes et leur efficacité dispose d’une certaine évidence.
-
L’alimentation: Il existe une recommandation générale consistant à éviter des repas copieux et riches en graisse. Dans les études disponibles, il n’existe toutefois aucune évidence concernant le renoncement complet au café ou à des repas épicés chez tous les patients. En revanche, des «triggerfoods» individuels doivent être identifiés puis évités (agrumes, alimentation acide comme p.ex. les tomates). Un conseil diététique trouve ici toute sa justification en cas de grande souffrance et de persistance des symptômes.
IPP/antagonistes du récepteur H2
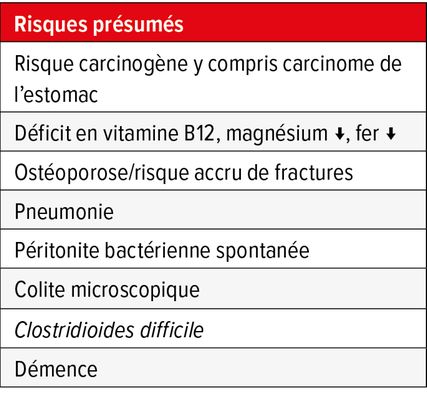
L’introduction des IPP, à la fin des années 1980 a radicalement transformé le traitement de la maladie de reflux, tout comme celui de la maladie ulcéreuse. Au cours des dernières années, les IPP sont cependant tombés en disgrâce en raison des effets indésirables à long terme révélés par de nombreuses études (Tab. 4). Toutefois, il s’agit souvent d’études observationnelles menées sur de grandes cohortes, présentant de potentielles variables perturbatrices et des résultats en partie contradictoires. Le risque de survenue d’une infection à C. difficile paraît légèrement augmenté et ceci doit être pris en compte chez les patients ayant présenté une infection antérieure. Quant aux autres risques présumés, p.ex. la démence, il n’existe aucune donnée satisfaisante. En résumé, il en ressort que les avantages d’un traitement par IPP dans une indication correcte dépassent le risque potentiel. Cependant, il convient d’instaurer le traitement par IPP à la plus petite posologie possible, et pour la durée la plus courte possible; en cas de traitement de longue durée, il convient de s’interroger sur leur indication. La «protection gastrique» par IPP est devenue clairement obsolète en cas de polymédication.
Effet des IPP
Les IPP sont très efficaces pour traiter l’œsophagite; leur effet sur les symptômes est également satisfaisant, mais dépend beaucoup du type de symptômes (60−80% pour les brûlures d’estomac, 50% pour la régurgitation, 20% ou moins pour la toux/l’enrouement présumé(e) associé(e) au reflux).5 Ceci doit être pris en compte au moment de l’instauration du traitement, et expliqué au patient. On ignore quel est le principe actif IPP le plus efficace, et il n’est pas possible à ce jour d’émettre une préférence pour l’un d’entre eux. L’oméprazole (ainsi que l’énantiomère de l’oméprazole doté d’un effet pharmacologique probablement meilleur) et le dexlansoprazole, (ne nécessitant aucune prise postprandiale obligatoire) présentent des avantages.
La posologie doit être débutée à une dose standard, administrée pour une durée déterminée, et le traitement doit être ensuite arrêté (à l’exception de l’œsophagite sévère, voir plus bas).
Antagonistes du récepteur H2
Les antagonistes du récepteur H2, qui ont une efficacité plus faible par rapport aux IPP dans les études, offrent une bonne alternative lors d’intolérance aux IPP ou en cas de symptômes légers, bien que le principe actif ranitidine ne soit plus disponible depuis peu.
Autres médicaments
Les antiacides tels que le magaldrate (Riopan®) ou les hydroxydes de magnésium ou d’aluminium (Alucol®) se lient à l’acide et peuvent être pris en postprandial seuls, en cas de symptômes légers isolés, ou en association, lors de troubles persistants sous IPP. L’alginate de sodium (Gaviscon®), sel de l’acide alginique (issu de la paroi cellulaire de certaines algues), constitue une autre option puisqu’il précipite au contact des acides. Cela présente l’avantage de lier les acides qui flottent au-dessus des aliments (également appelés «acid pocket» ou «acid layer») et de former une couche protectrice vers le haut, afin de réduire les épisodes de reflux et l’exposition de l’œsophage aux acides.6
En cas de maladie de reflux avérée et de symptômes persistants, d’autres médicaments sont instaurés occasionnellement, mais leur évidence est toutefois plus faible, comme Ziverel® (sel sodique d’acide hyaluronique, chondroïtine sulfate sodique), à visée protectrice de la muqueuse œsophagienne.
Traitements chirurgicaux
Le traitement chirurgical de choix est la fundoplicature, effectuée par voie laparoscopique, le cas échéant avec resserrement du hiatus. Il en existe différentes variantes (selon Thal, Toupet, Dor). L’opération ne peut avoir lieu qu’après un examen fonctionnel à visée diagnostique (manométrie œsophagienne/pH-impédancemétrie de 24h), destiné à objectiver le reflux et à exclure d’autres maladies (telles qu’une achalasie, des spasmes œsophagiens ou des pathologies fonctionnelles comme la rumination).
La chirurgie est le plus efficace chez les patients présentant une hernie hiatale, et des troubles de reflux classiques notamment une régurgitation de volumes (retour de liquide dans la bouche, p.ex. en se penchant en avant). L’opération fonctionne également mieux chez les patients dont les brûlures d’estomac ont bien répondu à un traitement par IPP. Chez les patients présentant des troubles atypiques tels que toux et douleurs thoraciques, l’effet est nettement inférieur. Ainsi, la chirurgie n’a vraiment de sens que chez une petite proportion de patients présentant un reflux. Parmi les risques/inconvénients, on note la dysphagie postopératoire et le météorisme. Le patient doit aussi être conscient du fait que la régurgitation de volumes est réduite efficacement par l’opération, mais que dans jusqu’à 20% des cas, les IPP doivent être poursuivis pour libérer le patient d’autres troubles du reflux persistants.
Parmi les procédés chirurgicaux qui ne sont pas encore établis, on note entre autres le Linx® (occlusion mécanique du retour gastro-œsophagien par des aimants posés chirurgicalement) et l’Endostim® (électrostimulation du sphincter par implantation d’un stimulateur à proximité du sphincter œsophagien inférieur).
Parmi les traitements endoscopiques non encore établis, on peut mentionner, entre autres, Stretta (ablation par radiofréquence endoscopique dans la zone de passage gastro-œsophagien), et mucosectomie anti-reflux, les deux ayant pour objectif de renforcer la barrière au reflux par la formation d’une cicatrice dans la zone du sphincter œsophagien inférieur.7
Même si ces options sont intéressantes sur le plan purement mécanico-pathologique, il convient encore de les considérer comme expérimentales. Elles n’ont pas encore trouvé leur place dans les directives et ne doivent être pratiquées qu’au sein d’études/cohortes.
Prise en charge à long terme/absence de réponse au traitement
En cas de découverte d’érosions importantes à l’endoscopie (œsophagite C et D selon la classification de Los-Angeles) ou d’un ulcère, une endoscopie de contrôle doit être pratiquée après 8 semaines de traitement par IPP, dans le but également d’exclure un carcinome sous-jacent. En cas de tels résultats ou de la survenue d’une stricture, un traitement d’entretien est indiqué. Dans tous les autres cas, le traitement sera arrêté après (4 à) 8 semaines et poursuivi de manière adaptée aux besoins en cas de récidive des troubles (au côté des mesures générales) à la plus petite posologie possible.
Absence de réponse au traitement
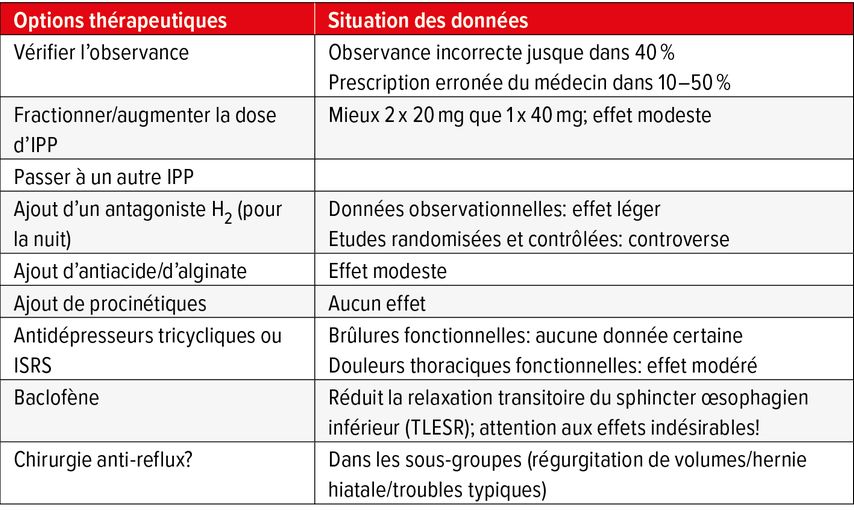
La réponse au traitement diffère en fonction du symptôme principal (voir plus haut). Les études ont en outre montré que dans jusqu’à 40% des cas, il existe des problèmes d’observance du traitement médicamenteux. En outre, les IPP sont souvent mal prescrits (pas principalement avant le petit déjeuner). D’autres mécanismes jouent encore un rôle:
-
Reflux de liquides persistant en raison d’une grande insuffisance de la barrière au reflux en présence d’une grosse hernie hiatale, cas dans lequel les IPP ont un effet limité (le cas échéant, procédé chirurgical, voir plus haut).
-
Perception accrue au niveau de l’œsophage d’un très petit reflux acide, ou d’un reflux non acide (hypersensibilité au reflux) → instauration d’antiacides, évent. d’antidépresseurs tricycliques (p.ex. amitryptiline) avec l’indication d’un «antalgique viscéral»
-
Hypomotilité œsophagienne (p.ex. dans le cadre d’une sclérodermie) → aucune influence directe du traitementmédicamenteux possible
-
«Métaboliseur rapide» de l’isoenzyme 2C19 du cytochrome P450 → passage à un autre IPP tel qu’ésoméprazole, rabéprazole
Diagnostic fonctionnel
Afin d’évaluer, entre autres, les facteurs mentionnés, un éclaircissement diagnostique fonctionnel par une manométrie œsophagienne et une pH-impédancemétrie sur 24h (ou une pH-métrie par capsule sans fil «capsule Bravo» de manière alternative) peut être indiqué (évent. après division/augmentation de la dose/passage à une autre préparation). Ces examens sont utiles, entre autres, pour prouver une maladie de reflux non érosive ou une hypersensibilité dans le cas où l’endoscopie n’a permis d’objectiver aucune érosion: c’est la raison pour laquelle il convient, suite à une endoscopie non décisive, d’effectuer une pH-métrie après 2 semaines de pause sans IPP. Le sphincter œsophagien inférieur est alors évalué au moyen de la manométrie, et on recherchera des troubles de la motilité (qui existent chez jusqu’à 10% des patients présentant une persistance des symptômes de reflux sous IPP). Il est alors important qu’au cours de la manométrie, le patient n’avale pas seulement de l’eau mais aussi des repas solides, car cela augmente la sensibilité de l’examen. On peut également rechercher une rumination par diagnostic fonctionnel et un syndrome d’aérophagie avec «supra-gastric belching»: Dans le cas de la rumination, il s’agit d’une maladie fonctionnelle au cours de laquelle l’alimentation est régurgitée dans la bouche par la contraction involontaire mais aléatoire de la musculature de la paroi abdominale. En cas d’aérophagie avec «supra-gastric belching», de l’air est avalé et finalement à nouveau régurgité, mécanisme perceptible extérieurement sous forme de rots répétés. Tant lors de rumination que d’aérophagie, le traitement consiste en une physiothérapie spécifique basée sur des mouvements respiratoires. Les différentes mesures possibles en cas d’autres symptômes réfractaires au traitement sont résumées dans le Tableau 5.
Œsophage de Barrett
On parle d’œsophage de Barrett en cas demétaplasie intestinale de l’œsophage distal.
L’œsophage de Barrett constitue une précancérose facultative d’un adénocarcinome (appelé carcinome de Barrett). En étudiant la littérature, il convient de remarquer que la définition histologique variait autrefois suivant les régions/pays. La maladie de reflux joue un rôle important dans la genèse de l’œsophage de Barrett, mais tout patient atteint de reflux ne développe pas un œsophage de Barret. Les facteurs de risque sont énumérés dans le Tableau 2; il est possible qu’un traitement par statine, entre autres, constitue un des facteurs protecteurs.
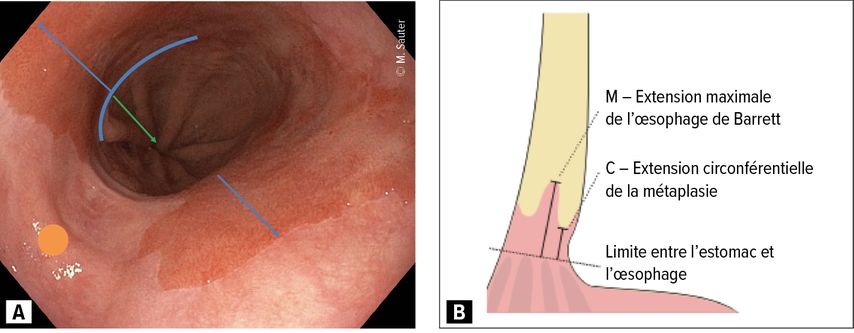
Il est important de décrire précisément l’ampleur d’un œsophage de Barrett à l’endoscopie (avec ce que l’on nomme la classification de Prague, Fig. 2); la localisation doit être également déterminée avec précision (de préférence en l’absence d’inflammation), le plus facile étant par représentation à la lumière bleue («narrow band imaging») et/ou par application d’acide acétique, pour détecter plus précisément les régions portant des atypies, et pouvoir les évaluer.
Fig. 2: Œsophage de Barrett. A) Photo d’un œsophage de Barrett à titre d’exemple (ligne en bleu: fin des plis gastriques = transition gastro-œsophagienne; flèche en vert: hernie hiatale; flèche en bleu: languette de Barrett; point en orange: muqueuse épithéliale pavimenteuse de l’œsophage); B) étendue de la muqueuse de Barrett selon la classification de Prague
Le risque de progression vers une dysplasie puis vers un carcinome dépend de la longueur du segment de Barrett et des mêmes facteurs de risque (Tab. 2). Le risque est vraisemblablement inférieur à celui qui est admis et se situe, en fonction de la longueur et de la présence de facteurs de risque de Barret, jusqu’à 3% par an, alors que de nouvelles études ont documenté des taux de progression inférieurs, d’environ 0,4% par an. Bien que le risque de carcinome œsophagien soit multiplié par 30 chez un patient porteur d’un œsophage de Barrett par rapport à la population normale, il semble que le risque absolu pour un patient porteur d’un œsophage de Barrett soit faible.
En fonction de la longueur du segment et de la situation générale (espérance de vie/comorbidités), on recommandera au patient un traitement par IPP et une surveillance. Un traitement par IPP semble, dans une certaine mesure, protéger contre la progression vers un carcinome.
La surveillance a lieu selon des directives de l’ESGE suivantes:3
-
Si l’endoscopie n’a pas été effectuée d’après le standard mentionné plus haut (inspection précise, biopsies, coloration le cas échéant) → répéter l’endoscopie
-
Barrett <1cm sans dysplasie: pas de surveillance
-
Barrett 1−3cm sans dysplasie: contrôle à 5 ans
-
Barrett 3−10cm sans dysplasie: contrôle à 3 ans
-
>10cm: à adresser à un centre expert
Les dysplasies de l’œsophage de Barrett doivent être confiées à des personnes expérimentées (tant sur le plan de l’endoscopie que sur celui de l’évaluation pathologique). En cas de dysplasie et de lésion visible, il faut procéder à une résection endoscopique (mucosectomie); dans le cas d’une dysplasie «low grade» sans particularités visibles, on effectuera un contrôle endoscopique à 6 mois dans un centre très expérimenté. En présence d’une dysplasie «high grade», il faut traiter dans tous les cas (résection endoscopique +/– ablation par radiofréquence [RFA]). Après ce type de traitement, une surveillance ultérieure est indiquée.
Fig. 3: La maladie du reflux gastro-œsophagien (GERD) est la maladie bénigne la plus fréquente du tractus gastro-intestinal supérieur en Occident: 10 à 20% de la population occidentale souffrent de troubles de reflux
Littérature:
1 Koop H et al.: S2k guideline: gastroesophageal reflux disease guided by the German Society of Gastroenterology: AWMF register no. 021-013. Z Gastroenterol 2014; 52: 1299-346 2 Porschen R et al.: S3-Leitlinie – Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. Z Gastroenterol 2019; 57: e120 3 Weusten B et al.: Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2017; 49: 191-8 4 Vakil N et al.: The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006, 101: 1900-20 5 Kahrilas PJ et al.: Management of the patient with incomplete response to PPI therapy. Best Pract Res Clin Gastroenterol 2013, 27: 401-14 6 Sauter M, Fox MR: [The acid pocket – a novel target for the treatment of gastro-esophageal reflux disease.] Z Gastroenterol 2018; 56: 1276-82 7 Rettura F et al.: Refractory gastroesophageal reflux disease: a management update. Front Med 2021; 8: 765061
Das könnte Sie auch interessieren:
Séquelles cardiopulmonaires à long terme après une infection sévère par le SARS-CoV-2
Le SARS-CoV-2 a entraîné une crise sanitaire mondiale et a posé des défis considérables aux systèmes de santé.1 Si le Covid-19 était initialement considérée comme une maladie ...
Posters et communications sélectionnés
Lors du congrès annuel de la Société Suisse d’Endocrinologie et de Diabétologie, les endocrinologues et diabétologues suisses ont fourni une vue d’ensemble de leurs nombreuses recherches ...
Analogues de l’incrétine par rapport à la chirurgie bariatrique
La question du meilleur traitement pour la perte de poids a fait l’objet d’un débat pour et contre dans le cadre du congrès 2024 de l’EASD. Alors que la facilité d’accès et la bonne ...