Passage à l‘ozanimod après l‘interruption du traitement par fingolimod en raison d‘une lymphopénie
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une étude récente menée en „real world“ montre que les patients atteints de sclérose en plaques récurrente-rémittente (SEPR) qui ont interrompu leur traitement par fingolimod en raison d‘une lymphopénie peuvent bénéficier d‘un passage à l‘ozanimod. Les taux de lymphocytes se sont améliorés après le passage à l‘ozanimod avec une réponse clinique persistante.1
Contexte
Le traitement de la SEP-RR par le fingolimod entraîne une réduction dose-dépendante de la concentration de lymphocytes périphériques à environ 30 % en moyenne (environ 0,5 × 103 cellules/µL) de la valeur initiale.2 En pratique, en cas de lymphopénie sévère de grade 4, c’est-à-dire d’un taux de lymphocytes (ALC) < 0,2 × 103 cellules/µL, il convient d’interrompre ou d’arrêter le traitement.2 Les études cliniques sur l’ozanimod, modulateur sélectif du récepteur S1P, ont montré qu’il réduit le nombre de lymphocytes à une moyenne de 0,8 × 103 cellules/µL.3 L’étude présentée ici a examiné si le passage du fingolimod à l’ozanimod pouvait atténuer la lymphopénie tout en maintenant l’efficacité clinique..
Conception de l’étude
Une étude observationnelle en Real-World a été menée au centre de sclérose en plaques de l’hôpital universitaire Federico II de Naples, en Italie. Elle a inclus 18 patients atteints de SEP-RR qui avaient arrêté leur traitement par fingolimod en raison d’une lymphopénie et qui remplissaient les conditions pour passer à l’ozanimod. Le taux de leucocytes, de lymphocytes et de neutrophiles ont été examinés à quatre moments de l’analyse :1
12 mois avant l’interruption du traitement par le fingolimod
au moment de l’arrêt du traitement par le fingolimod (valeur de référence)
au début du traitement par l’ozanimod
après 6 mois de traitement par ozanimod
Résultats de l’étude
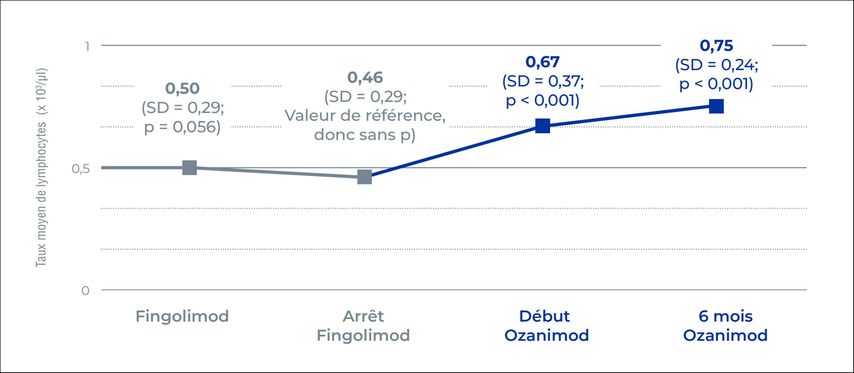
Le taux de lymphocytes sous fingolimod 12 mois avant l’arrêt du traitement et au moment de l’arrêt était similairement bas (0,50 vs 0,46 × 103 cellules/µL). Le passage à l’ozanimod a eu lieu après une interruption du traitement de 21 jours en moyenne. Au début du traitement par l’ozanimod, le nombre de lymphocytes était déjà significativement plus élevé par rapport à la valeur de référence, avec une moyenne de 0,67 x 103 cellules/µL (figure 1; p < 0,001). Une nouvelle augmentation à 0,75 x 103 cellules/µL en moyenne (p < 0,001) a été enregistrée après 6 mois de traitement par l’ozanimod. Aucune poussée ni infection n’est survenue pendant la période d’observation. Seule une patiente a vu son EDSS augmenter d’un point pendant le traitement par l’ozanimod. Cependant, les auteurs de l’étude soulignent que l’échantillon de l’étude permet de tirer des conclusions sur les paramètres de laboratoire, mais qu’il est trop petit pour évaluer les paramètres cliniques.1
Conclusion
Les patients atteints de SEP-RR qui ont interrompu un traitement par fingolimod en raison d’une lymphopénie pourraient tirer profit du passage à un traitement par ozanimod.1 Ces résultats ouvrent de nouvelles perspectives dans la prise en charge de la lymphopénie associée au fingolimod et soulignent l’importance du choix d’un traitement de suivi approprié. De plus, ces résultats aident éventuellement à choisir le traitement initial afin de minimiser le risque de changement de traitement lié à la lymphopénie.
Avec l’aimable soutien de Bristol-Myers Squibb GmbH
2084-CH-2400069, 06/2024
Referenzen
1. a, b, c, d, e Caliendo D et al. Switching to ozanimod as a strategy to adjust fingolimod-related lymphopenia. Mult Scler Relat Disord. 2024;81:105135.
2. a, b Information pour professionnelle Gilenya® (Fingolimod), Etat Mai 2023.
3. Information pour professionnelle ZEPOSIA® (Ozanimod), état actuel; www.swissmedicinfo.ch
Littérature sur demande.
Information professionnelle abrégée Zeposia® (ozanimod)
Ce médicament fait l’objet d’une surveillance supplémentaire. Pour de plus amples informations, voir l’information professionnelle Zeposia® sur
www.swissmedicinfo.ch
. I : Sclérose en plaques (SEP) : Indiqué pour le traitement de patients adultes atteints de sclérose en plaques (SEP) récurrente-rémittente. Rectocolite hémorragique (RCH) : Indiqué pour le traitement des patients adultes atteints de RCH active modérée à sévère chez qui les traitements conventionnels ou le traitement par un agent biologique ont eu une réponse inadéquate, ne répondent plus ou n’ont pas été tolérés. P : Gélules 0,23/0,46/0,92 mg par voie orale une fois par jour. Schéma d’escalade de dose : jour 1 à 4 : 0,23 mg ; jour 5 à 7 : 0,46 mg ; à partir du jour 8 : 0,92 mg. CI : hypersensibilité aux effets secondaires / excipients ; ne pas commencer le traitement chez les patients qui ont eu les maladies suivantes au cours des 6 derniers mois : infarctus du myocarde, angine de poitrine instable, accident vasculaire cérébral, accident ischémique transitoire, insuffisance cardiaque décompensée avec hospitalisation nécessaire, insuffisance cardiaque de classe III/IV, ainsi que chez les patients ayant des antécédents connus ou un diagnostic actuel de bloc auriculo-ventriculaire (AV) du deuxième degré (type II), bloc AV du troisième degré, bloc sino-atrial, syndrome du nœud sinusal (sans stimulateur cardiaque fonctionnel) ; apnée du sommeil grave non traitée ; état d’immunodéficience ; patients présentant un risque accru d’infections opportunistes ; infections actives graves ou infections chroniques actives (hépatite, tuberculose) ; tumeur maligne active ; insuffisance hépatique grave ; œdème maculaire existant ; grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception efficace. MP : Avant la mise en route du traitement : examen cardiaque (ECG), test de fonction hépatique, hémogramme, examen ophtalmologique chez les patients diabétiques, antécédents d’uvéite ou de maladie rétinienne, examen de la fonction pulmonaire chez les patients atteints de maladies pulmonaires graves, vérifier la médication concomitante. Pendant la première administration de Zeposia®, une dimi-nution temporaire de la fréquence cardiaque peut survenir ; chez les patients souffrant de maladies cardiaques préexistantes, une surveillance est recommandée. Des élévations des aminotransférases sont possibles et doivent être régulièrement surveillées. Zeposia® a un effet immunosuppresseur qui prédispose les patients à un risque d’infection. Étant donné que le risque potentiel d’altérations cutanées malignes est important, il convient de veiller à la protection solaire, pas de photothérapie concomitante (photochimiothérapie UVB, PUVA), hémogramme complet, fonction hépatique, tester régulièrement la tension artérielle pendant le traitement. Si le nombre total de lymphocytes confirmé est < 0,2 × 109/l ou en cas d’œdème maculaire, interrompre le traitement. Vaccination contre le VZV sans immunité documentée ≥ 1 mois avant le début du traitement. EI : Très fréquents (≥ 10%) : rhinopharyngite, lymphopénie. Fréquents (≥ 1%, < 10%) : pharyngite, infections virales des voies respiratoires, infection des voies urinaires, herpès zoster, herpès simplex, céphalées, test de fonction pulmonaire anormal, bradycardie, hypotension orthostatique, hypotension orthostatique, ALT, GGT et bilirubine augmentée, œdème périphérique. P : Boîte de démarrage Zeposia® : 7 gélules (4 × 0,23 mg, 3 × 0,46 mg) ; Zeposia®
0,92 mg : 28 gélules. Catégorie de remise B. Vous trouverez l’information professionnelle complète sur
www.swissmedicinfo.ch
.
Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Mise à jour de l’information: mai 2023.