Persistance thérapeutique et satisfaction vis-à-vis du traitement élevées dans des conditions du monde réel
Compte-rendu: Dr. Therese Schwender
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Une analyse intermédiaire récente de l’étude post-commercialisation allemande OzEAN, lancée après l’autorisation de Zeposia® (ozanimod), fournit des résultats prometteurs: après 12 mois, on a observé une persistance thérapeutique et une satisfaction vis-à-vis du traitement élevées dans des conditions du monde réel, ainsi qu’une efficacité et une sécurité comparables à celles dans les études.1–11
Suite à l’autorisation de Zeposia® (ozanimod) pour le traitement des adultes atteints de sclérose en plaques récurrente-rémittente (SEP-RR), l’étude post-commercialisation OzEAN a été lancée en Allemagne.1 Depuis mars 2021, des patient·es adultes atteint·es de SEP-RR confirmée sont inclus·es dans cette étude prospective non interventionnelle dans toute l’Allemagne afin d’évaluer, dans des conditions du monde réel, leur persistance dans le cadre du traitement par Zeposia® (critère d’évaluation primaire) ainsi que l’efficacité, la sécurité et différents PRO («patient-reported outcomes»).1
Persistance et satisfaction élevées dans des conditions du monde réel
La première analyse intermédiaire, dont la date de référence était le 15 juin 2023, a montré que 69,1 % des 317 personnes atteintes de SEP-RR incluses jusqu’à présent étaient des femmes.1 L’âge moyen était de 39,6 ans, 40,7 % des personnes avaient été diagnostiquées d’une SEP-RR depuis moins de deux ans et un bon tiers (36,3 %) étaient naïves de traitement (faible proportion due aux indications autorisées en Allemagne). Dans ce groupe, la persistance thérapeutique et la satisfaction vis-à-vis du traitement ont été évaluées à l’aide du TSQM v1.4 (Treatment Satisfaction Questionnaire for Medication).1 Il s’est avéré que 81 % des participant·es étaient sous traitement par Zeposia® après 12 mois.1 Ce dernier a été interrompu par 60 patient·es, dont 16 en raison d’effets secondaires liés au traitement. La satisfaction des patient·es vis-à-vis du traitement par Zeposia® était élevée, en particulier dans les catégories de la tolérance et du confort.1
Efficacité et sécurité comparables à celles dans les études
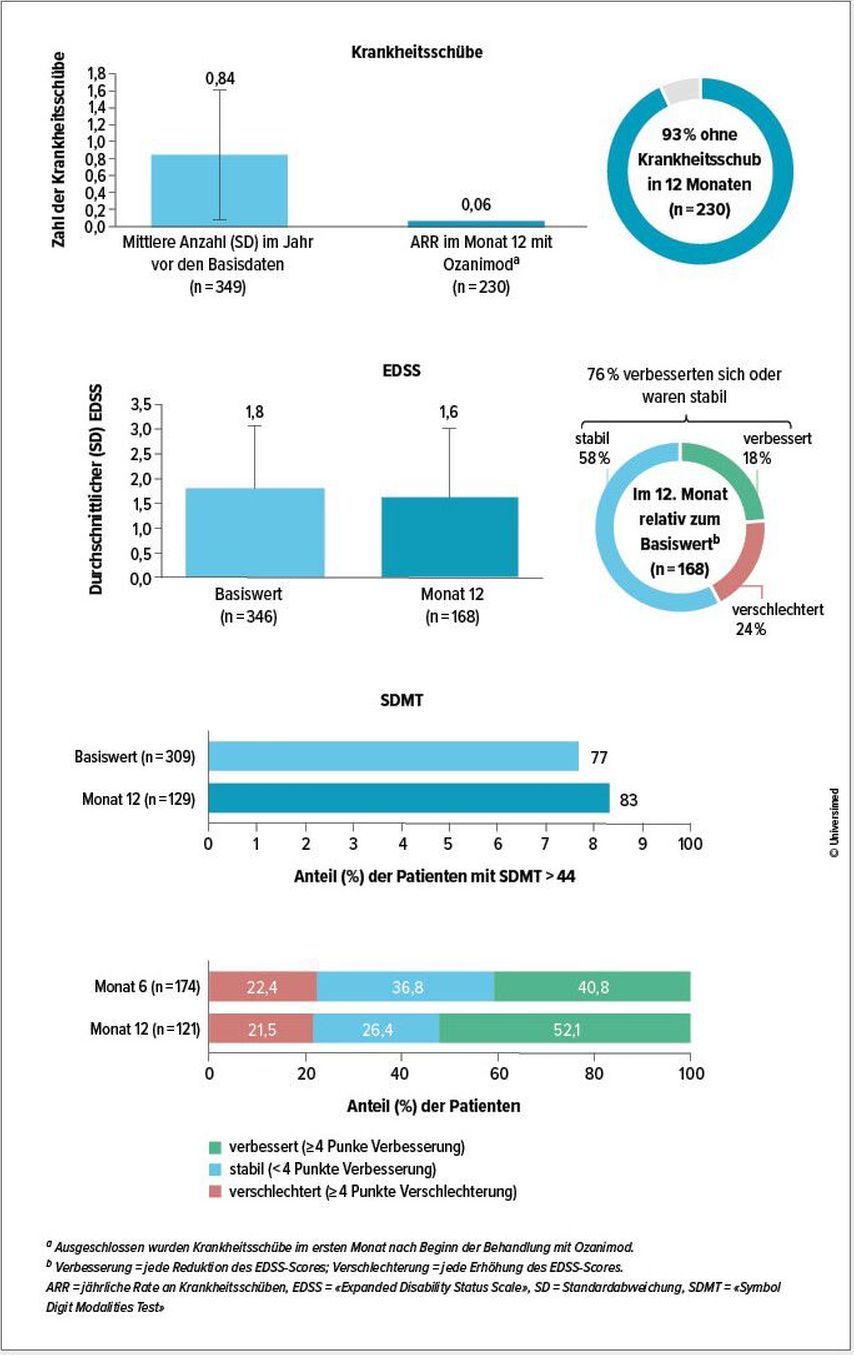
L’analyse la plus récente de l’étude OzEAN présentée au congrès de l’ECTRIMS à Copenhague (date de référence: 15 mars 2024, n = 389) a fourni pour la première fois des données sur l’efficacité et la sécurité de Zeposia® dans des conditions du monde réel.2 Elles ont révélé que le taux annuel de poussées était de 0,06 après un an. Au total, 93 % des participant·es (n = 230) n’ont connu aucune poussée pendant 12 mois (Fig. 1).2 Le score EDSS («Expanded Disability Status Scale») est resté stable ou s’est amélioré par rapport à la valeur initiale chez 76 % des participant·es (n = 168) (Fig. 1).2 La vitesse de traitement cognitif, mesurée par le SDMT («Symbol Digit Modalities Test»), s’est améliorée d’au moins 4 points chez 52,1 % des patient·es après 12 mois (n = 121) et est restée stable chez 26,4 % (Fig. 1).2 L’efficacité de Zeposia® dans des conditions du monde réel semble donc correspondre à l’efficacité observée dans les études cliniques de phase III.2–5
Fig. 1: Au cours de l’année de traitement par Zeposia®, le taux de poussées a été faible et l’ampleur du handicap ainsi que la vitesse de traitement cognitif sont restées majoritairement stables ou se sont améliorées2
Le profil de sécurité général de Zeposia® dans l’étude OzEAN était également conforme aux résultats des études cliniques.2–4,6 Seul le taux d’événements indésirables ayant entraîné l’arrêt du traitement était plus élevé que dans les études avec 6,9 % des participant·es de l’étude OzEAN (27/389). Cependant, de tels événements ont généralement tendance à être observés plus fréquemment dans les cohortes de monde réel que dans les essais cliniques, comme le montrent les données relatives à d’autres traitements de la SEP-RR.7–10
Conclusion
Les résultats de l’analyse intérimaire de l’étude post-commercialisation allemande OzEAN soulignent le potentiel de Zeposia® en tant qu’option thérapeutique efficace et bien tolérée au quotidien pour les personnes atteintes de SEP-RR. Après 12 mois, on a ainsi constaté une persistance thérapeutique et une satisfaction vis-à-vis du traitement élevées, surtout dans les catégories de la tolérance et du confort, ainsi qu’une efficacité et une sécurité comparables à celles dans les études cliniques.1–11
Contenu sponsorisé
Avec l’aimable soutien de Bristol-Myers Squibb SA
2084-CH-2400123, 12/24 | Information professionnelle abrégée
Literatur:
1 Ziemssen T et al.: Interim analysis of OzEAN: a prospective, noninterventional study to evaluate the utilization and effectiveness of ozanimod in clinical practice in patients with relapsing-remitting multiple sclerosis. ECTRIMS-ACTRIMS Oktober 2023, Mailand/I. P1458. 2 Buttmann M et al.: One-year real-world clinical effectiveness and safety of ozanimod for relapsing-remitting multiple sclerosis in Germany: an interim analysis of the prospective, non-interventional OzEAN study. ECTRIMS Oktober 2024, Kopenhagen/DK. P387. 3 Comi G et al.: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (SUNBEAM): a multicentre, randomised, minimum 12-month, phase 3 trial. Lancet Neurol 2019; 18: 1009-20 4 Cohen JA et al.: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (RADIANCE): a multicentre, randomised, 24-month, phase 3 trial. Lancet Neurol 2019; 18: 1021-33 5 DeLuca J et al. Effect of ozanimod on symbol digit modalities test performance in relapsing MS. Mult Scler Relat Disord. 2021; 48: 102673 6 Cree BA et al.: Long-term safety and efficacy of ozanimod in relapsing multiple sclerosis: Up to 5years of follow-up in the DAYBREAK open-label extension trial. Mult Scler. 2022; 28: 1944-62 7 Frisell T et al.: Comparative analysis of first-year fingolimod and natalizumab drug discontinuation among Swedish patients with multiple sclerosis. Mult Scler 2016; 22: 85-93 8 Cohen JA et al.: Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402-15 9 Bucello S et al. Real world experience with teriflunomide in multiple sclerosis: the TER-Italy study. J Neurol 2021; 268: 2922-32 10 O’Connor P et al.: Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011; 365: 1293-303 11 Information professionnelle de Zeposia® (ozanimod). www.swissmedicinfo.ch.
Information professionnelle abrégée Zeposia® (ozanimod)
Ce médicament fait l’objet d’une surveillance supplémentaire. Pour de plus amples informations, voir l’information professionnelle Zeposia® sur
www.swissmedicinfo.ch
. I : Sclérose en plaques (SEP) : Indiqué pour le traitement de patients adultes atteints de sclérose en plaques (SEP) récurrente-rémittente. Rectocolite hémorragique (RCH) : Indiqué pour le traitement des patients adultes atteints de RCH active modérée à sévère chez qui les traitements conventionnels ou le traitement par un agent biologique ont eu une réponse inadéquate, ne répondent plus ou n’ont pas été tolérés. P : Gélules 0,23/0,46/0,92 mg par voie orale une fois par jour. Schéma d’escalade de dose : jour 1 à 4 : 0,23 mg ; jour 5 à 7 : 0,46 mg ; à partir du jour 8 : 0,92 mg. CI : hypersensibilité aux effets secondaires / excipients ; ne pas commencer le traitement chez les patients qui ont eu les maladies suivantes au cours des 6 derniers mois : infarctus du myocarde, angine de poitrine instable, accident vasculaire cérébral, accident ischémique transitoire, insuffisance cardiaque décompensée avec hospitalisation nécessaire, insuffisance cardiaque de classe III/IV, ainsi que chez les patients ayant des antécédents connus ou un diagnostic actuel de bloc auriculo-ventriculaire (AV) du deuxième degré (type II), bloc AV du troisième degré, bloc sino-atrial, syndrome du nœud sinusal (sans stimulateur cardiaque fonctionnel) ; apnée du sommeil grave non traitée ; état d’immunodéficience ; patients présentant un risque accru d’infections opportunistes ; infections actives graves ou infections chroniques actives (hépatite, tuberculose) ; tumeur maligne active ; insuffisance hépatique grave ; œdème maculaire existant ; grossesse et chez les femmes en âge de procréer n’utilisant pas de contraception efficace. MP : Avant la mise en route du traitement : examen cardiaque (ECG), test de fonction hépatique, hémogramme, examen ophtalmologique chez les patients diabétiques, antécédents d’uvéite ou de maladie rétinienne, examen de la fonction pulmonaire chez les patients atteints de maladies pulmonaires graves, vérifier la médication concomitante. Pendant la première administration de Zeposia®, une dimi-nution temporaire de la fréquence cardiaque peut survenir ; chez les patients souffrant de maladies cardiaques préexistantes, une surveillance est recommandée. Des élévations des aminotransférases sont possibles et doivent être régulièrement surveillées. Zeposia® a un effet immunosuppresseur qui prédispose les patients à un risque d’infection. Étant donné que le risque potentiel d’altérations cutanées malignes est important, il convient de veiller à la protection solaire, pas de photothérapie concomitante (photochimiothérapie UVB, PUVA), hémogramme complet, fonction hépatique, tester régulièrement la tension artérielle pendant le traitement. Si le nombre total de lymphocytes confirmé est < 0,2 × 109/l ou en cas d’œdème maculaire, interrompre le traitement. Vaccination contre le VZV sans immunité documentée ≥ 1 mois avant le début du traitement. EI : Très fréquents (≥ 10%) : rhinopharyngite, lymphopénie. Fréquents (≥ 1%, < 10%) : pharyngite, infections virales des voies respiratoires, infection des voies urinaires, herpès zoster, herpès simplex, céphalées, test de fonction pulmonaire anormal, bradycardie, hypotension orthostatique, hypotension orthostatique, ALT, GGT et bilirubine augmentée, œdème périphérique. P : Boîte de démarrage Zeposia® : 7 gélules (4 × 0,23 mg, 3 × 0,46 mg) ; Zeposia®
0,92 mg : 28 gélules. Catégorie de remise B. Vous trouverez l’information professionnelle complète sur
www.swissmedicinfo.ch
.
Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Mise à jour de l’information: mai 2023.