Umstellung auf Ozanimod nach Lymphopeniebedingtem Therapieabbruch unter Fingolimod
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Eine aktuelle Real-World-Studie zeigt, dass Patient:innen mit schubförmig remittierender Multipler Sklerose (RRMS), die aufgrund einer Lymphopenie ihre Fingolimod-Therapie abbrachen, von einer Umstellung auf Ozanimod profitieren können. Die Lymphozytenwerte verbesserten sich nach der Umstellung auf Ozanimod bei persistierendem klinischen Ansprechen.1
Hintergrund
Die RRMS-Behandlung mit Fingolimod verursacht eine dosisabhängige Reduktion der peri-pheren Lymphozytenkonzentration auf im Mittel ca. 30 % (ca. 0,5 × 103 Zellen/µL) des Aus-gangswerts.2 In der Praxis ist bei einer schweren Lymphopenie Grad 4, also einer absoluten Lymphozytenzahl (ALC) < 0,2 × 103 Zellen/µL, eine Therapieunterbrechung oder ein Therapie-abbruch angezeigt.2
Aus klinischen Studien zum selektiven S1P-Rezeptor-Modulator Ozanimod ist bekannt, dass dieser die Lymphozytenzahl auf im Mittel 0,8 × 103 Zellen/µL reduziert.3 Die hier vorgestellte Studie unter-suchte, ob eine Umstellung von Fingolimod auf Ozanimod die Lymphopenie mildern und gleich-zeitig die klinische Wirksamkeit aufrechterhalten kann.
Studiendesign
Die Real-World-Beobachtungsstudie wurde am Multiple Sclerosis Center der Universitätsklinik Federico II in Neapel, Italien, durchgeführt. Eingeschlossen wurden 18 RRMS-Patient:innen, die ihre Fingolimod-Therapie aufgrund einer Lymphopenie abbrachen und die Voraussetzungen für eine Umstellung auf Ozanimod erfüllten.
Untersucht wurden die absolute Leukozytenzahl, die absolute Lymphozytenzahl und die ab-solute Zahl der Neutrophilen zu vier Analyse-Zeitpunkten:1
12 Monate vor Therapieabbruch mit Fingolimod
zum Zeitpunkt des Therapieabbruchs von Fingolimod (Referenzwert)
zu Therapiebeginn mit Ozanimod
nach 6 Monaten unter Ozanimod-Therapie
Studienergebnisse
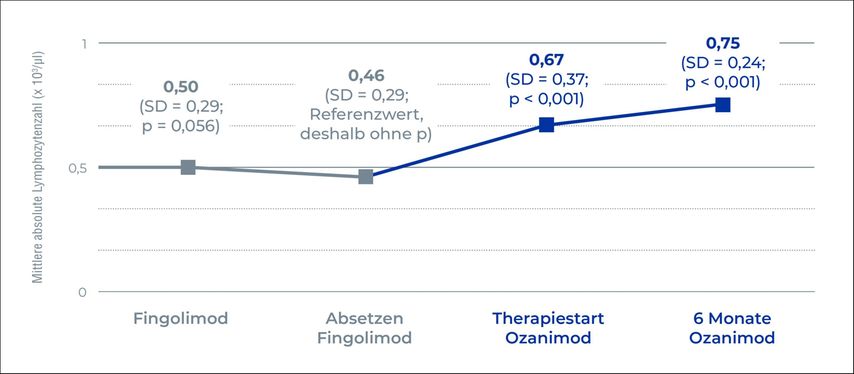
Die absoluten Lymphozytenzahlen unter Fingolimod 12 Monate vor Therapieabbruch und zum Zeitpunkt des Abbruchs waren ähnlich niedrig (0,50 vs. 0,46 × 103 Zellen/µL). Die Umstellung auf Ozanimod erfolgte nach einer Therapiepause von durchschnittlich 21 Tagen. Zu Beginn der Ozanimod-Therapie war die Lymphozytenzahl bereits signifikant erhöht im Vergleich zum Referenzwert und lag im Mittel bei 0,67 x 103 Zellen/µL (Abbildung 1; p < 0,001). Ein weiterer Anstieg auf durchschnittlich 0,75 x 103 Zellen/µL (p < 0,001) wurde nach 6 Monaten unter Ozanimod-Therapie verzeichnet. Während des Beobachtungszeitraums traten keine Schübe oder Infektionen auf. Lediglich bei einer Patientin kam es zu einem Anstieg des EDSS um 1 Punkt während der Ozanimod-Therapie. Jedoch weisen die Studienautoren darauf hin, dass die Studienstichprobe Aussagen zu den Laborparametern zulässt, für eine Beurteilung klinischer Parameter allerdings zu klein ist.1
Fazit
RRMS-Patienten, die eine Fingolimod-Therapie aufgrund einer Lymphopenie abbrachen, könnten durch den Wechsel zu einer Ozanimod-Therapie profitieren.1 Diese Ergebnisse eröffnen neue Perspektiven im Management der Fingolimod-assoziierten Lymphopenie und unterstreichen die Bedeutung der Wahl einer geeigneten Folgetherapie. Zudem unterstützen diese Ergebnisse möglicherweise bei der initialen Therapiewahl, um das Risiko für Lymphopenie-bedingte Therapiewechsel zu minimieren.
Mit freundlicher Unterstützung durch Bristol Myers Squibb SA
2084-CH-2400069, 06/2024
Referenzen
1. a, b, c, d, e Caliendo D et al. Switching to ozanimod as a strategy to adjust fingolimod-related lymphopenia. Mult Scler Relat Disord. 2024;81:105135.
2. a, b Fachinformation Gilenya® (Fingolimod), Stand Mai 2023.
3. Fachinformation ZEPOSIA® (Ozanimod), aktueller Stand; www.swissmedicinfo.ch
Literatur auf Anfrage.
Geküzte Fachinformation Zeposia® (Ozanimod)
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Für weitere Informationen siehe Fachinformation Zeposia® auf www.swissmedicinfo.ch . I: Multiple Sklerose (MS): Indiziert zur Be-handlung von erwachsenen Patienten mit schubförmig remittierend verlaufender MS. Colitis Ulcerosa (CU): Indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer aktiver CU, die entweder auf konventionelle Therapien oder die Behandlung mit einem Biologikum ungenügend angesprochen haben, nicht mehr ansprechen oder die Therapie nicht tolerierten. D: Hartkapseln 0.23/0.46/0.92 mg oral einmal täglich. Dosistitrationsschema: Tag 1–4: 0.23 mg; Tag 5–7: 0.46 mg; ab Tag 8: 0.92 mg. KI: Überempfindlichkeit gegen Wirk-/Hilfsstoffe; Behandlung nicht beginnen bei Patienten, die in den letzten 6 Monaten folgende Erkrankungen hatten: Myokardinfarkt, instabile Angina pectoris, Schlaganfall, transitorische ischämische Attacke, dekompensierte Herzinsuffizienz mit erforderlicher Hospitalisierung, Herzinsuffizienz Klasse III/IV, anamnestisch bekannter oder aktuell vorliegender atrioventrikulärer (AV) Block zweiten Grades (Typ II), AV-Block dritten Grades, sinuatrialer Block, Sinusknotensyndrom (ohne funktionstüchtigen Herzschrittmacher); schwere unbehandelte Schlafapnoe; immundefizienter Zustand; erhöhtes Risiko für opportunistische Infektionen; schwere aktive oder aktive chronische Infektionen (Hepatitis, Tuberkulose); aktive maligne Erkrankung; schwere Leberinsuffizienz; bestehendes Makulaödem; Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Methode zur Empfängnisverhütung anwenden. WH/VM: Vor Therapieeinleitung: kardiale Untersuchung (EKG), Leberfunktionstest, BB, ophthalmologische Untersuchung bei Diabetes mellitus, Uveitis oder Netzhauterkrankung in der Vorgeschichte, Untersuchung der Lungenfunktion bei Patienten mit schweren Lungenerkrankungen, Begleitmedikationen prüfen. Während der ersten Zeposia® Gabe kann es zu einer vorübergehenden Abnahme der Herzfrequenz kommen; bei Patienten mit vorbestehenden Herzerkrankungen ist eine Überwachung bei der ersten Gabe empfohlen. Erhöhungen von Aminotransferasen sind möglich und werden regelmässig überwacht. Zeposia® hat eine immunsuppressive Wirkung, die Patienten für ein Infektionsrisiko prädisponiert. Da potentielles Risiko für maligne Hautveränderungen, auf Sonnenschutz achten, keine gleichzeitige Phototherapie (UVB, PUVA Photochemotherapie), grosses BB, Leberfunktion, Blutdruck während der Behandlung regelmässig testen. Bei bestätigter Gesamtlymphozytenzahl < 0.2 × 109/l oder bei bestätigtem Makulaödem Behandlung unterbrechen. Impfung gegen VZV ohne dokumentierte Immunität ≥ 1 Monat vor Beginn empfohlen. UW: Sehr häufig (≥ 10 %): Nasopharyngitis, Lymphopenie. Häufig (≥ 1 %, < 10 %): Pharyngitis, virale Atemwegsinfektion, Harnwegsinfektion, Herpes Zoster, Herpes simplex, Kopf-schmerzen, Lungenfunktionstest abnormal, Bradykardie, Hypertonie, orthostatische Hypotension, ALT, GGT und Bilirubin erhöht, periphere Ödeme. P: Zeposia® Starterpackung: 7 Hartkapseln (4 × 0.23 mg, 3 × 0.46 mg); Zeposia® 0.92 mg: 28 Hartkapseln. Abgabekategorie B.
Vollständige Fachinformation unter www.swissmedicinfo.ch . Bristol-Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Stand der Information: Mai 2023.