Lupusnephritis: frühzeitig erkennen – richtig behandeln
Autorinnen:
Dr. med. Stephanie Damm
Prof. Dr. med. Britta George
Klinik für Nephrologie
Universitätsspital Zürich
E-Mail: stephanie.damm@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Lupusnephritis ist eine der wichtigsten Organmanifestationen des systemischen Lupus erythematodes, da sie entscheidend zur Morbidität und Mortalität der Erkrankung beiträgt. Die Diagnosestellung kann dabei im klinischen Alltag anspruchsvoll sein, da klinische und serologische Parameter unterschiedlich stark ausgeprägt sein können. Eine frühzeitige Therapie ist jedoch entscheidend, um den langfristigen Verlust an Nierenfunktion aufhalten zu können.
Keypoints
-
Die Lupusnephritis (LN) ist eine häufige und schwere Organmanifestation des systemischen Lupus erythematodes, welche massgeblich zur Morbidität und Mortalität der Erkrankung beiträgt.
-
Bei klinischen Hinweisen auf eine LN ermöglicht die frühzeitige Diagnose mittels Nierenbiopsie eine rasche Therapieeinleitung zur Vermeidung chronischer Schäden und damit langfristig des Verlusts der Nierenfunktion.
-
Die Therapie ist abhängig von der LN-Klasse, wobei es verschiedene neue Therapeutika gibt mit einem Benefit je nach individuellem Patientenprofil.
-
Eine multimodale Kombinationstherapie ermöglicht ein rasches Ausschleichen der Steroide und verbessert die Therapiekontrolle. Welche der zur Verfügung stehenden Therapeutika kombiniert werden, sollte individualisiert unter Berücksichtigung der Patientenpräferenz von einem Spezialisten entschieden werden.
Der systemische Lupus erythematodes (SLE) gehört zu den Autoimmunerkrankungen, die jedes Organ oder Organkompartiment betreffen können. Der Krankheitsprozess verläuft häufig über Jahre und ist von Phasen unterschiedlicher Krankheitsaktivität geprägt.
Die Ursache des SLE ist weiterhin unklar. Aktuell wird von einer «Multiple hit»-Hypothese ausgegangen: Wahrscheinlich besteht eine genetische Veranlagung, welche zusammen mit individuellen Faktoren und Umwelteinflüssen zum Ausbruch der Erkrankung führt.1 Jede Ethnie, jedes Geschlecht und jedes Alter kann betroffen sein, wobei es eine Häufung bei Frauen und im Alter von 18–45 Jahren gibt.2
Die Diagnosestellung kann schwierig sein, da das Spektrum der Symptome weitläufig ist und die immunologischen Parameter unterschiedlich ausgeprägt sein können. Häufige Manifestationen sind Hautveränderungen, Muskel- und Gelenkschmerzen, Fieber, Gewichtsverlust, Müdigkeit und Leistungsintoleranz. Es können gastrointestinale Symptome, pulmonale Beschwerden oder eine Beteiligung der Nieren, des Herzens oder des Knochenmarks vorliegen.3 Serologische Parameter sind antinukleäre Antikörper (ANA), Anti-Doppelstrang-DNA-Antikörper (Anti-dsDNA) und Anti-Smith-Antikörper (Anti-Sm) sowie ein Komplementverbrauch von C3c und C4.
Die Organbeteiligungen können je nach Aggressivität der Erkrankung mild bis lebensbedrohlich sein.4 Entsprechend wichtig sind eine frühzeitige Diagnose und Einleitung einer Therapie zur Krankheitskontrolle, um chronische Schäden und damit verbundene Morbidität und Mortalität zu vermeiden.
Welche Bedeutung hat die Lupusnephritis und wie wird sie eingeteilt?
Die Lupusnephritis (LN) ist eine wichtige Organmanifestation und für die Diagnose stehen uns derzeit weder im Blut noch im Urin geeignete Biomarker zur Verfügung, sodass eine Nierenbiopsie zur Diagnosestellung empfohlen wird.5
Die Häufigkeit einer LN wird von der ethnischen Abstammung beeinflusst. Bei SLE-Patienten kaukasischer Herkunft liegt bei ca. 20–25% eine LN vor, bei Patienten aus dem südamerikanischen und afrikanischen Raum bei bis zu 50–60%. Entsprechend sollte bei diesen Patienten eine Nierenbiopsie grosszügiger in Betracht gezogen werden.6
Histologisch entspricht die LN einer Immunkomplex-Glomerulonephritis und wird anhand des Ausmasses und der Lokalisation der Inflammation in 6 Klassen eingeteilt:
-
Klasse I und II: milde renale Beteiligung mit Entzündung in nur einem Kompartiment des Glomerulus (Mesangium)
-
Klasse III und IV: schwere renale Beteiligung mit einer ausgeprägten Entzündung in mehreren Kompartimenten des Glomerulums (Mesangium, Kapillaren, Bowman’scher Kapselraum)
-
Klasse V: Sonderform mit Ablagerungen in der Basalmembran, einer membranösen Glomerulonephritis entsprechend
-
Klasse VI: Endstrecke der Erkrankung mit mehrheitlich sklerotischen Läsionen in den Glomerula
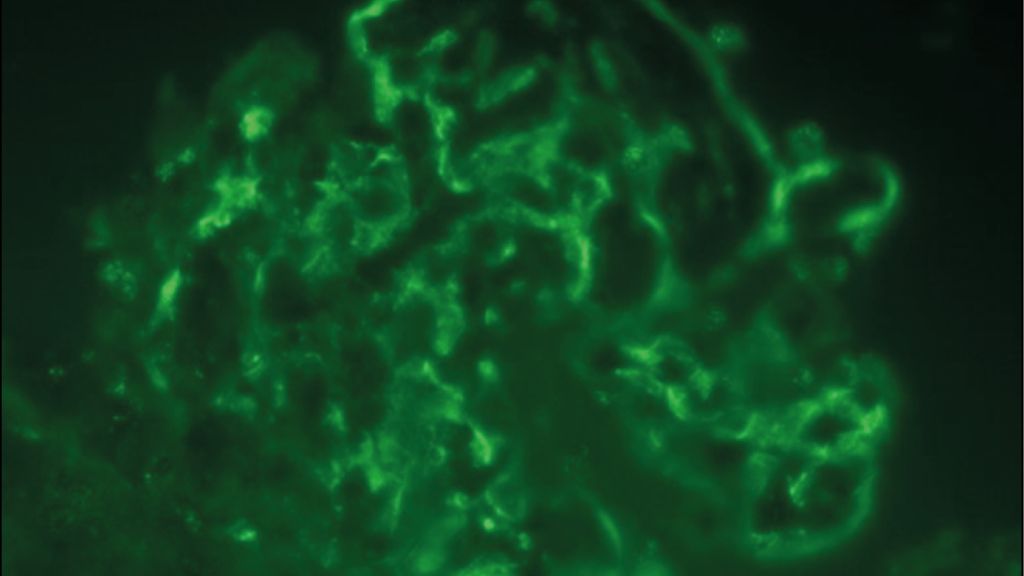
Exemplarisch sind in Abbildung 1 histologische Schnitte einer LN Klasse IV und V dargestellt, in welchen sich die typischen Läsionen in der Licht- und Elektronenmikroskopie sowie der Immunfluoreszenz finden. In den Klassen III und IV wird anhand eines standardisierten Index («NIH activity/chronicity index») das Ausmass an aktiven/entzündeten bzw. chronischen/vernarbten Läsionen angegeben.12 Das Ausmass der chronischen Läsionen hat eine prognostische Bedeutung und ist mit einem schlechteren renalen Überleben assoziiert.13,14
Abb. 1: Die histologischen Schnitte zeigen eine Lupusnephritis Klasse IV und V mit (A) endokapillärer Hyperzellularität und einem interstitiellen lymphohistiozytären Infiltrat in der Lichtmikroskopie (LM) und (B) klassischen subendothelialen und subepithelialen elektronendichten Depots sowie «reticular aggregates» in der Elektronenmikroskopie (EM). (C) Exemplarisch für die starke Positivität der Immunfluoreszenz (IF) in allen Untersuchungen (IgG, IgA, freie Leichtketten Kappa und Lambda, Komplementfaktor C3 und Antigen C1q entsprechend dem klassischen «full house» Muster) die IF für IgG
Wann sollte eine Nierenbiopsie erfolgen?
Zur Indikationsstellung für eine Nierenbiopsie werden sowohl in nationalen als auch internationalen nephrologischen und rheumatologischen Behandlungsrichtlinien die glomeruläre Mikrohämaturie und Proteinurie aufgeführt. Es besteht Einigkeit, dass eine Nierenbiopsie bei glomerulärer Mikrohämaturie und Proteinurie >500mg/d (geschätzt aus dem Spot-Urin oder aus einer 24h-Urinsammlung) durchgeführt werden sollte. Zu beachten ist, dass der Hintergrund dieser Empfehlung auf Überlegungen der Praktikabilität und der Invasivität der Diagnostik beruht und auf keinen wissenschaftlichen Daten gründet.5,7 Dazu im Kontrast stehen Untersuchungen an bis zu 275 SLE-Patienten, bei welchen bei einer Proteinurie <500mg/d in bis zu 50% eine LN Klasse III oder höher nachgewiesen werden konnte.8,9 Ähnlich gering korreliert die Reduktion der Proteinurie im Sinne einer kompletten/partiellen Remission mit der histologischen Krankheitsaktivität in der Niere. Bei Patienten mit wiederholten Nierenbiopsien während des Krankheitsverlaufes zeigen nur 25% mit kompletter Remission nach 12 Monaten auch histologisch keine Aktivität mehr. Bei Patienten mit partieller Remission war der Prozentsatz mit nur 17% noch niedriger.10
Entsprechend sollte die Entscheidung zur Nierenbiopsie mehr auf einer individualisierten Basis als anhand von einzelnen klinischen Parametern getroffen werden. Ein möglicher Algorithmus zum Zeitpunkt der Diagnosestellung ist in Abbildung 2 abgebildet. Wichtige weitere Zeitpunkte zur Evaluation einer Nierenbiopsie sind neben der Diagnosestellung des SLE ein fehlendes klinisches Ansprechen auf die Therapie 3 und 12–18 Monate nach Therapiebeginn.11
Abb. 2: Algorithmus zur Evaluation der Notwendigkeit einer Nierenbiopsie zum Zeitpunkt der Diagnosestellung des systemischen Lupus erythematodes (SLE) in Anlehnung an die internationalen nephrologischen Behandlungsempfehlungen (KDIGO 2024 Clinical Practical Guidelines for the Management of Lupus Nephritis)5
Welche Therapie sollte mit den Patienten besprochen werden?
Die Basis jeder SLE-Therapie stellt die Evaluation von individuellen und krankheitsspezifischen Risikofaktoren dar. Speziell für den SLE sollten neben dem allgemeinen kardiovaskulären Risiko (optimale Kontrolle des Blutdruckes und der Blutfettwerte) das erhöhte Risiko für Infektionen, die erhöhte Lichtempfindlichkeit der Haut sowie therapieassoziierte Risiken wie eine Osteoporose, eine Beeinträchtigung der Fertilität und die Entwicklung von Malignomen berücksichtigt werden.5 Aufgrund von ersten Real-Life-Daten aus einer grossen, multinationalen, multizentrischen Studie ist zudem anzunehmen, dass Sodium-Glukose-2-Transporter-Inhibitoren (SGLT2-I) ähnlich wie bei der chronischen Nephropathie anderer Ätiologie auch für die Reduktion der Proteinurie bei LN eine zentrale Rolle spielen könnten.22
Die Basismedikation mit Hydroxychloroquin (HCQ) ist unabhängig von der renalen Beteiligung ein wichtiger Eckpfeiler der Immunmodulation. Empfohlen wird eine Dosis von 5mg/kgKG, sofern keine Kontraindikationen vorliegen und das Präparat verfügbar ist.15 Die Empfehlung beruht auf verschiedenen Arbeiten, welche unter Therapie mit HCQ eine verbesserte Knochendichte, ein verbessertes Lipidprofil, eine geringere chronische Schädigung der beteiligten Organe, eine Reduktion des kardiovaskulären Risikos inklusive thrombotischer Ereignisse bei Patienten mit Anti-Phospholipid-Syndrom, ein verbessertes Ansprechen auf die immunsuppressive Therapie sowie ein häufigeres Erreichen einer klinischen Remission und eine Reduktion von Schüben der Erkrankung («flares») beschrieben haben.4,5,16
Aufgrund der möglichen Entwicklung einer Retinopathie unter HCQ sollten nach Behandlungsbeginn regelmässige opthalmologische Kontrollen erfolgen. Liegen Risikofaktoren wie eine begleitende Behandlung mit Tamoxifen, eine glomeruläre Filtrationsrate (eGFR) <60ml/min oder eine HCQ-Dosis >5mg/kgKG vor, wird empfohlen, die Kontrollen 12 Monate nach Therapiebeginn und anschliessend jährlich durchzuführen. Ohne diese Risikofaktoren kann das Screening 5 Jahre nach Therapiebeginn begonnen werden.16 Sobald die eGFR <30ml/min liegt, sollte zudem die Dosis um 25% reduziert werden.5
Neben HCQ richtet sich die Wahl der immunsuppressiven Therapie nach der Art und der Schwere der Organbeteiligung. Liegt eine LN vor, wird die Wahl der immunsuppressiven Therapie häufig hierdurch bestimmt. Eine LN Klasse I und II wird in der überwiegenden Mehrheit nicht mit einer immunsuppressiven Therapie behandelt, sondern mit generellen supportiven Massnahmen (optimale Kontrolle der kardiovaskulären Risikofaktoren, Reduktion der Proteinurie). Eine Ausnahme stellt ein begleitendes nephrotisches Syndrom dar, da in diesem Fall das Vorliegen einer Lupuspodozytopathie angenommen wird, die entsprechend einer «minimal change disease» mit hoch dosierten Steroiden behandelt werden sollte.
Vergleichbar wird eine isolierte LN Klasse V primär konservativ behandelt, sofern sich keine Komplikationen (Thrombose, Lipidstoffwechselstörungen, ausgeprägte Ödeme) durch die Proteinurie ergeben. Je nach Verlauf und Schwere der Proteinurie (z.B. bei einem nephrotischen Syndrom) stehen vergleichbare Therapieregime wie bei Klasse III und IV zur Verfügung.
Für eine LN Klasse III und IV wird neu eine multimodale Kombinationstherapie empfohlen. Mycophenolat mofetil (MMF) und Steroide bleiben als Basis die empfohlene Erstlinientherapie und können individualisiert entweder mit Cyclophosphamid (CYS), Belimumab oder Voclosporin ergänzt werden. Voclosporin ist nur in Kombination mit MMF zugelassen. Belimumab kann als 3-fach-Therapie entweder mit MMF oder CYS kombiniert werden (Abb. 3).5
Abb. 3: Behandlungsalgorithmus bei Lupusnephritis Klasse III/IV. Die Reihenfolge der Therapien stellt keine Präferenz der Behandlungsalternativen dar. Die immunsuppressive Therapie sollte immer gemeinsam mit einer generellen nephroprotektiven Therapie gegeben werden. Eine Kombination von Belimumab (BEL) ist für die Induktion mit Mycophenolat mofetil (MMF) oder Low- Dose-Cyclophosphamid (CYC) bzw. zur Erhaltungstherapie mit Azathioprin (AZA) oder MMF möglich. Der Calcineurininhibitor Voclosporin (VOC) kann mit MMF kombiniert werden (adaptiert nach Fanouriakis A et al.: Ann Rheum Dis 2024; 83: 15-29)
Belimumab ist ein rekombinanter, humaner monoklonaler IgG1λ-Antikörper, welcher einen B-Zell-Aktivierungsfaktor hemmt. In Studien kam es unter Therapie mit Belimumab zu einer Reduktion der Proteinurie, einem geringeren Abfall der Nierenfunktion, einer häufigeren klinischen und histologischen Remission sowie zu einem selteneren Auftreten von renalen Flares. Dies scheint vor allem bei Patienten mit einer Proteinurie <3g/d der Fall zu sein.19–21 Voclosporin ist ein Calcineurininhibitor, welcher zu einer rascheren Senkung der Proteinurie und damit einer klinischen Remission beiträgt. Effekte auf die Nierenfunktion konnten bisher noch nicht dargestellt werden. Besonders effektiv scheint der Einsatz bei Patienten mit einer Proteinurie >3g/d zu sein.
Für therapierefraktäre Verläufe wird Cyclophosphamid oder Rituximab als Eskalation empfohlen.4,5 Ein grosser Vorteil der Kombinationstherapie ist eine rasche und frühzeitige Reduktion der begleitenden Steroidtherapie, da diese als massgeblicher Faktor für die Entwicklung von Infektionen und die damit verbundene Mortalität identifiziert werden konnte.17,18 Entsprechend wird empfohlen, die perorale Steroidtherapie nach 12 Monaten komplett zu sistieren, sofern dies von der Krankheitsaktivität her vertretbar ist.5 Weitere Vorteile sind eine höhere Wahrscheinlichkeit für eine frühzeitige Remission und somit ein Vermeiden bzw. eine Reduktion der chronischen Schäden.
Nach der Induktionstherapie sollte sich eine Erhaltungstherapie, vorzugsweise mit MMF bzw. Azathioprin (AZA) als Alternativpräparat bei Unverträglichkeit/Kontraindikationen, anschliessen. Die Dauer der immunsuppressiven Therapie sollte insgesamt mindestens 3 Jahre betragen, wobei in den rheumatologischen Behandlungsrichtlinien zusätzlich eine Remission (komplett/partiell) von mindestens 2 Jahren gefordert wird.4,5
Die bessere Kontrolle der Krankheitsaktivität bedeutet allerdings für die Patienten eine Zunahme der Medikamentenlast, ein erhöhtes Risiko für Infektionen und geht mit höheren Therapiekosten für die Allgemeinheit einher, weswegen eine individualisierte Entscheidung über die Kombination der zur Verfügung stehenden Therapieoptionen erfolgen sollte. Eine Möglichkeit zur individualisierten Entscheidung ist in Abbildung 4 dargestellt.
Abb. 4: Wahl der Multitargettherapie. Gegenüberstellung der aktuell zur Verfügung stehenden Behandlungsalternativen für den Einsatz einer Multitargettherapie. Bevorzugter Einsatz von Belimumab bei einer glomerulären Filtrationsrate (eGFR) von <45ml/min/1,73m2, verstärkter extrarenaler Aktivität, einem erhöhten Risiko für einen Lupusschub sowie bei Adhärenzproblemen. Bevorzugte Gabe von Voclosporin bei einer Proteinurie >3g/d sowie der Notwendigkeit einer raschen Steroidreduktion (adaptiert nach Frangou E et al. 2024)23
Literatur:
1 Pons-Estel GJ et al.: Semin Arthritis Rheum 2010; 39: 257-68 2 Lahita RG: Curr Opin Rheumatol 1999 ; 11: 352-6 3 Cervera R et al.: Medicine (Baltimore) 2003; 82: 299-308 4 Aringer M et al.: Arthritis Rheumatol 2019; 71: 1400-12 5 Rovin BH et al.: Kidney Int 2024; 105: 31-4 6 Alarcon GS et al.: Lupus 2002; 11: 95-101 7 Mucke J, Aringer M et al.: Z Rheumatol 2024; 83: 431-8 8 Christopher-Stine L et al.: J Rheumatol 2007; 34: 332-5 9 Al Arfaj AS, Khalil N: Saudi J Kidney Dis Transpl 2023; 34: 154-609: 38146725 10 Malvar A et al.: Nephrol Dial Transplant 2017; 32: 1338-44 11 Rodriguez-Ramirez S et al.: Kidney Med 2023; 6: 100772 12 Bajema IM et al.: Kidney Int 2018; 93: 789-96 13 Nakagawa S et al.: Lupus 2021; 30: 1739-46 14 Sun YS et al.: Rheumatol (Oxford) 2024; 63: 2467-72 15 Jorge AM et al.: JAMA 2022; 328: 1458-60 16 Peña-Vizcarra ÓR et al.: Rheumatol (Oxford) 2024; 63: 2230-8 17 Obrișcă B et al.: Clin Rheumatol 2021; 40 3285-97 18 Frodlund M et al.: Rheumatol (Oxford) 2024; 63: 1104-12 19 Furie R et al.: N Engl J Med 2020; 383: 1117-28 20 Rovin BH et al.: Kidney Int 2022; 101: 403-13 21 Anders HJ et al.: Nephrol Dial Transplant 2023; 38: 2733-42 22 Caravaca-Fontán F et al.: Nephrol Dial Transplant 2024; 39: 328-40 23 Frangou E et al.: Nephrol Dial Transplant 2024; 39: 727-30
Das könnte Sie auch interessieren:
Neue Klassifikation soll für mehr Klarheit sorgen
Die Glomerulonephritis ist eine komplizierte Angelegenheit. Das liegt auch daran, dass die immunvermittelten Erkrankungen anhand von histopathologischen Mustern beschrieben werden, die ...
Therapie der ANCA-assoziierten Vaskulitis: Gibt es steroidfreie Alternativen?
Noch in den 1950er-Jahren verstarben rund 90% der Patient:innen, die an einer mit antineutrophilen zytoplasmatischen Antikörpern (ANCA) assoziierten Vaskulitis litten, im ersten Jahr ...
Spannende Fälle
Neben ihren Forschungsergebnissen stellten Schweizer Nephrologinnen und Nephrologen am Jahreskongress 2024 in Basel auch einige spannende und lehrreiche Fälle vor. Wir präsentieren Ihnen ...