Positiver Effekt auf MS-Progression und Kognition
Bericht:
Dr. med. Alexander Kretzschmar
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Neue Analysen der Phase-III-Studien und ihrer offenen Extensionsstudien (DAYBREAK) unterstützen die Evidenz, dass sich die Therapie mit dem S1P-Modulator Zeposia® (Ozanimod)1 positiv auf die schubassoziierte (RAW: «relapse-associated worsening») sowie die schubfreie (PIRA: «progression independent of relapse activity») Pathologie der schubförmig-remittierten MS (RRMS) auswirkt.1, 2 Davon profitiert auch die kognitive Leistungsfähigkeit als wichtiger Patient:innen-assoziierter Outcomefaktor, unterstrich Prof. Eleonora Cocco, Cagliari, auf der ACTRIMS-ECTRIMS-Jahrestagung 2023 in Mailand.
Neurodegenerative Krankheitsprozesse lassen sich bei der MS nach aktuellem Kenntnisstand bereits in einem sehr frühen Stadium der MS unabhängig von klinisch sichtbaren Symptomen und sogar schon vor der definitiven Diagnose einer manifesten MS, nachweisen. Dieser Teil der MS-Pathogenese wird unter dem Akronym PIRA («progression independent of relapse activity») zusammengefasst.3–5 PIRA ist kein rein theoretisches Konstrukt, sondern erklärt auch viele Aspekte der klinischen Behinderungsprogression, unterstrich Dr. Carmen Tur, Barcelona.
Je früher PIRA bei einem Patienten auftritt, desto eher muss mit bleibenden Einschränkungen und Behinderungen gerechnet werden.3 Symptome innerhalb von PIRA können sein:6, 7
-
Sukzessiv nachlassende Gehfähigkeit
-
Nachlassende Feinmotorik
-
Subtile Verschlechterung der Kognition
PIRA führt nicht nur zu einer Verschlechterung der Gehfähigkeit sowie der Feinmotorik.6 Inzwischen wurde gezeigt, dass die bei zahlreichen Fällen schon früh nachweisbare Verschlechterung der Kognition nicht nur eine Folge von Schubereignissen («relapse-associated worsening»; RAW) ist, sondern auch des unter einer PIRA stattfindenden schleichenden (auch als «silent» oder «smoldering» bezeichnet) pathologischen Krankheitsprozesses.7, 8
Ozanimod: positiver Einfluss auf RAW und PIRA
Als neuroanatomisches Korrelat der Kognition gilt ein pathologisch erhöhter Hirnvolumenverlust in allen Stadien der MS.9 Besonders der Erhalt des Thalamusvolumens korreliert mit einem verbesserten kognitiven Langzeitverlauf, bestätigte Prof. Cocco.10 Die Neurologin verwies hierzu auf neuere Analysen der Phase-III-Studie SUNBEAM und der OLE DAYBREAK, in denen diese Aspekte für die Therapie mit Ozanimod untersucht wurden.11
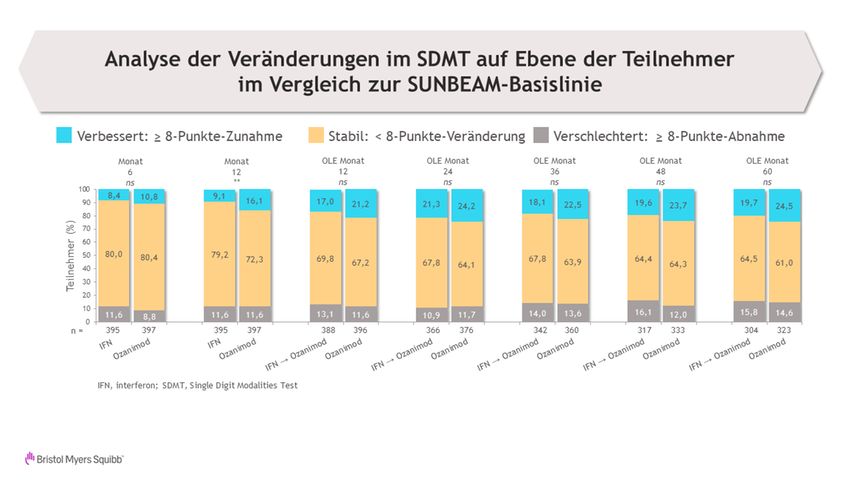
In der SUNBEAM-Studie verzeichneten nach 12-monatiger Therapie signifikant mehr Patient:innen mit Ozanimod eine klinisch relevante Verbesserung von ≥ 8 Punkten im Symbol Digit Modalities Test (SDMT) im Vergleich zur Therapie mit Interferon(IFN)-beta-1a (16,1% vs. 9,1%; p < 0,01). Der Vorteil einer frühen Therapie mit Ozanimod zeigte sich auch in DAYBREAK. Dort erreichten nach 5–7-jähriger kontinuierlicher Therapie numerisch mehr Patient:innen unter Ozanimod eine Verbesserung von ≥ 8 Punkten im SDMT im Vergleich zu der Gruppe, die erst in DAYBREAK von IFN-beta-1a zu Ozanimod umgestellt wurde (Abb. 1).11 Dies zeigt, dass die Therapie mit Ozanimod von Beginn an besser geeignet ist, die Patient:innen vor einer kognitiven Verschlechterung zu schützen, so Prof. Cocco.
Abb. 1: Verbesserung der Kognition ≥ 8 Punkte im Symbol Digit Modalities Test (SDMT) versus Interferon(IFN)-beta 1a; Daten aus der Phase-III-Studie SUNBEAM und der DAYBREAK-Extensionsstudie (mod. nach De Luca J et al., 2023)11
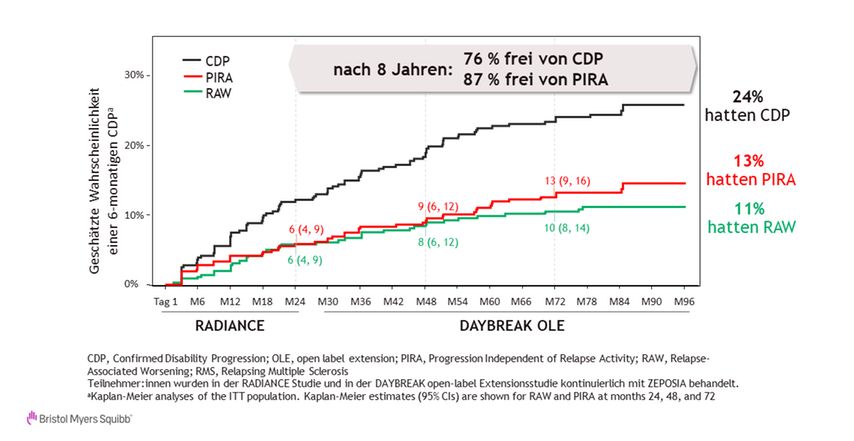
Prof. Filippi et al. konnten darüber hinaus nachweisen, dass sich die Therapie mit Ozanimod offenbar positiv auf die schubassoziierte sowie die schubfreie RAW- bzw. PIRA-Pathologie der schubförmig-remittierten MS (RRMS) auswirkte. Von den in der Phase-III-Studie RADIANCE und der OLE DAYBREAK behandelten RRMS-Patient:innen waren nach 8 Jahren 87% frei von PIRA und 76% frei von einer bestätigten Behinderungsprogression (Abb. 2).
Abb. 2: RAW und PIRA bei RMS-Patient:innen unter Ozanimod aus den Studien RADIANCE und DAYBREAK OLE. PIRA stabilisierte sich nach 5 Jahren kontinuierlicher Behandlung mit 0,92 mg Ozanimod (mod. nach Filippi M et al., 2023)2
Gehirn und Kognition vor Schaden schützen
Die derzeit laufende multizentrische, einarmige, offene Longitudinalstudie ENLIGHTEN untersucht die Zusammenhänge zwischen der Gabe von DMT, Hirnvolumenverlust und kognitiver Verarbeitungsgeschwindigkeit (CPS) bei der frühen RRMS unter dreijähriger Behandlung mit Ozanimod. Eine Interimsanalyse nach einem Jahr zeigte für die Ozanimod-Gruppe (n = 98) einen Verlust an Gesamthirnvolumen, der mit demjenigen gesunder Personen identisch ist (mittlere Veränderung –0,28 %). Das Volumen des Thalamus und der kortikalen grauen Substanz blieb stabil. Dies deutet darauf hin, dass das Hirnvolumen während des ersten Jahres unter Ozanimod bei Patient:innen mit früher RRMS erhalten bleibt, kommentierte Prof. Cocco die Ergebnisse.12
Sponsored Content
Mit freundlicher Unterstützung durch Bristol-Myers Squibb SA
2084-CH-2400060, 05/2024
Quelle:
Satellitensymposium «The latest developments in MS classification and treatment: from AI to clinical decision making» im Rahmen der ACTRIMS-ECTRIMS-Jahrestagung am 11. Oktober 2023 in Mailand
Literatur:
Fachinformation Zeposia®(Ozanimod), aktueller Stand; www.swissmedicinfo.ch
Filippi M et al.: Relapse-associated worsening and progression-independent relapse activity in ozanimod-treated participants with relapsing multiple sclerosis from the RADIANCE and DAYBREAK trials. ACTRIMS-ECTRIMS Oktober 2023; Abstract P368
Lublin F et al.: How patients with multiple sclerosis acquire disability. Brain 2022; 145(2): 569-83
Kappos L et al.: Contribution of relapse-independent progression vs relapse-associated worsening to overall confirmed disability accumulation in typical relapsing multiple sclerosis in a pooled analysis of 2 randomized clinical trials. JAMA Neurol 2020; 77(9): 1132-40
Tur C et al.: Association of early progression independent of relapse activity with long-term disability after a first demyelinating event in multiple sclerosis. JAMA Neurol 2023; 80(2): 151-60
Cree B et al.: Silent progression in disease activity-free relapsing multiple sclerosis. Ann Neurol 2019; 85: 653-66
Giovannoni G et al.: Smouldering multiple sclerosis: the “real MS”. Ther Adv Neurol Disord 2022; 15: 17562864211066751
Benedict RHB et al.: Cognitive impairment in multiple sclerosis: clinical management, MRI, and therapeutic avenues. Lancet Neurol 2020; 19(10): 860-71
De Stefano N et al.: Assessing brain atrophy rates in a large population of untreated multiple sclerosis subtypes. Neurology 2010; 74(23): 1868-76
Cabrera DV et al.: Diffusion imaging of fornix and interconnected limbic deep grey matter is linked to cognitive impairment in multiple sclerosis. Eur J Neurosci 2022; 55(1): 277-94
DeLuca J et al.: Eight-point reliable change on Symbol Digit Modalities Test with ozanimod: findings from the phase 3 SUNBEAM and DAYBREAK extension trials. ACTRIMS-ECTRIMS Oktober 2023; Abstract P727
Zivadinov R et al.: Brain volume changes over 1 year in ozanimod-treated patients with early relapsing multiple sclerosis: an interim analysis of the ENLIGHTEN study. ACTRIMS-ECTRIMS Oktober 2023; Abstract P1311
Gekürzte Fachinformation Zeposia® (Ozanimod)
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Für weitere Informationen siehe Fachinformation Zeposia® auf www.swissmedicinfo.ch .
I: Multiple Sklerose (MS): Indiziert zur Behandlung von erwachsenen Patienten mit schubförmig remittierend verlaufender MS. Colitis Ulcerosa (CU): Indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer aktiver CU, die entweder auf konventionelle Therapien oder die Behandlung mit einem Biologikum ungenügend angesprochen haben, nicht mehr ansprechen oder die Therapie nicht tolerierten. D: Hartkapseln 0.23/0.46/0.92 mg oral einmal täglich. Dosistitrationsschema: Tag 1–4: 0.23 mg; Tag 5–7: 0.46 mg; ab Tag 8: 0.92 mg. KI: Überempfindlichkeit gegen Wirk-/Hilfsstoffe; Behandlung nicht beginnen bei Patienten, die in den letzten 6 Monaten folgende Erkrankungen hatten: Myokardinfarkt, instabile Angina pectoris, Schlaganfall, transitorische ischämische Attacke, dekompensierte Herzinsuffizienz mit erforderlicher Hospitalisierung, Herzinsuffizienz Klasse III/IV, anamnestisch bekannter oder aktuell vorliegender atrioventrikulärer (AV) Block zweiten Grades (Typ II), AV-Block dritten Grades, sinuatrialer Block, Sinusknotensyndrom (ohne funktionstüchtigen Herzschrittmacher); schwere unbehandelte Schlafapnoe; immundefizienter Zustand; erhöhtes Risiko für opportunistische Infektionen; schwere aktive oder aktive chronische Infektionen (Hepatitis, Tuberkulose); aktive maligne Erkrankung; schwere Leberinsuffizienz; bestehendes Makulaödem; Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Methode zur Empfängnisverhütung anwenden. WH/VM: Vor Therapieeinleitung: kardiale Untersuchung (EKG), Leberfunktionstest, grosses Blutbild (BB), ophthalmologische und dermatologische Untersuchung, Untersuchung der Lungenfunktion bei Patienten mit schweren Lungenerkrankungen, Begleitmedikationen prüfen. Während der ersten Zeposia® Gabe kann es zu einer vorübergehenden Abnahme der Herzfrequenz kommen; bei Patienten mit vorbestehenden Herzerkrankungen ist eine Überwachung bei der ersten Gabe empfohlen. Erhöhungen von Aminotransferasen sind möglich und werden regelmässig überwacht. Zeposia® hat eine immunsuppressive Wirkung, die Patienten für ein Infektionsrisiko prädisponiert. Es sollte ein Sonnenschutz verwendet werden, keine gleichzeitige Phototherapie (UVB, PUVA-Photochemotherapie). Während der Behandlung sollten regelmässig ein BB, ein Leberfunktionstest, ein Blutdrucktest und eine augenärztliche Untersuchung bei Patienten mit Uveitis, Diabetes mellitus oder einer zugrundeliegenden/begleitenden Netzhauterkrankung durchgeführt werden. Bei bestätigter Gesamtlymphozytenzahl < 0.2 × 109/l oder bei bestätigtem Makulaödem Behandlung unterbrechen. Impfung gegen VZV ohne dokumentierte Immunität ≥ 1 Monat vor Beginn empfohlen. UW: Sehr häufig (≥ 10 %): Nasopharyngitis, Lymphopenie. Häufig (≥ 1 %, < 10 %): Pharyngitis, virale Atemwegsinfektion, Harnwegsinfektion, Herpes Zoster, Herpes simplex, Kopfschmerzen, Lungenfunktionstest abnormal, Bradykardie, Hypertonie, orthostatische Hypotension, ALT, GGT und Bilirubin erhöht, periphere Ödeme. P: Zeposia® Starterpackung: 7 Hartkapseln (4 × 0.23 mg, 3 × 0.46 mg); Zeposia® 0.92 mg: 28 Hartkapseln. Abgabekategorie B. Vollständige Fachinformation unter www.swissmedicinfo.ch . Bristol Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Stand der Information: März 2025.
Literatur auf Anfrage