Zeposia® (Ozanimod) als attraktive Option
Bericht:
Dr. med. Alexander Kretzschmar
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei der Auswahl einer geeigneten krankheitsmodifizierenden Therapie (DMT) ist eine individuelle Stratifizierung des Infektionsrisikos vor und nach Therapiebeginn sinnvoll. Neue Auswertungen der Phase-III-Studien SUNBEAM und RADIANCE sowie der offenen Extensionsstudie (OLE) DAYBREAK zeigen, dass unter Therapie mit dem S1P-Modulator Ozanimod auch im Langzeitverlauf das Infektionsrisiko gering ist und nicht mit der absoluten Lymphozytenzahl (ALC; absolute lymphocyte count) korreliert. Bei Patient:innen, die unter Ozanimod einen anhaltend niedrigen ALC von ≤ 0,2 × 109/l entwickelten, stieg der ALC in der überwiegenden Mehrzahl der Fälle nach Therapieunterbrechung auf einen Wert von ≥ 0,5 × 109/l. Eine aktuelle Observationsstudie weist auf Ozanimod als Switch-Option bei Patient:innen mit schwerer Fingolimod-assoziierter Lymphopenie hin.
Für die Therapie der MS stehen heute zahlreiche, teilweise sehr hochwirksame DMT zur Verfügung, die gezielt in das Immunsystem eingreifen. Dadurch kann das Risiko von Infektionen erhöht werden.1 Die während der Corona-Pandemie gemachten Erfahrungen zeigen auch, dass die verschiedenen DMT auch die Impfantwort beeinflussen können.2 Die Auswahl einer geeigneten DMT sollte daher auch unter Berücksichtigung möglicher therapieassoziierter Infektionsrisiken erfolgen.3 Im Zusammenhang mit dem Einsatz von S1P-Modulatoren wird oft die Frage gestellt, ob transiente Lymphopenien mit einer erhöhten Infektionsgefahr assoziiert sind: Periphere Lymphopenien sind Teil des Wirkmechanismus von S1P-Modulatoren wie Fingolimod oder Ozanimod. Der Rückgang des Anteils zirkulierender Lymphozyten resultiert daraus, dass unerwünschte autoreaktive proinflammatorische Lymphozyten in den Lymphknoten zurückgehalten werden.4 Das Verbleiben in Lymphknoten betrifft vor allem naive T-Zellen sowie zentrale T-Gedächtniszellen, während Effektor-Gedächtnis-T-Zellen, die eine wichtige Rolle bei Immunantworten bei Infektionen spielen, weitgehend ausgespart bleiben.5
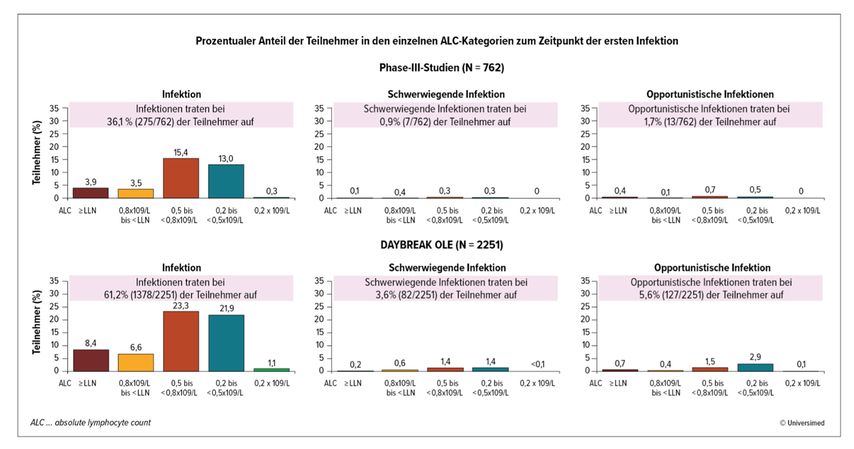
In den Phase-III-Studien SUNBEAM und RADIANCE sowie der OLE DAYBREAK traten nur selten ernste Infektionen unter Ozanimod auf.6–8 Auf der ACTRIMS-ECTRIMS-Jahrestagung 2023 wurden neue Daten vorgestellt, die bei Ozanimod keine Korrelation zwischen der Höhe der Lymphozytenzahl im Blut und der Infektionsneigung fanden.9 Hartung et al. untersuchten bei den Teilnehmern der SUNBEAM- und RADIANCE-Studie (n = 762) sowie der DAYBREAK-OLE (n = 2251) die Beziehung zwischen der Höhe des ALC zum Zeitpunkt der ersten Infektion und dem Risiko einer ersten Infektion aller Schweregrade, einer ernsten Infektion sowie einer opportunistischen Infektion.9 In den Phase-III-Studien SUNBEAM/RADIANCE betrug die Häufigkeit von
-
Infektionen aller Schweregrade: 36,1 %,
-
ernsten Infektionen: 0,9 % sowie
-
opportunistischen Infektionen: 1,7 %.
In der OLE DAYBREAK traten Infektionen insgesamt etwas häufiger auf als in den Phase-III-Studien:
-
Infektionen aller Schweregrade: bei 61,2 %,
-
ernste Infektionen: bei 3,6 % sowie
-
opportunistische Infektionen: 5,6 %.
Bei der Mehrzahl der Patient:innen (Infektionen aller Schweregrade, ernste und opportunistische Infektionen) lag der ALC zum Zeitpunkt der ersten Infektion im Bereich von 0,5–0,8 x 109/l bzw. 0,2 – <0,5 x 109/l. Bei Patient:innen mit sehr geringen Lymphozytenzahlen (ALC < 0,2 x 109/l) waren erstmalig auftretende Infektionen jeglicher Art noch deutlich seltener (Abb. 1).9
Abb. 1: Patient:innen mit Infektionen (Infektionen aller Schweregrade, ernsten Infektionen und opportunistischen Infektionen) in SUNBEAM, RADIANCE und DAYBREAK (mod. nach Hartung HP et al., 2023)9
Zusammenfassend fanden die Autoren keinen Hinweis auf eine Beziehung zwischen den Lymphozytenzahlen und dem Risiko einer Infektion jeglicher Art. Es fand sich auch kein klarer Trend hinsichtlich der Häufigkeit von Infektionen und dem ALC-Nadir.9
Selmaj et al. fanden in DAYBREAK in 10,8 % der Fälle unter Therapie mit Ozanimod mindestens einen ALC < 0,2 × 109/l.10 Insgesamt 1,2 % der Patient:innen entwickelten einen anhaltenden, bestätigten ALC < 0,2 × 109/l. Im weiteren Behandlungsverlauf erholten sich die Lymphozytenzahlen bei den meisten Patient:innen nach Unterbrechung oder Fortsetzung der Therapie mit Ozanimod bis zu einem ALC ≥ 0,2 × 109/l und zwar in
-
80,8 % der Fälle innerhalb von 1 Monat bzw.
-
92,3 % der Fälle nach 3 Monaten und
-
96,2 % der Fälle nach 6 Monaten.10
76,9 % der Patient:innen erreichten einen ALC ≥ 0,5 × 109/l innerhalb von 3 Monaten; 92,3 % erholten sich innerhalb von 6 Monaten.10
Ozanimod als Switch-Option bei schwerer Fingolimod-assoziierter Lymphopenie
Ozanimod wird aufgrund seiner im Vergleich zu Fingolimod selektiveren Bindung an den S1P1- und an S1P5-Subtypen mit einer geringeren Rate therapieinduzierter Lymphopenien assoziiert.11 Eine aktuelle Real-World-Observationsstudie einer italienischen Arbeitsgruppe untersuchte jetzt Ozanimod als Option für einen Switch bei Patient:innen mit schwerer Fingolimod-assoziierter Lymphopenie, die ein Absetzen von Fingolimod erfordert.12 Die 18 Teilnehmer:innen der Observationsstudie waren im Mittel 47,7 Jahre alt, die Erkrankungsdauer betrug 13,9 Jahre, der mediane EDSS 3,0. In 13 Fällen lag eine Fingolimod-assoziierte Lymphopenie vom Grad 3–4 vor, die ein Absetzen von Fingolimod erzwang. Die Patient:innen wurden auf Ozanimod umgestellt und der weitere Krankheitsverlauf über eine Dauer von 6 Monaten nachverfolgt. Nach 6-monatiger Therapie mit Ozanimod litten lediglich noch 2 Patient:innen an einer Lymphopenie vom Grad 3; kein Patient hatte eine Lymphopenie vom Grad 4. Der klinisch-neurologische Status blieb im Beobachtungszeitraum stabil. Neue unerwünschte Ereignisse, insbesondere neue Infektionen, traten nicht auf.12
Die Autoren folgern aus den Ergebnissen, dass Patien:tinnen, bei denen Fingolimod wegen Entwicklung einer schweren Lymphopenie abgesetzt werden muss, von einem Switch auf Ozanimod profitieren.12
Literatur:
Williamson EM et al.: Infection risk in patients on multiple sclerosis therapeutics. CNS Drugs 2015; 29: 229-244
Tur C et al.: The risk of infections for multiple sclerosis and neuromyelitis optica spectrum disorder disease-modifying treatments: Eighth European Committee for Treatment and Research in Multiple Sclerosis Focused Workshop Review. April 2021. MSJ 2022; 28(9): 1424-1456
Pawlitzki M et al.: Risiken und Chancen von Immuntherapien in Zeiten der Coronavirus-2019-Pandemie. DGNeurologie 2020; 3(4): 285-297
Scott FL et al.: Ozanimod (RPC1063) is a potent sphingosine-1-phosphate receptor-1 (S1P1) and receptor-5 (S1P5) agonist with autoimmune disease-modifying activity. Br J Pharmacol 2016; 173: 1778-92
Mehling M et al.: FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis. Neurology 2008; 71(16): 1261-1267
Comi G et al.: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (SUNBEAM): a multicentre, randomised, minimum 12-month, phase 3 trial. Lancet Neurol 2019; 18: 1009-20
Cohen JA et al.: Safety and efficacy of ozanimod versus interferon beta-1a in relapsing multiple sclerosis (RADIANCE): a multicentre, randomised, 24-month, phase 3 trial. Lancet Neurol 2019; 18: 1021-1033
Cree BAC et al.: Long-term safety and efficacy of ozanimod in relapsing multiple sclerosis: Up to 5 years of follow-up in the DAYBREAK open-label extension trial. Mult Scler 2022; 28: 1944-1962
Hartung HP et al.: Absolute lymphocyte count around infections during phase 3 and open-label extension trials of ozanimod in participants with relapsing multiple sclerosis. ACTRIMS-ECTRIMS 2023; Poster P306
Selmaj K et al.: Impact of ozanimod on absolute lymphocyte count stability and recovery over time in participants with relapsing multiple sclerosis. ACTRIMS-ECTRIMS 2023; Poster P1487
Swallow E et al.: Comparative safety and efficacy of ozanimod versus fingolimod for relapsing multiple sclerosis. J Comp Eff Res 2020; 9: 275-285
Caliendo D et al.: Switching to ozanimod as a strategy to adjust fingolimod-related lymphopenia. Mult Scler Relat Disord 2024; 81: 105135
Literatur auf Anfrage
Gekürzte Fachinformation Zeposia® (Ozanimod)
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Für weitere Informationen siehe Fachinformation Zeposia® auf www.swissmedicinfo.ch .
I: Multiple Sklerose (MS): Indiziert zur Behandlung von erwachsenen Patienten mit schubförmig remittierend verlaufender MS. Colitis Ulcerosa (CU): Indiziert zur Behandlung von erwachsenen Patienten mit mittelschwerer bis schwerer aktiver CU, die entweder auf konventionelle Therapien oder die Behandlung mit einem Biologikum ungenügend angesprochen haben, nicht mehr ansprechen oder die Therapie nicht tolerierten. D: Hartkapseln 0.23/0.46/0.92 mg oral einmal täglich. Dosistitrationsschema: Tag 1–4: 0.23 mg; Tag 5–7: 0.46 mg; ab Tag 8: 0.92 mg. KI: Überempfindlichkeit gegen Wirk-/Hilfsstoffe; Behandlung nicht beginnen bei Patienten, die in den letzten 6 Monaten folgende Erkrankungen hatten: Myokardinfarkt, instabile Angina pectoris, Schlaganfall, transitorische ischämische Attacke, dekompensierte Herzinsuffizienz mit erforderlicher Hospitalisierung, Herzinsuffizienz Klasse III/IV, anamnestisch bekannter oder aktuell vorliegender atrioventrikulärer (AV) Block zweiten Grades (Typ II), AV-Block dritten Grades, sinuatrialer Block, Sinusknotensyndrom (ohne funktionstüchtigen Herzschrittmacher); schwere unbehandelte Schlafapnoe; immundefizienter Zustand; erhöhtes Risiko für opportunistische Infektionen; schwere aktive oder aktive chronische Infektionen (Hepatitis, Tuberkulose); aktive maligne Erkrankung; schwere Leberinsuffizienz; bestehendes Makulaödem; Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Methode zur Empfängnisverhütung anwenden. WH/VM: Vor Therapieeinleitung: kardiale Untersuchung (EKG), Leberfunktionstest, grosses Blutbild (BB), ophthalmologische und dermatologische Untersuchung, Untersuchung der Lungenfunktion bei Patienten mit schweren Lungenerkrankungen, Begleitmedikationen prüfen. Während der ersten Zeposia® Gabe kann es zu einer vorübergehenden Abnahme der Herzfrequenz kommen; bei Patienten mit vorbestehenden Herzerkrankungen ist eine Überwachung bei der ersten Gabe empfohlen. Erhöhungen von Aminotransferasen sind möglich und werden regelmässig überwacht. Zeposia® hat eine immunsuppressive Wirkung, die Patienten für ein Infektionsrisiko prädisponiert. Es sollte ein Sonnenschutz verwendet werden, keine gleichzeitige Phototherapie (UVB, PUVA-Photochemotherapie). Während der Behandlung sollten regelmässig ein BB, ein Leberfunktionstest, ein Blutdrucktest und eine augenärztliche Untersuchung bei Patienten mit Uveitis, Diabetes mellitus oder einer zugrundeliegenden/begleitenden Netzhauterkrankung durchgeführt werden. Bei bestätigter Gesamtlymphozytenzahl < 0.2 × 109/l oder bei bestätigtem Makulaödem Behandlung unterbrechen. Impfung gegen VZV ohne dokumentierte Immunität ≥ 1 Monat vor Beginn empfohlen. UW: Sehr häufig (≥ 10 %): Nasopharyngitis, Lymphopenie. Häufig (≥ 1 %, < 10 %): Pharyngitis, virale Atemwegsinfektion, Harnwegsinfektion, Herpes Zoster, Herpes simplex, Kopfschmerzen, Lungenfunktionstest abnormal, Bradykardie, Hypertonie, orthostatische Hypotension, ALT, GGT und Bilirubin erhöht, periphere Ödeme. P: Zeposia® Starterpackung: 7 Hartkapseln (4 × 0.23 mg, 3 × 0.46 mg); Zeposia® 0.92 mg: 28 Hartkapseln. Abgabekategorie B. Vollständige Fachinformation unter www.swissmedicinfo.ch . Bristol Myers Squibb SA, Hinterbergstrasse 16, 6312 Steinhausen. Stand der Information: März 2025.
Literatur auf Anfrage
Entgeltlicher Beitrag
Mit freundlicher Unterstützung durch Bristol-Myers Squibb GmbH
2084-CH-2400064, 06/2024