Allo-CAR-T-Zellen als Off-the-shelf-Produkte
Autorin:
Univ.-Prof. Dr. Hildegard Greinix
Klinische Abteilung für Hämatologie, Medizinische Universität Graz
E-Mail: hildegard.greinix@medunigraz.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Allogene CAR-T-Zellen, die aus Lymphozyten eines gesunden Spenders gentechnisch hergestellt werden, haben viele Vorteile gegenüber autologen, da sie rasch verfügbar sind, in Hinblick auf ihre Qualität standardisiert werden können und aus gesunden T-Zellen hergestellt werden. Weitere Verbesserungen im Herstellungsprozess der allogenen CAR-T-Zellen sind allerdings erforderlich, um ihre In-vivo-Expansion und -Persistenz zu verbessern und damit ihre Antitumorwirkung zu verstärken.
Keypoints
-
Allogene CAR-T-Zellen können durch gentechnische Modifikationen gesunder Spenderlymphozyten hergestellt werden.
-
Sie haben sich in klinischen Studien als wirksam und sicher herausgestellt.
-
Ihre Expansion und Persistenz nach Infusion sollten noch verbessert werden, um die langfristigen Therapieansprechraten zu erhöhen.
-
Sie stellen eine interessante, rasch verfügbare, logistisch weniger fordernde und wahrscheinlich kostengünstigere Alternative zu autologen CAR-T-Zell-Produkten dar.
Autologe, gentechnisch modifizierte T-Lymphozyten einschließlich der chimären Antigenrezeptor(CAR)-T-Zellen sind aufgrund ausgezeichneter Studienergebnisse von den Behörden für die Therapie von Patienten mit rezidivierten/refraktären diffusen großzelligen B-Zell Lymphomen (DLBCL), Mantelzelllymphomen, follikulären Lymphomen, akuten lymphatischen Leukämien (ALL) und multiplen Myelomen zugelassen worden.
Mittels eines in der Regel viralen Vektors werden Proteinbestandteile in T-Zellen eingeschleust, sodass sie eine bestimmte Zielstruktur auf Tumorzellen selektiv erkennen, nach Infusion an diese andocken, aktiviert und stimuliert werden und diese Tumorzellen zum Absterben bringen. Autologe CAR-T-Zellen werden individuell für jeden einzelnen Patienten innerhalb von 2 bis 5 Wochen hergestellt und variieren in der Zusammensetzung der unterschiedlichen T-Zell-Subgruppen sehr, da alle Patienten bereits Chemo-Immuntherapien hinter sich haben, die zusammen mit ihrer hämatologischen Erkrankung das Immunprofil der einzelnen Patienten sehr beeinträchtigen. Daher gibt es von medizinisch-wissenschaftlicher Seite das Bestreben, T-Zell-Produkte von gesunden Spendern herzustellen, die dann für alle Patienten umgehend ohne lange Produktionsdauer und aufwendige Logistik mit einheitlicher T-Zell-Zusammensetzung zur Verfügung stehen.
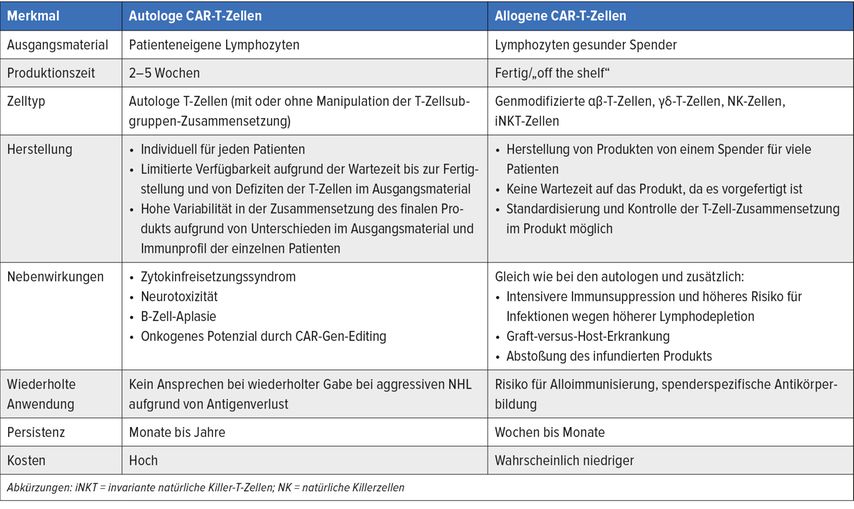
Die Vor- und Nachteile der autologen wie der allogenen CAR-T-Zellprodukte sind in Tabelle 1 dargestellt.
Tab. 1: Unterschiede zwischen autologen und allogenen CAR-T-Zellen. Modifiziert nach Khurana A, Lin Y 2022
Herstellung allogener CAR-T-Zellen aus αβ-T-Zellen
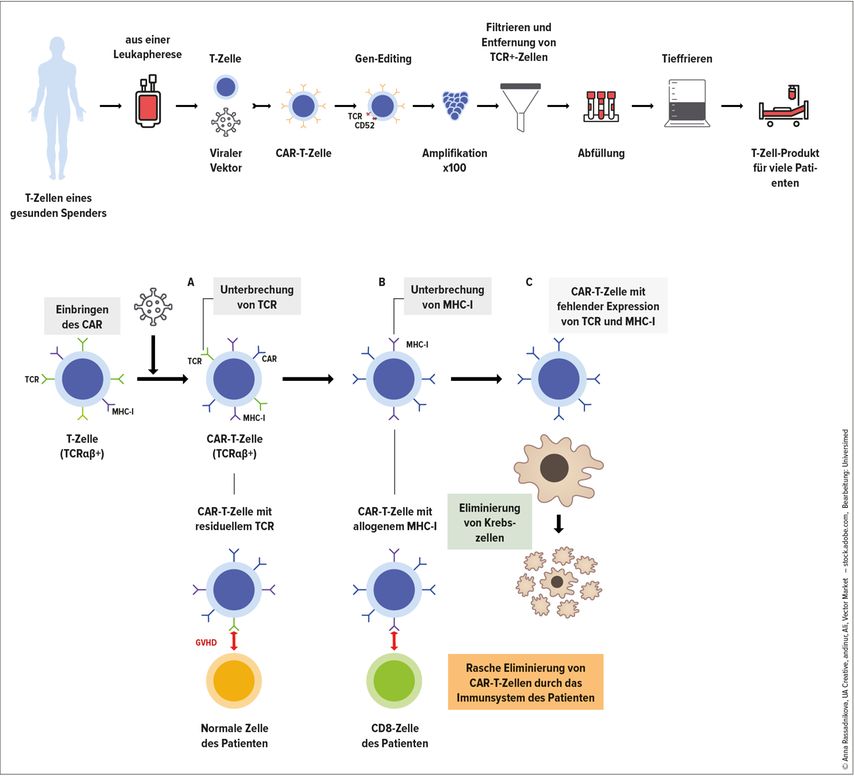
Allogene CAR-T-Zellen können sowohl aus mononukleären Zellen gesunder Spender, die mittels Leukapherese gewonnen werden, als auch aus Nabelschnurblutzellen oder induzierten pluripotenten Stammzellen hergestellt werden. Gesunde Spender haben den Vorteil, dass sie im Unterschied zu Patienten keine vorangegangenen Chemo- oder Radiotherapien hatten und ihre T-Zellen daher vital und unbeschädigt sind.
Neben dem CAR-Konstrukt, das für die spezifische Tumorerkennung und Aktivierung der T-Zellen in vivo erforderlich ist, müssen bei der Herstellung allogener CAR-T-Zellen weitere gentechnische Maßnahmen durchgeführt werden, um die Risiken für Graft-versus-Host-Erkrankung (GvHD) und Alloimmunisierung zu reduzieren. T-Zell-Rezeptoren (TCR), die als Proteinkomplex an der Oberfläche von T-Zellen verankert sind und für die Erkennung von Antigenen, die durch MHC-Moleküle präsentiert werden, zuständig sind, sind auch wesentlich für das Auftreten einer GvHD, da sie bei Bindung eines körperfremden Antigens Signale zur Proliferation der T-Zelle, Sekretion von Zytokinen, Oberflächenexpression von Kostimulatoren und Differenzierung in Effektorzellen initiieren. Um bei allogenen CAR-T-Zellen das Auftreten einer GvHD zu verhindern, wird daher der TCR der T-Zellen gentechnisch effizient und stabil unterbrochen und es werden residuelle TCR-αβ-T-Zellen aus dem Produkt entfernt (Abb. 1).
Allogene T-Zellen eines Spenders können vom Immunsystem des Patienten als fremd erkannt werden, wie es bei Gewebemerkmalsunterschieden (HLA) der Fall ist, und dann abgestoßen werden. Daher wird vor Infusion der CAR-T-Zellen eine intensivere lymphodepletierende Chemo-Immuntherapie verabreicht, um zelluläre Immunantworten des Patienten gegen allogene HLA-„mismatch“-T-Zellen zu unterdrücken und den CAR-T-Zellen einen Wachstumsvorteil im Tumormikromilieu zu verschaffen. Durch die Erhöhung der Dosierungen dieser lymphodepletierenden Chemo-Immuntherapie werden die Patienten jedoch höhergradig immundefizient, haben schwerere und protrahiertere Zytopenien und sind damit stärker gefährdet, an schweren opportunistischen Infektionen zu erkranken. Eine andere Möglichkeit ist die Verabreichung von Antikörpern wie dem gegen CD52 gerichteten Antikörper Alemtuzumab, der als Immunsuppressivum bei Multipler Sklerose zugelassen ist und im Rahmen der allogenen Blutstammzelltransplantation (HSZT) Verwendung findet. Um die allogenen CAR-T-Zellen vor diesem Antikörper zu schützen, ist es erforderlich, CD52 an der Oberfläche der CAR-T-Zellen gentechnisch aufzubrechen, sodass nur die Empfängerzellen nach Infusion von Alemtuzumab depletiert werden.
Es gibt im allogenen Bereich noch andere Möglichkeiten, Oberflächenmerkmale der CAR-T-Zellen gentechnisch zu verändern, wie die Elimination von HLA-Klasse- I- oder -Klasse-II-Merkmalen, um eine Abstoßungsreaktion durch den Empfänger zu vermeiden, oder die Veränderung von Checkpoint-Leitungswegen, um die Aktivität der CAR-T-Zellen zu erhöhen.
Klinische Studienergebnisse zu allogenen CAR-T-Zellen
Qasim und Kollegen führten 2017 die erste allogene CAR-T-Zelltherapie mit UCART19-T-Zellen bei 2 Kindern im Alter von 11 und 16 Monaten durch, die an einer refraktären ALL erkrankt waren und bereits erfolglos eine allogene HSZT mit einem unverwandten Spender und Blinatumomab erhalten hatten. Beide erzielten nach der einmaligen Gabe von 4,6 bzw. 4,0x106 Zellen/kg Körpergewicht innerhalb von 28 Tagen eine komplette molekulare Remission, wurden anschließend einer weiteren allogenen HSZT unterzogen und waren 18 bzw. 12 Monate nach allogener CAR-T-Zell-Therapie in kontinuierlicher kompletter Remission in Bezug auf die Grunderkrankung.
Kürzlich berichteten Benjamin und Kollegen die Ergebnisse einer offenen, Phase-I-Dosiseskalationsstudie mit 25 Erwachsenen, die an einer rezidivierten/refraktären B-ALL erkrankt waren und UCART19 in Dosierungen von 6x106, 6–8x107 und 1,8–2,4x108 erhielten. Die Gesamtansprechrate lag nach einem median Follow-up von 12,8 Monaten bei 48%, die Dauer des Ansprechens bei 7,4 Monaten. Zytokinfreisetzungssyndrome (CRS) ≥Grad 3 traten bei 7 (28%), Neurotoxizitäten ≥Grad 3 bei 1 (4%) und ≥Grad-3-Infektionen bei 7 Patienten (28%) auf. Nur 2 Patienten (8%) hatten eine akute GvHD Grad 1. Das progressionsfreie Überleben (PFS) betrug 2,1 Monate, das Gesamtüberleben 13,4 Monate.
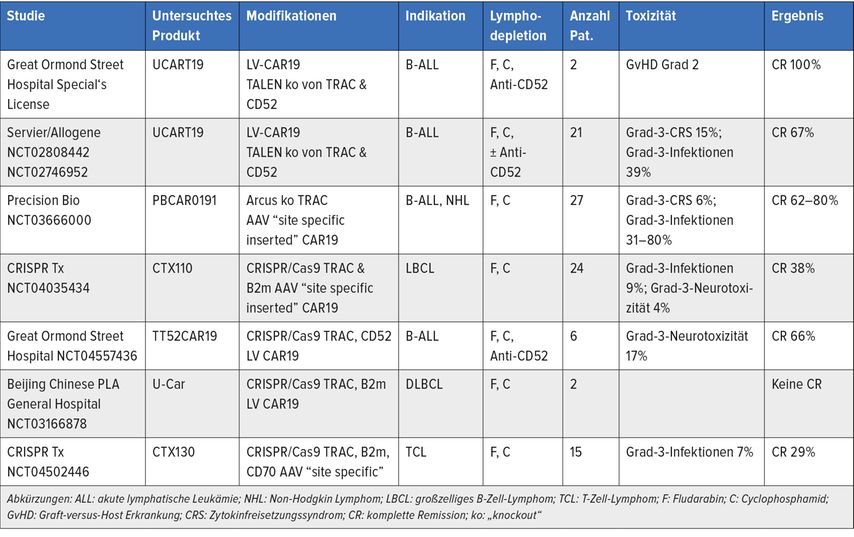
Mailankody und Kollegen therapierten 43 Patienten mit rezidiviertem/refraktärem Myelom mit ALLO-715-CAR-T-Zellen nach Lymphodepletion mit Fludarabin, Cyclophosphamid und einem monoklonalen Anti-CD52-Antikörper (ALLO-647), wobei insgesamt 24 Patienten (55,8%) ein Therapieansprechen zeigten und in der höchsten Dosisstufe der verabreichten allogenen CAR-T-Zellen 17 Patienten (70,8%) auf die Therapie ansprachen. CRS traten bei 24 Patienten (55,8%) mit 1 Ereignis ≥Grad 3, Neurotoxizität bei 6 Patienten (14%) und Infektionen bei 23 Patienten (53,5%) mit 10 Grad ≥3 auf. Das mediane Therapieansprechen betrug 8,3 Monate. Weitere Ergebnisse nach allogener CAR-T-Zell-Therapie sind der Tabelle 2 zu entnehmen.
Tab. 2: Klinische Studien mit gentechnisch bearbeiteten allogenen CAR-T-Zellen. Modifiziert nach Qasim W et al. 2023
Unsere Abteilung wird ab Herbst d. J. an einer randomisierten Phase-II-Studie teilnehmen, bei der allogene CAR-T-Zellen (ALLO-501A) bei Patienten mit rezidiviertem/refraktärem DLBCL zum Einsatz kommen werden.
Derzeitige Herausforderungen der Anwendung allogener CAR-T-Zellen
Von den autologen CAR-T-Zellen ist bekannt, dass höhere In-vivo-Expansion der CAR-T-Zellen und längere In-vivo-Persistenz entscheidend für eine gute Antitumorwirkung dieser zellulären Immuntherapie sind. Um eine höhere In-vivo-Expansion allogener CAR-T-Zellen zu ermöglichen, wurde versucht, die Lymphodepletion vor Zellinfusion zu intensivieren, um die inhibitorische Tumormikroumgebung besser zu überwinden und damit den CAR-T-Zellen einen Wachstumsvorteil zu verschaffen. Dadurch können jedoch auch schwerere Toxizitäten auftreten und auch das Risiko für CRS steigt. Derzeit ist die In-vivo-Persistenz der CAR-T-Zellen nur kurz, sodass im Anschluss an eine allogene CAR-T-Zell-Therapie entweder eine allogene HSZT durchgeführt wird oder allogene CAR-T-Zellen wiederholt verabreicht werden, wodurch die Patienten jedoch die Nebenwirkungen der wiederholten Lymphodepletion haben. Die Verwendung Alemtuzumab-resistenter CAR-T-Zellen in Kombination mit diesem Antikörper erhöht die In-vivo-Persistenz, ist jedoch mit einem höheren Risiko für Infektionen vergesellschaftet. Andere Möglichkeiten sind die gentechnische Deletion der HLA-Klasse I- und -Klasse-II-Expression auf den allogenen CAR-T-Zellen und weitere gentechnische Zellmodifikationen, an denen derzeit intensiv geforscht wird.
Die Zusammensetzung der T-Zell-Subpopulationen im Produkt hat sich bei autologer CAR-T-Zell-Therapie als sehr wichtig für eine verbesserte Effizienz dieser zellulären Immuntherapie herausgestellt. Entscheidend ist hier die Anreicherung an „Stem cell-like memory“-T-Zellen (TSCM), die aufgrund ihrer Stammzelleigenschaften für Jahrzehnte persistieren und eine erhöhte Proliferationskapazität haben, sowie „Central memory“-T-Zellen (TCM). Auch sollten die CAR-T-Zellen nicht dysfunktional im Sinne einer T-Zell-Exhaustion sein, was bei gesunden Spendern verglichen mit Patienten mit fortgeschrittenen Tumoren und vielen Vortherapien eher nicht der Fall sein wird.
FAZIT
Zusammenfassend kann festgehalten werden, dass allogene CAR-T-Zellen für Patienten mit rasch progredienten Malignomen, niedriger Anzahl an T-Lymphozyten im peripheren Blut und damit der fehlenden Möglichkeit, ein wirksames autologes CAR-T-Zellprodukt herzustellen,sowie intensiven Vortherapien und damit zu erwartender T-Zell-Dysfunktion eine große Chance für eine effiziente und sichere Therapie darstellen. Die bisher beschriebenen Nebenwirkungen sind akzeptabel und rechtfertigen ihren klinischen Einsatz. Derzeit sind einige Firmen in den USA knapp davor, eine Bewilligung durch die amerikanische Arzneimittelbehörde für allogene CAR-T-Zell-Therapien zu erhalten, und steigern damit für unsere Patienten die wirksamen Behandlungsmöglichkeiten in der Zukunft.
Literatur:
Benjamin R et al.: UCART19, a first-in-class allogeneic anti-CD19 CAR-T cell therapy in r/r ALL (CALM). Lancet Haematol 2022; 9(11): e833-43 • Depil S et al.: ‘Off-the-shelf’ allogeneic CAR T cells: development and challenges. Nat Rev Drug Discov 2020; 19(3): 185-99 • Khurana A, Lin Y: Allogeneic chimeric antigen receptor therapy in lymphoma. Curr Treat Options in Oncol 2022; 23(2): 171-87 • Liu DD et al.: Umbilical cord blood: A promising source for allogeneic CAR-T cells. Front Oncol 2022; 12: 944248 • Mailankody S et al.: Allogeneic BCMA-targeting CAR-T cells in r/r myeloma: Phase 1 UNIVERSAL trial. Nat Med 2023; 29: 422 • Maldonado-Pérez N et al.: Efficacy and safety of universal (TCRKO) ARI-0001 CAR-T cells for the treatment of B-cell lymphoma. Front Immunol 2022; 13: 1011858 • Ottaviano G et al.: Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia. Sci Transl Med 2022; 14(668): eabq3010 • Qasim W et al.: Molecular remission of infant B-ALL after infusion of universal TALEN gene-edited CAR T cells. Sci Transl Med 2017; 9(374): eaaj2013 • Qasim W: Genome-edited allogeneic donor “universal” chimeric antigen receptor T cells. Blood 2023; 141(8): 835-45 • Smirnov S et al.: Strategies to circumvent the side-effects of immunotherapy using allogeneic CAR-T cells and boost its efficacy: Results of recent clinical trials. Front Immunol 2021; 12: 780145
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...