Antikörper-Wirkstoff-Konjugate können mehr, als man denkt!
Autor:
PD Dr. med. Marcus Vetter
Klinik Onkologie & Hämatologie
Kantonsspital Baselland
E-Mail: marcus.vetter@ksbl.ch
Seit 2013 sind Antikörper-Wirkstoff-Konjugate für die Behandlung des metastasierten Mammakarzinoms in der Schweiz verfügbar. Studien verdeutlichen die Benefits der Substanzen gegenüber der Chemotherapie beim tripelnegativen bzw. Hormonrezeptor-positiven, HER2-negativen Karzinom.
Die Entwicklung der modernen Chemotherapie als Standbein der Krebsbehandlung geht auf Paul Ehrlich (1854–1915) zurück. Im Laufe der Zeit fanden verschiedene Klassen wie Anthrazykline, Taxane und Platine Eingang in die klinische Routine. Zu den potenziellen Vorteilen zählen die orale und die metronomische Anwendbarkeit bestimmter Substanzen sowie Unterschiede im Toxizitätsprofil. Beim frühen und fortgeschrittenen Mammakarzinom gelangt nach wie vor häufig (Poly-)Chemotherapie in unterschiedlichen Kombinationen zum Einsatz (Immuncheckpoint-Inhibitoren, HER2-gezielte Substanzen).
Ein breites Spektrum an möglichen Nebenwirkungen und Komplikationen erforderte jedoch die Entwicklung von alternativen Optionen wie Antikörper-WirkstoffKonjugaten (ADC). ADC bestehen aus monoklonalen Antikörpern und zytotoxischen Substanzen, die durch einen Linker verbunden sind. Das Ansetzen an spezifischen Antigenen auf Tumorzellen ermöglicht den direkten Transport der Chemotherapie in das Tumor-Microenvironment, wodurch höhere Dosen appliziert werden können als bei Verabreichung der freien Substanz.
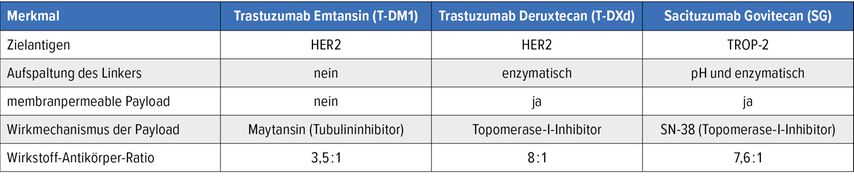
In der Schweiz erfolgte mit Trastuzumab Emtansin (T-DM1) 2013 die erste Zulassung eines ADC in der Indikation des Mammakarzinoms.1 Mittlerweile stehen zudem Trastuzumab Deruxtecan (T-DXd) und Sacituzumab Govitecan (SG) zur Verfügung. Zwischen den Präparaten finden sich Unterschiede in Bezug auf Zielantigen, Aufspaltung des Linkers und andere Merkmale (Tab. 1).1,2
OS-Verdopplung durchSG in ASCENT
Gegenstand der ASCENT-Studie war die Effektivität von SG beim metastasierten tripelnegativen Mammakarzinom nach ≥2 Chemotherapien in der fortgeschrittenen Situation. Im Verhältnis 1:1 wurden insgesamt 529 Patient:innen SG bzw. einer Therapie nach Wahl der Prüfärzt:innen (Eribulin, Gemcitabin, Capecitabin oder Vinorelbin) zugeteilt. Ein Einschluss bei Vorliegen stabiler Hirnmetastasen (BM) war erlaubt, jedoch auf maximal 15% der Studienpopulation beschränkt.
Als primärer Endpunkt galt das progressionsfreie Überleben (PFS) in der Gruppe ohne BM. Diesbezüglich resultierte ein hochsignifikanter Vorteil des ADC (5,6 vs. 1,7 Monate; HR: 0,41; p<0,001).3 PFS-Benefits wurden auch bei HER2-Negativität dokumentiert; dies traf sowohl auf die Gruppe mit HER2-low-Tumoren (6,2 vs. 2,9 Monate; HR: 0,446) als auch auf jene mit IHC 0 (4,3 vs. 1,6 Monate; HR: 0,375) zu.4 Das Gesamtüberleben (OS) war im BM-freien Kollektiv unter SG fast verdoppelt (12,1 vs. 6,7 Monate; HR: 0,48; p<0,001) und auch die Gesamtansprechrate unterschied sich signifikant zugunsten des Prüfarms (35% vs. 5%; p<0,001).3 Eine zusätzliche Analyse bestätigte die mit SG erzielten PFS- und OS-Vorteile gegenüber den einzelnen Komparator-Regimes.5
TROPiCS-02: OS-Vorteildurch SG konsistent
Im Setting des Hormonrezeptor-positiven/HER2-negativen lokal fortgeschrittenen oder metastasierten Mammakarzinoms wurde SG in der TROPiCS-02-Studie evaluiert. Der Vergleich erfolgte wiederum mit den oben aufgezählten Therapien nach Wahl der Prüfärzt:innen. Als Voraussetzung für den Einschluss galt eine Vorbehandlung mit zumindest einer endokrinen Therapie, einem Taxan und einem CDK4/6-Inhibitor. Im metastasierten Setting mussten zwei bis vier Chemotherapielinien verabreicht worden sein. 543 Patient:innen wurden 1:1 randomisiert. Im Median hatten sie drei Chemotherapielinien erhalten und 95% wiesen viszerale Metastasen auf.
Auch hier bewirkte SG eine signifikante PFS-Verlängerung (primärer Endpunkt), wobei das Risiko für Progression oder Tod um 34% abnahm (5,5 vs. 4,0 Monate; HR: 0,66; p=0,0003).6 Verlängerungen des PFS wurden bei HER2-low ebenso verzeichnet (5,8 vs. 4,2 Monate; HR: 0,60) wie bei HER2 IHC 0 (5,0 vs. 3,4 Monate; HR: 0,70).6,7 Für das OS erbrachte die zweite Interimsanalyse eine Risikosenkung um 21% (median: 14,4 vs. 11,2 Monate; HR: 0,79; p=0,020).8 Der OS-Vorteil erwies sich in allen Subgruppen als konsistent, so auch bei Patient:innen mit ≥3 Chemotherapielinien, viszeralen Metastasen und jenen, die über ≥6 Monate eine endokrine Therapie erhalten hatten.
Sowohl in ASCENT als auch in TROPiCS02 traten Neutropenien als häufigste therapieassoziierte hämatologische Nebenwirkung der Grade ≥3 auf.3,6 Im Bereich der nichthämatologischen Ereignisse der Grade ≥3 dominierte in beiden Studien Diarrhö.
DESTINY-Breast04:T-DXd bei HER2-low
Patient:innen mit metastasierten HER2-low-Tumoren nach ein bis zwei Chemotherapielinien im fortgeschrittenen Setting gingen in die DESTINY-Breast04-Studie ein. T-DXd wurde einer Therapie nach Wahl der Prüfärzt:innen mit Capecitabin, Eribulin, Gemcitabin, Paclitaxel oder Nab-Paclitaxel gegenübergestellt, wobei die Randomisierung im Verhältnis 2:1 erfolgte. Bis zu 70% der insgesamt 557 Patient:innen hatten zuvor eine CDK4/6-Inhibitor-Therapie erhalten, und 70% wiesen Lebermetastasen auf.
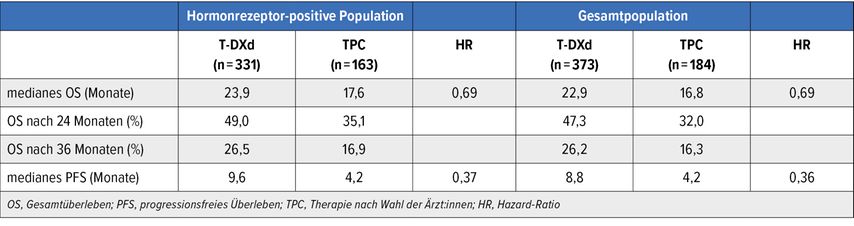
Als primärer Endpunkt war das PFS in der Hormonrezeptor(HR)-positiven Kohorte definiert. In dieser Gruppe ergab die Primäranalyse einen klaren PFS-Unterschied von 5,4 Monaten zugunsten von T-DXd (10,1 vs. 5,4 Monate; HR: 0,51; p<0,001).9 Ebenso eindeutig war der Effekt im Gesamtkollektiv (9,9 vs. 5,1 Monate; HR: 0,50; p<0,001). Das OS zeigte sich im Prüfarm in klinisch relevantem Ausmass verlängert, was sowohl auf die HR-positive Gruppe (23,9 vs. 17,5 Monate; HR: 0,64; p=0,003) als auch auf die Gesamtpopulation (23,4 vs. 16,8 Monate; HR: 0,64; p=0,001) zutraf. Die aktualisierte Analyse bestätigte diese Ergebnisse (Tab. 2).10
Im Nebenwirkungsprofil von T-DXd überwogen Nausea und Fatigue, wohingegen Neutropenien unter der Chemotherapie die höchste Inzidenz zeigten.9 Als häufigste Nebenwirkung der Grade ≥3 fanden sich in beiden Gruppen Neutropenien (13,7% vs. 40,7%). Therapiebezogene interstitielle Lungenerkrankungen/Pneumonitiden aller Grade traten unter T-DXd bei 12,1% (vs. 0,6%) auf.
Insgesamt lässt sich der Schluss ziehen, dass alle drei Studien bei Patient:innen mit tripelnegativem bzw. HR-positivem/HER2-negativem fortgeschrittenem Mammakarzinom einen eindeutigen Benefit der ADC im Vergleich zur Chemotherapie dokumentieren.
Literatur:
1 www.swissmedinfo.ch , Dezember 2024 2 Shastry M et al.: Antibody-drug conjugates targeting TROP-2: clinical development in metastatic breast cancer. Breast 2022; 66: 169-77 3 Bardia A et al.: Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med 2021; 384(16): 1529-41 4 Bardia A et al.: Final results from the randomized phase III ASCENT clinical trial in metastatic triple-negative breast cancer and association of outcomes by human epidermal growth factor receptor 2 and trophoblast cell surface antigen 2 expression. J Clin Oncol 2024; 42(15): 1738-44 5 Hurvitz SA et al.: Subgroup analyses from the phase 3 ASCENT study of sacituzumab govitecan in metastatic triple-negative breast cancer. Breast Cancer 2024; 10(1): 33 6 Rugo HS et al.: Sacituzumab govitecan in hormone receptor-positive/human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol 2022; 40(29): 3365-76 7 Tolaney S et al.: Final overall survival analysis from the phase 3 TROPiCS-02 study of sacituzumab govitecan in patients with hormone receptor-positive/HER2-negative metastatic breast cancer. ASCO 2023; Abstr. #1003 8 Rugo HS et al.: Overall survival with sacituzumab govitecan in hormone receptor-positive and human epidermal growth factor receptor 2-negative metastatic breast cancer (TROPiCS-02): a randomized, open-label, multicentre, phase 3 trial. Lancet 2023; 402(10411): 1423-33 9 Modi S et al.: Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022; 387(1): 9-20 10 Modi S et al.: Trastuzumab deruxtecan versus treatment of physician’s choice in patients with HER2-low unresectable and/or metastatic breast cancer: updated survival results of the randomized, phase 3 DESTINY-Breast04 study. ESMO 2023; Abstr. #3760
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...