ASH-Highlights zur AML: Menin-Inhibitoren – A Star Is Born
Autor:
PD Dr. med. Boris Eugen Schleiffenbaum
Hämatologie
Klinik im Park, Zürich
AndreasKlinik Cham, Hirslanden
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei der letzten Jahrestagung der American Society of Hematology (ASH) wurden unzählige spannende und Hoffnung gebende Studiendaten zur akuten myeloischen Leukämie (AML) präsentiert. Besonders beeindruckend waren jene zu Menin-Inhibitoren, die in Zukunft die Therapie der AML-Patient:innen wohl massgeblich verbessern werden.
Eine retrospektive Studie des Memorial Sloan Kettering Cancer Center konnte recht überzeugend zeigen, dass die Konsolidation von AML-Patienten im Rahmen der intensiven Chemotherapie ambulant weitaus kostengünstiger verabreicht werden kann als stationär (13168 USD/Zyklus vs. 36658USD/Zyklus Gesamtkosten, p<0,001).1 Und dies, ohne dass mit mehr Komplikationen (febrile Neutropenie, grosse Blutungen, IPS-Aufenthalte, Todesfälle) oder mit einer schlechteren Prognose (Rate ereignisfreies Überleben [EFS] nach zwei Jahren: 67% vs. 69%; Rate Gesamtüberleben [OS] nach zwei Jahren: 80% vs. 76%) gerechnet werden muss.
Eine andere Studie konnte zeigen, dass ein für eine MRD(minimale Resterkrankung)-AML spezifisches Genexpressionsprofil eine zumindest teilweise bessere Prognostik bietet als die heutige Klassifikation durch das «European Leukemia Network» (ELN) 2022/die «International Consensus Classification» (ICC) 2022. Diese Ergebnisse könnten den Weg ebnen von einer Genom- hin zu einer auch Transkriptom-basierten Klassifikation der AML.2
Überraschende Ergebnisse zu CPX-351
Es ist eine ziemlich lange Zeit her, dass die Überlegenheit von CPX-351 über das «7+3»-Regime bei älteren Patienten (60–75 Jahre) mit einer «Adverse risk»-AML nachgewiesen werden konnte (mOS: 9,56 vs. 5,96 Monate; HR: 0,69; p=0,003).3 Bei jüngeren Patienten (18–60 Jahre) aber fand sich kein Vorteil gegenüber einer Therapie mit FLAG-IDA (= Fludarabin, Cytarabin, Idarubicin und G-CSF; mOS: 13,3 vs. 11,4 Monate; HR: 0,78; p=0,1). Eine Subgruppenanalyse der AML19-Studie kam nun zu dem überraschenden Ergebnis, dass jüngere Patienten mit MDS (myelodysplastisches Syndrom)/AML (ICC 2022: ASXL-1, BCOR, EZH2, RUNX-1, SF3B1, SRSF2, STAG2, U2AF, ZRSR2) sehr wohl von einer CPX-351-Therapie profitieren (OS: 38,4 vs. 16,3 Monate; HR: 0,38; p=0,008). Interessant ist hier, dass Patienten unter FLAG-IDA eine initial deutlich höhere Ansprechrate hatten (Zyklus 1: 33 vs. 45%; Zyklus 2: 69 vs. 62%), mit schlussendlich aber ähnlicher CR(Komplettremissions)-Rate/MRD-Negativität. Trotz (noch) nur geringer Unterschiede in der Tag-30- (3 vs. 7) und Tag-60-Mortalität (7 vs. 10) fand sich am Ende eine weitaus höhere kumulative Mortalität für FLAG-IDA (p=0,0021). Schon der Wiederanstieg der Zahl an Neutrophilen (>1,0 G/L: 29,5 vs. 49,5 Tage) und Thrombozyten (>100 G/L: 29 vs. 49 Tage) nach dem zweiten Zyklus der Therapie, aber vor allem auch die Inzidenz schwerer Nebenwirkungen (10% vs. 76%) zeigten, dass insbesondere die unterschiedliche Toxizität für den Überlebensvorteil unter der CPX-351-Therapie verantwortlich sein dürfte.4
Im Gegensatz dazu kam die Dana-Farber-Gruppe in ihrer Studie zu dem Schluss, dass der Überlebensvorteil (mOS: 9,7 Monate vs. 6,8 Monate; p=0,037) unter einer CPX-351-Therapie gegenüber «7+3», bei in etwa ähnlicher Transplantationsrate, vor allem aus dem längeren Überleben der Patienten nach einer Transplantation resultiert (p=0,022).5
Um die Verwirrung komplett zu machen, war «7+3» plus fraktioniertes Gemtuzumab der CPX-351-Therapie bei älteren Patienten (>60 Jahre) mit einer «Non-adverse risk»-AML überlegen (Rate CR/CRi [CR mit unvollständiger Erholung des Blutbildes]: 85% vs. 78% nach dem zweiten Zyklus; Rate CR/MRD-negativ [MRD–]; 84% vs. 66%; EFS nach drei Jahren: 34% vs. 27%; OS nach drei Jahren: 52% vs. 35%).6
Venetoclax u.a. bei neu diagnostizierter AML
Die retrospektive Analyse einer französischen Gruppe könnte darauf hindeuten, dass die volle Dosierung von Venetoclax (Ven) wichtig für die Prognose der mit Ven/Azacitidin(Aza) behandelten Patienten sein könnte. Die Studie unterstreicht jedoch in jedem Falle die prognostische Bedeutung der MRD auch in der Therapie mit Ven/Aza.7
Über die bisherigen Applikationen hinaus könnte Ven/Aza durchaus auch bei NPM-1/CBF-AML-Patienten mit einem molekularen Rezidiv eine gute Möglichkeit darstellen, um sie zur Transplantation zu bringen.8
Interessant im Hinblick auf die Studien, in denen Ven/Aza mit einer konventionellen intensiven Chemotherapie (ICT) kombiniert wurde, waren die Daten einer chinesischen Studie, die zeigen konnten, dass Ven/Aza in Kombination mit «7 +3» bei der Therapie jüngerer Patienten – vor allem mit «adversem» Risikoprofil – im Vergleich zur alleinigen Therapie mit «7+3» häufiger eine CR/CRi (91% vs. 42%, p=0,001) erzielen konnte, allerdings bei ähnlicher MRD-Negativität (76% vs. 75%).9
Die Gruppe vom MD Anderson Cancer Center präsentierte sehr vielversprechende Daten einer Phase-II-Studie zur Therapie von Patienten mit neu diagnostizierter AML. Die Therapie bestand aus der Kombination einer ICT aus Cladribin (5mg/m2, d1–5), Idarubicin (8–10mg/m2, d1–3); AraC (1–1,5g/m2, d1–5) in der Induktion und Cladribin (5mg/m2, d1–3); Idarubicin (8mg/m2, d1–2); Cytarabin (AraC, 0,75–1,5g/m2, d1–3) in der Konsolidation, jeweils in der Kombination mit Venetoclax (400mg/d, d2–8). Es fand sich eine ausserordentlich hohe Effektivität (CR/CRi: 94%, MRD-: 89%) mit entsprechend guter 5-Jahres-EFS- (68%), RFS(Rezidiv-freies Überleben)- (74%) und OS-Rate (73%), die durch eine Transplantation noch verbessert werden konnte (OS TPL[Transplantation]+ vs. TPL–: 82% vs 63%). Die Nebenwirkungen entsprachen in etwa denen einer ICT ohne zusätzliche Gabe von Venetoclax.10
Von praktischer Bedeutung: In einer weiteren Studie verwendete die Gruppe vom MD Anderson Cancer Center Pegfilgastrim (G-CSF) am Tag 8 der Induktions- und Konsolidationstherapie. Sie verkürzte so die Zeit bis zur Erholung der Neutrophilenwerte und verringerte die Inzidenz von neutropenem Fieber und Bakteriämie, ohne die Effektivität der Therapie zu beeinträchtigen.11
In ganz ähnlicher Weise wurde in einer New Yorker Phase-IB-Studie Venetoclax («ramp up» d1–2, 400mg/p.o., d3–8→ d3–11→d3–14, «dose escalation») mit einer «7+3»-ICT (Daunorubicin [60mg/m2 d2–4], AraC [100mg/m2, d2–8]) in der Induktion von jüngeren Patienten mit neu diagnostizierter AML (18–75 Jahre; in der Konsolidation: 1,5g/m2 AraC, Zyklus 1, bzw. 1,0g/m2, Zyklus 2, jeweils d1, 3, 5 plus Venclyxto 200mg/d p.o., d1–7) kombiniert. Die Therapie wurde ausserordentlich gut vertragen. Es wurden keine Nebenwirkungen beobachtet, mit Ausnahme allenfalls einer neutropenen Enterokolitis, die man in einer «7+3»-ICT der AML auch ohne Venetoclax erwarten würde (Mortalität d30&60: 0%; Neutrophile >0,5G/L d26, Thrombozyten >50G/L d26). Auch erwies sich diese Therapie als ausserordentlich effektiv (nach der Induktion CR: 82%, Komposit-CR [CRc] MRD–: 86%). Bei einer Beobachtungszeit von 9,6 Monaten waren mOS, mEFS und mDOR (Dauer des Ansprechens) nicht erreicht worden. Zum Schluss der Datenerhebung lebten 93% der Patienten, 76% in MRD-Komplettremission. Die besten Ergebnisse zeigten Patienten mit einer CBF- oder NPM1-Mutation (MRD– CR: 100%) bzw. Patienten mit guter oder intermediärer ELN(European Leukemia Network)22-Prognose (MRD– CR: 100%; OS: 100% bei Schluss der Datenerhebung). Patienten mit einer TP53-Mutation profitierten nicht.12
Avapritinib bei CBF/KIT-mutierter AML
Eine chinesische Gruppe präsentierte interessante Daten für die zukünftige Therapie der 25–35% Patienten mit KIT-mutierter CBF-AML.13 42,9% der mit dem KIT-Inhibitor Avapritinib (Monotherapie oder in Kombination mit ICT oder Venetoclax + HMA) behandelten MRD+ Patienten wurden MRD–. Von den rezidivierten/refraktären Patienten erreichten 41,7% eine CRc. Sollten die EFS- und OS-Daten die Wirksamkeit dieser Therapie bestätigen, so wäre diese Art der Therapie sicherlich in randomisiert-kontrollierten Phase- III-Studien zunächst im MRD+ und r/rSetting bei Patienten mit KIT-mutierter CBF-AML zu untersuchen, bevor man Avapritinib allenfalls auch in die Behandlung von Patienten mit neu diagnostizierter AML einbeziehen könnte.
Dreier-Kombi mit Ivosidenib bei IDH1-AML
Aus der Gruppe um Courtney DiNardo kam eine Phase-Ib/II-Studie mit hervorragenden Ergebnissen für die Dreierkombination aus Ivosidenib (500mg/d p.o., ab C1D15), Ven 400/800mg/d p.o., d1–14 und Aza (75mg/m2, s.c./i.v., d1–7) für Patienten mit
-
Hochrisiko-MDS/myeloproliferativer Neoplasie (MPN; Gesamtansprechrate [ORR]: 100%, CRc: 100%, MRD–: 43%, OS-Rate nach drei Jahren: 82%, DOR-Rate nach drei Jahren: 30%),
-
neu diagnostizierter AML (ORR: 97%, CRc: 94%, MRD–: 77%, OS-Rate nach drei Jahren: 71%, DOR-Rate nach drei Jahren: 72%) und
-
r/r AML (ORR: 83%, CRc: 83%, MRD–: 78%, OS-Rate nach drei Jahren: 52%, DOR-Rate nach 3 Jahren: 44%), Ergebnisse jeweils in der gesamten Studienpopulation.14
Für den Vergleich des Triplets (Ivosidenib/Ven/Aza) mit dem Duplet (Ivosidenib/Aza) ergaben sich durchaus vielversprechende HR (OS: 0,41, EFS: 0,30, DOR: 0,19, p=0,01). Eine prospektive Studie zum Vergleich des Duplets mit dem Triplet wird unter der Leitung von H. Döhner im ersten Quartal 2025 beginnen, Patienten zu rekrutieren.
FLT3-AML: Co-Mutationen, Gilteritinib, Midostaurin
Die Prognose von FLT3-mutierten AML-Patienten hängt u.a. auch von Co-Mutationen ab. Für die NPM1-Co-Mutation ist dies schon lange bekannt. Eine Gruppe aus Hannover in Deutschland hat sich nun der «Harmony Alliance»-Gruppe (siehe auch ASH-Kongress 2022, Dr. med. Alberto Sanchez)15 angeschlossen und mithilfe dieses durch die internationale Vernetzung stark erweiterten Datensatzes bei FLT3-mutierten AML-Patienten Co-Mutationen bei «MDS-related»-Genen untersuchen können. Die Patienten waren häufiger männlichen Geschlechts, älter, zeigten eine niedrigere Anzahl weisser Blutkörperchen (WBC) und waren seltener NPM1-mutiert. Sie zeigten auch ein schlechteres Ansprechen auf die Therapie (CR-Rate: 74% vs. 82%) und eine schlechtere Prognose (RFS-HR: 1,14, OS HR: 1,36), was sich aber in der Multivarianzanalyse als nicht unabhängiger Risikofaktor erwies. Hingegen waren die MR-Co-Mutationen durchaus von prognostischer Relevanz bei FLT3-mutiertenNPM1-Wildtyp-AML-Patienten. Es sollte jedoch angemerkt warden, dass der prinzipielle Ansatz der Studie hinterfragt werden darf, wurden die «MDS-related»-Co-Mutationen doch als Gruppe und nicht im Einzelnen untersucht.16
R. Stone berichtete am ASH-Kongress die 10-Jahres-Daten der RATIFY-Studie. In dieser hatten Patienten mit FLT3-mutierter neu diagnostizierter AML eine «7+3»-Therapie +/– Midostaurin (50mg BID p.o., d8–21 in der Induktion und Konsolidation, d1–28 in der Erhaltung) erhalten.17 Auch in dieser langen Beobachtungszeit erwies sich der FLT3-Inhibitor als wirksam, wenn auch mit einer über die Zeit weniger guten Differenz im OS gegenüber dem Placebo. Dies ist mit aller Wahrscheinlichkeit ein Resultat der Alterung der Studienpopulation (67,7 vs. 25,6 Monate). Der Vorteil einer Transplantation in der ersten CR muss hier nochmals hervorgehoben werden (OS: nicht erreicht vs. 24,8 Monate bzw. 77,7 Monate für die Gesamtgruppe der Patienten mit Transplantation).
In einer Phase-Ib/II-Studie konnte die australische Gruppe um A. Wei zeigen, dass Patienten mit neu diagnostizierter AML (>60 Jahre, nicht fit für eine ICT) im Vergleich mit niedrig dosiertem AraC (LDAC; 20mg/d s.c., d1–10) und Ven (400 → 600mg/d p.o., d1–28) erfolgreich mit LDAC/Ven –/+ Midostaurin (50mg BID, d11–28) behandelt werden konnten. Bemerkenswert waren die CR/CRi-Rate von 63% bzw. 57% vs. 82% und das mOS mit 9,9 Monaten bzw. 8,8 Monaten vs. 16,6 Monate. Die Rate an MRD– lag bei 0% vs. 61%. Allerdings wurde eine etwas erhöhte Toxizität beobachtet: Die Rate an febriler Neutropenie Grad 3 lag bei 17,1% vs. 26,6%; ausserdem gab es vermehrt gastrointestinale Nebenwirkungen Grad 1 und 2.18 Patienten mit anderen Mutationen profitierten nicht vom Midostaurin.
In der Phase-II-Studie PrECOG 0905 wurden erstmals zwei FLT3-Inhibitoren in der Induktionstherapie («7+3») und Konsolidationstherapie (hoch dosiertes AraC) von Patienten mit neu diagnostizierter FLT3+ AML miteinander verglichen.19 Obwohl Daten zum EFS und OS noch nicht vorliegen, war der Unterschied in den erzielten Remissionsraten doch eindrücklich: CRc-Rate: 86,6 % vs 72,4%, p=0,042 (Gilteritinib vs. Midostaurin). Die MRD-Rate am Ende der Induktion liess dennoch Zweifel an einer möglichen höheren Effektivität von Gilteritinib aufkommen (MRD–: 40% vs. 47,1%, p=0,366). Eine genauere Analyse der MRD-Kinetik konnte dann aber zeigen, dass am Ende der Konsolidationstherapie 83,3% der Gilteritinib-Patienten MRD– waren, gegenüber 44,4% der Midostaurin-Patienten. Dies unterstreicht einmal mehr die Komplexität der Interpretation von MRD-Daten in der Therapie der AML.
Emavusertib ist nicht nur ein FLT3-Inhibitor, sondern inhibiert auch den «Splicing factor»-Mutationen(U2AF1 und SF3B1)-getriebenen IRAK4(Interleukin-1 Rezeptor-assoziierte Kinase 4)-Stoffwechselweg. Bei einem akzeptablen Nebenwirkungsprofil konnte mit einer Emavusertib-Monotherapie bei 16,1% der Patienten mit r/r AML und einer «Splicing factor»- oder einer FLT3-Mutation eine CRc erreicht werden.20 Eine Anschlussstudie rekrutiert nun AML-Patienten in erster CR mit MRD+ FLT3-Mutationen und «Splicing factor»-Mutationen für eine Monotherapie mit Emavusertib.
NPM1/KMT2Ar-AML: Menin-Inhibitoren im Fokus
Revumenib
I. Aldoss berichtete über die vielversprechenden Daten der fortlaufenden Phase II der AUGMENT-101-Studie. Patienten mit akuter Leukämie (akute lymphatische Leukämie, vor allem bei Kindern; r/r AML) und KMT2A-Rearrangement (KMT2Ar) erhielten den Menin-Inhibitor Revumenib (163mg BID p. o., 28-d-Zyklus; CYP3A4-Interaktionen!). Die Ergebnisse zeigten CR/CRh(CR mit partieller hämatologischer Regeneration)-Raten von 22,7% (MRD–61,1%) bzw. CRc-Raten von 43,3% (MRD– 58,3%) und eine mDOR von 6,4 Monaten in der ursprünglichen Kohorte (22 Patienten) und 13,0 Monaten in der Interimsanalyse (13 Patienten).21 32,9% der Patienten konnten eine Transplantation erhalten. 42,9% davon begannen danach mit einer Remuvenib-Erhaltungstherapie. Die Nebenwirkungen dieser Therapie waren nicht unerheblich (Grad≥ 3: QTc-Verlängerungen bei 12%, Differenzierungssyndrom bei 13%). Siehe dazu auch die Daten vom ASH-Kongress 202122 und 202223 sowie vom EHA-Kongress 202424. Anmerkung: Seit dem 15. November 2024 ist Revumenib von der FDA für die Therapie der KMT2Ar r/r AML zugelassen.
Bleximenib
Ähnlich konnte in der Phase I der Studie cAMeLot-1 die Effektivität eines anderen Menin-Inhibitors, Bleximenib, in der Therapie von KMT2Ar, NPM1– und NUP98/214-mutierter akuter Leukämie (>90% r/r AML) bei gleichzeitig guter Verträglichkeit gezeigt werden.25 Die CR/CRh-Rate war 33% (bei einer Dosis von 90/100mg BID p.o.); die mDOR lag bei 6 Monaten. Die empfohlene Phase-II-Dosis (RP2D), 100mg BID p.o., mit einem «Ramp-up» von 50mg BID über 2 Wochen, wurde aufgrund der höheren Nebenwirkungsrate (v.a. Zytopenien; keine QTc-Verlängerungen; Differenzierungssyndrom Grad ≥3 bei 6,5%, meist um d8, Zyklus 1) und Abbruchrate bei der höheren Dosis von 150mg BID gewählt, ohne dass bei dieser hohen Dosis eine bessere klinische Effektivität oder eine vermehrte MEIS-Inhibierung zu beobachten gewesen wäre.
Enzomenib
Ein weiterer Menin-Inhibitor, Enzomenib (DSP-5336), wurde in einer Phase-I-Dosiseskalations- (40–300mg BID p.o. +/– Azol-Therapie) und -optimierungsstudie (200/300mg BID p.o.) getestet, um die RP2D bei der Therapie von Patienten mit KMT2Ar- und NPM1-mutierter r/r AML zu finden. Es zeigte sich keine dosislimitierende Toxizität (DLT)und bei nur 1% der Patienten eine QTc. Es kam zu keinem nebenwirkungsbedingten Studienabbruch und v.a. zu keinem klinisch relevanten Differenzierungssyndrom (insgesamt 10,7%, ohne Prophylaxe, ohne «ramp up»).26 Azole hatten kaum einen Einfluss auf die Pharmakokinetik. Die Therapie erwies sich als wirksam (KMT2Ar: 300mg BID, CR+CRh-Rate: 40%, NPM1: 200/300mg BID, 47,1%). Patienten, die auf die Therapie ansprachen, zeigten im Gegensatz zu Patienten, die nicht ansprachen, eine konsistente Verminderung der HOXA9/MEIS1-Aktivität und einen Anstieg des CD11b in den Knochenmarksproben nach jedem Zyklus. Diese Laboranalysen könnten daher als Biomarker für den Erfolg einer Menin-Inhibitor-Therapie dienen (siehe auch EHA-Kongress 2024).27
Ven/HMA + Revumenib
Die Kombinationstherapie Ven/HMA ist Standard in der Behandlung von AML-Patienten, die eine ICT nicht vertragen. In präklinischen Studien konnte zudem ein Synergismus von Ven und Menin-Inhibitoren gezeigt werden, sodass sich als nächster Schritt in der Behandlung von Patienten mit NPM1/KMT2Ar/NUP98-r/r-AML- eine rein orale Therapie von Ven (400mg/d nach «ramp up», d1–14) und Decitabin und Cedazuridin (35mg und 100mg, d1–5) in Kombination mit Revumenib (113mg →163mg, BID p.o., jeweils mit starkem CYP3A4-Inhibitor, d1–28; 28-d-Zyklus) anbot, wie in der Phase-I/II-Studie des MD Anderson Cancer Center.
Sowohl bei einer Revumenib-Dosis von 113mg (1/6 der Teilnehmenden) als auch bei einer Dosis von 163mg (ebenfalls 1/6) trat eine prolongierte Thrombozytopenie (42d) als DLT auf, 163mg wurde dann als RP2D gewählt.28 Zudem fanden sich eine verlängerte QTc (Grad 3) bei 9% und ein Differenzierungssyndrom (Grad 3) bei 3% der Patienten. Die übrigen Nebenwirkungen entsprachen denen, die auch sonst bei Ven/HMA-behandelten r/r AML-Patienten gefunden werden (febrile Neutropenie, Pneumonie, Sepsis). Insgesamt kam es zu zwei Todesfällen infolge der Therapie (respiratorisches Versagen; Bakteriämie). Die Effektivität übertraf dann aber doch deutlich die der bisher bekannten Ruvemnib-Monotherapie: CR/CRh-Rate 48%, CR-Rate 39%, MRD– 88%; CRD («complete remission duration», 6 Monate) 74%, mDOR nicht erreicht; OS-Rate (6 Monate) 68%, mOS nicht erreicht.
Ziftomenib
Basierend auf diesen vielversprechenden Daten bei r/r-AML-Patienten (siehe oben und siehe auch Lancet Oncology 2024,29 CR/CRh-Rate: 35%) war man nun sehr gespannt auf die Ergebnisse der Phase-Ia-Studie KOMET-007. In dieser wurde der Menin-Inhibitor Ziftomenib (d8 der Induktion, Konsolidation und Post-TPL-Erhaltungstherapie) kombiniert mit einer «7+3»-Therapie bei neu diagnostizierten AML-Patienten mit schlechtem Risikoprofil (>60 Jahre, t-AML, «Adverse risk»-Zytogenetik) – mit durchschlagendem Erfolg. Die Daten zu Ziftomenib 200 – 400 – 600mg:30
-
NPM1 CRc/CRh: 100%/100% – 100%/ 67% – 100%/57%; MRD–: 76%;
-
KMT2Ar CRc/CRh: 90%/63% – 67%/ 83% – 100%/100%; MRD–: 75%
Bei einem Follow-up von 31 bzw. 19 Wochen (NPM1 bzw. KMT2Ar) waren 100% bzw. 96% der Patienten noch am Leben. Die beobachteten Nebenwirkungen entsprachen den bekannten Nebenwirkungen einer ICT bei neu diagnostizierten AML-Patienten: Zytopenie, Nausea, Diarrhö und Obstipation. Es kam zu keiner DLT und es gab keine Therapieabbrüche wegen eines Rezidivs oder wegen Nebenwirkungen. Bei diesem Medikament ist eine Interferenz mit Azolen nicht bekannt, es gab keinen Fall mit einer QTc-Verlängerung. Nur ein Patient zeigte ein Differenzierungssyndrom, das jedoch so leicht war, dass die Therapie nicht unterbrochen werden musste. Beeindruckend war auch die Zeit bis zum Wiederanstieg der Neutrophilen (>0,5G/L, 200/400/600mg: 32d/27d/ 26d) und Thrombozyten (>50G/L, 28d/ 28d/26d). Aufgrund dieser Daten sind schon jetzt parallel zwei Phase-III-Studien geplant, für die ab 2025 rekrutiert werden wird: eine zur Kombination von Ziftomenib mit einer «7+3»-ICT bei jungen, fitten Patienten mit einer neu diagnostizierten NPM1/KMT2Ar-AML, die andere zur Kombination mit Ven/Aza bei älteren Patienten.
Anmerkung: Diese neue Art der Therapie erschwert allerdings die Differenzierung zwischen regenerativem und refraktärem Knochenmark; hier hilft die Bestimmung des NPM1 in der Immunhistologie.
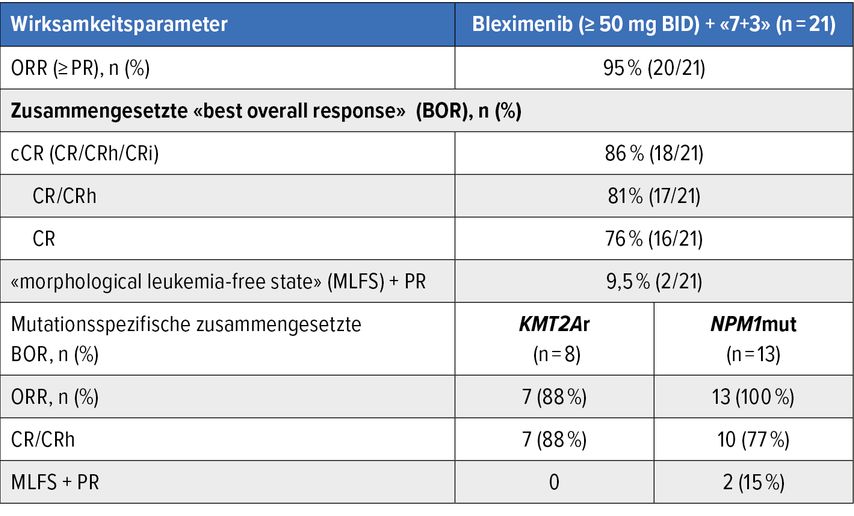
Bleximenib plus ICT
In ganz ähnlicher Weise kombinierte eine Toulouser Gruppe den Menin-Inhibitor Bleximenib (d4 30mg/50mg/100mg in der Induktion, Konsolidation und über 12 Monate Erhaltungstherapie; zum Zeitpunkt einer allfälligen Transplantation wurden die Patienten zensuriert) mit einer «7+3»-Therapie in einer Phase-Ib-Studie bei neu diagnostizierten NPM1-/KMT2Ar-AML-Patienten. Sie erzielte einen ähnlichen Erfolg (Tab.1): Bleximenib 50/100mg BID p.o., Gesamtpopulation CRc: 86%, CR/CRh: 81% (KMT2Ar: 88%/NPM1: 77%), CR: 76%; Bleximenib 50mg MRD–: 2/3; 100mg MRD–: 6/6).31 Wiederum entsprachen die Nebenwirkungen denen unter einer ICT, diesmal allerdings mit einem etwas verzögerten Wiederanstieg der Neutrophilen (>0,5G/L, 32d) und der Thrombozyten (>50 G/L, 33d). Auch hier zeigte kein Patient eine verlängerte QTc, es kam zu keinem Differenzierungssyndrom und zu keiner DLT.
Tab. 1: Bleximenib kombiniert mit ICT bei neu diagnostizierter AML: vorläufige Wirksamkeit in der «Intention to treat»-Population (modifiziert nach Recher C et al.)31
ICT vs. Ven/Aza
Unabhängig vom Einsatz von Menin-Inhibitoren kann die Therapieentscheidung bei fitten Patienten mit neu diagostizierten NPM1-AML mit gutem Risikoprofil und etwas fortgeschrittenerem Alter schwierig sein: Eine ICT verspricht eher Heilung, ist aber toxischer. Eine Ven/Aza-Therapie ist zwar weniger toxisch, schlussendlich, wenn nicht gefolgt von einer Stammzelltransplantation, wird der Patient aber wohl eher ein Rezidiv erleiden. In einer retrospektiven Single-Center-Studie aus dem John Hopkins Hospital konnte nun gezeigt werden, dass zwar die Effektivität von ICT und Ven/Aza ähnlich ist (CR: 81% vs. 74%; OS: 6,2 vs. 4,9 Jahre, bei ähnlichem CIR und NRM), transplantierte Patienten aber unabhängig von ihrer Vortherapie von einer Transplantation profitierten.32 Das gibt dieser Studie auch im Hinblick auf die sich anbahnende Therapie der NPM1-mutierten Patienten mit Menin-Inhibitoren einen direkt provokativen Charakter.
Intensivierte Chemotherapie
In einer retrospektiven Analyse der Daten der englischen Studien AML17 und AML19 zeigte sich für neu diagnostizierte KMT2Ar-AML-Patienten nicht nur eine verbesserte Rate an MRD– (76% vs. 59%) nach 2 Zyklen einer Induktionstherapie, sondern auch eine Verbesserung der Prognose (RFS «intermediate», HR: 0,80; RFS «adverse», HR: 0,45; OS «intermediate», HR: 0,72; OS «adverse», HR: 0,63) durch die Intensivierung der Chemotherapie (FLAG-IDA vs. DA, ADE, CPX351).33 Eine MRD– war prognostisch von grösster Bedeutung (OS HR: 5,11; CIR HR: 6,43), sodass bei MRD– Patienten die ursprünglichen ELN2022-Risikogruppen keine prognostische Bedeutung mehr hatten. In der Wahl des Chemotherapiekerns in der Kombinationsbehandlung der KMT2Ar-Patienten mit Menin-Inhibitoren könnten diese Daten von wesentlicher Bedeutung sein.
Immuntherapie: AFM28
Der bispezifische, tetravalente Natürliche-Killer(NK)-Zell-«Engager» AFM28 (CD16 bei NK-Zellen, CD123 bei AML-Zellen) führt zu einer CD64-unabhängigen AML-Zelllyse (antikörperabhängige zellvermittelte Zytotoxizität, ADCC). Die AFM28-Monotherapie von r/r-AML-Pati- enten im Rahmen einer Phase-I-Dosiseskalations-Studie (25–300mg w/i.v.) war in den Dosen von 250/300mg/w i.v. effektiv (CRc-Rate: 40%) und nebenwirkungsarm («Infusion related reaction»[IRR]-Grade 1+2: 13/29; Zytokinfreisetzungssyndrom [CRS]: 2/29; keine Neurotoxizität).34 Pharmakokinetische Daten wie auch der Grad der Rezeptorsättigung entsprachen der Wirksamkeit der Therapie in der Dosierung 250/300mg AFM28 pro Woche.
Ausblicke
Der «assay for transposase-accessible chromatin with sequencing» (ATAC-Seq) erlaubt die epigenetische Profilierung, indem er die Regionen des Chromatins definiert, die für RNA-Interaktionen zugänglich sind, und diese kenntlich macht. Damit wird die weitere Differenzierung der AML in Ergänzung zur genetischen Analyse im Next-Generation-Sequencing (NGS) ermöglicht und es eröffnen sich über die Verbesserungen der Klassifikation und Prognostik hinaus Möglichkeiten für neue therapeutische Ansätze.35
AML-Blasten mit einer niedrigen Expression von «reactive oxygen species» (ROS) identifizieren eine immer noch heterogene Gruppe von leukämischen Stammzellen (LSC) mit den typischen Eigenschaften der LSC: Sie sind in der Ruhephase und teilen sich nur selten, haben aber die Eigenschaft der Selbsterneuerung und des schnellen «engraftment». Sie zeigen ausserdem eine hohe Adhäsivität in spezifischer Lokalisation in der endostealen Nische und ein spezifisches Expressionsprofil und sie stellen sich in den «Uniform manifold approximation and projection»(UMAP)-Einzelzell-RNA-Sequenzierungsplots der hämatopoetischen Stammzellen (HSC) spezifisch dar. An dieser so definierten LSC-Population der AML sollten neue Medikamente zukünftig ansetzen, um so AML-Patienten tatsächlich heilen zu können.36
In diesem Zusammenhang ist es von Bedeutung, dass Mutationen, die die Basis für ein späteres Rezidiv bilden, schon sehr früh in den LSC auftreten.37 Kann man die LSC sicher definieren, dann sollte es möglich sein, schon früh die neu entstandenen Mutationen zum Ziel einer erweiterten Therapie zu machen.
Literatur:
1 Boussi L et al.: ASH 2024; Abstr. #445 2 Oelschläger L et al.: ASH 2024; Abstr.#641 3 Lancet JE et al.: J Clin Oncol 2018; 36: 2684-92 4 Mehta P et al.: ASH 2024; Abstr. #55 5 Shimony S et al.: ASH 2024; Abstr. #60 6 Knapper S et al.: ASH 2024; Abstr. #59 7 Heiblig M et al.: ASH 2024; Abstr. #846 8 Higué J et al.: ASH 2024; Abstr. #58 9 Lu J et al.: ASH 2024; Abstr. #971 10 Bouligny M et al.: ASH 2024; Abstr. #734 11 Kadia TM et al.: ASH 2024; Abstr. #446 12Mantzaris I et al.: ASH 2024; Abstr. #57 13 Dou X et al.: ASH 2024; Abstr. #222 14 Marvin-Peek J et al.: ASH 2024; Abstr. #219 15 Sanchez A et al.: ASH 2022; Abstr. #304 16 Mecklenbrauck R et al.: ASH 2024; Abstr. #844 17Stone R et al.: ASH 2024; Abstr. #218 18 Chua CC et al.: ASH 2024; Abstr. #217 19 Luger S et al.: ASH 2024; Abstr. #221 20 Winer ES et al.: ASH 2024; Abstr. #737 21 Aldoss I et al.: ASH 2024; Abstr. #211 22 Stein E et al.: ASH 2021; Abstr. #699 23 Issa G et al.: ASH 2022; Abstr. #63 24 Aldoss I et al.: EHA 2024; Abstr. #S131 25 Searle E et al.: ASH 2024; Abstr. #212 26 Zeidner JF et al.: ASH 2024; Abstr. #213 27 Daver N et al.: EHA 2024; Abstr. #132 28 Issa G et al.: ASH 2024; Abstr. #216 29 Wang ES et al.: Lancet Oncol 2024; 25:1310-24 30 Zeidan AM et al.: ASH 2024; Abstr. #214 31 Recher C et al.: ASH 2024; Abstr. #215 32Zale A et al.: ASH 2024; Abstr. #450 33 Othman J et al.: ASH 2024; Abstr. #845 34 Montesinos P et al.: ASH 2024; Abstr. #738 35 Ochi Y et al.: ASH 2024; Abstr. #639 36 Benetton M et al.: ASH 2024; Abstr. #640 37 Turkalj J et al.: ASH 2024; Abstr. #642
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...