CAR-T-Zellen: Fortschritte bei soliden Tumoren und Autoimmunerkrankungen
Bericht:
Therese Schwender
Das gemeinsam von der European Hematology Association (EHA) und der European Society for Blood and Marrow Transplantation (EBMT) organisierte European CAR T-cell Meeting fand in diesem Jahr zum siebten Mal statt. Das Programm der im Hybridformat durchgeführten Veranstaltung umfasste unter anderem Vorträge zur Anwendung von CAR-T-Zellen bei soliden Tumoren und Autoimmunerkrankungen.
Dr. med. John Maher (London, UK) erläuterte in seinem Vortrag die Entwicklung von LEU011, einem gegen NKG2D («natural killer group 2D») gerichteten CAR-T-Zell-Produkt zur Behandlung solider Tumoren. Der NKG2D-Ligand wird von zahlreichen Tumoren exprimiert und bietet daher einen vielversprechenden Angriffspunkt für die CAR-T-Zell-Therapie.1 Wie Maher berichtete, zeigte LEU011 in präklinischen Studien gute Ergebnisse in Modellen verschiedener solider Tumoren, darunter Kolorektal-, Pankreas-, Ovarial- und Mammakarzinom sowie Mesotheliome.
«Mithilfe eines intraperitonealen Ovarialkarzinom-Xenografts konnten wir beispielsweise zeigen, dass die Tumorzellen bereits 24 Stunden nach der intravenösen Applikation der CAR-T-Zellen lokalisiert waren», sagte Maher und ergänzte, dass anhand eines subkutanen Pankreaskarzinom-Xenografts zudem bestätigt werden konnte, dass die CAR-T-Zellen tatsächlich in die Tumoren eindringen. «Mittlerweile konnten wir mit LEU011 eine klinische Studie der Phase I/II namens AERIAL starten», berichtete er. Die Studie soll die maximal tolerable Dosis von LEU011 bei Erwachsenen mit rezidivierten oder refraktären soliden Tumoren bestimmen.
ROR2 beim klarzelligen Nierenzellkarzinom
Eine weitere interessante Zielstruktur für eine CAR-T-Zell-Therapie stellt ROR2 («receptor tyrosine kinase-like orphan receptor 2») dar.
«Wir haben festgestellt, dass ROR2 häufig auf Zelllinien und primären Tumorproben des klarzelligen Nierenzellkarzinoms und des multiplen Myeloms vorkommt», erläuterte Prof. Dr. med. Michael Hudecek (Würzburg, Deutschland).
Um die Effektivität ROR2-spezifischer CAR-T-Zellen zu untersuchen, wurden zwei CAR-Konstrukte mit zehnfach unterschiedlichen Bindungsaffinitäten für dasselbe Epitop von ROR2 hergestellt.2 Beide Zellprodukte zeigten in vitro hohe antigenspezifische Antitumorreaktivität – insbesondere im Hinblick auf Tumorzelllyse, Sekretion der Zytokine Interleukin-2 und Interferon-γ sowie T-Zell-Proliferation.
«In vivo sahen wir eine lang anhaltende Antitumoreffektivität sowie signifikante Überlebensvorteile und langfristige T-ZellPersistenz. Ausserdem beobachteten wir, sowohl in vitro als auch in vivo, einen Trend zu einer stärkeren Antitumoreffektivität von T-Zellen, die den CAR mit höherer Affinität für ROR2 exprimieren», führte Prof. Hudecek aus.
Vorläufige Toxizitätsdaten deuten zudem darauf hin, dass ROR2-spezifische CAR-T-Zellen ein vorteilhaftes Sicherheitsprofil aufweisen.2 Aktuell wird eine multizentrische Phase-I-Studie vorbereitet, um die Sicherheit und Wirksamkeit der ROR2-CAR-T-Zell-Therapie bei Patient:innen mit multiplem Myelom und klarzelligem Nierenzellkarzinom zu evaluieren. «Wir gehen davon aus, dass die Studie im ersten Quartal 2026 startet», schloss Prof. Hudecek.
CAR-T-Zell-Therapie beim rezidivierten Glioblastom
Beim Glioblastom besteht aufgrund seiner nach wie vor schlechten Prognose und der begrenzten Behandlungsmöglichkeiten ein hoher Bedarf an neuen Therapieoptionen.
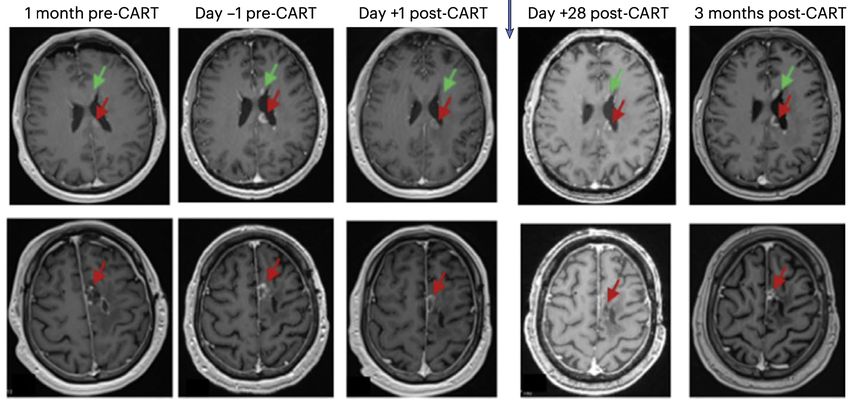
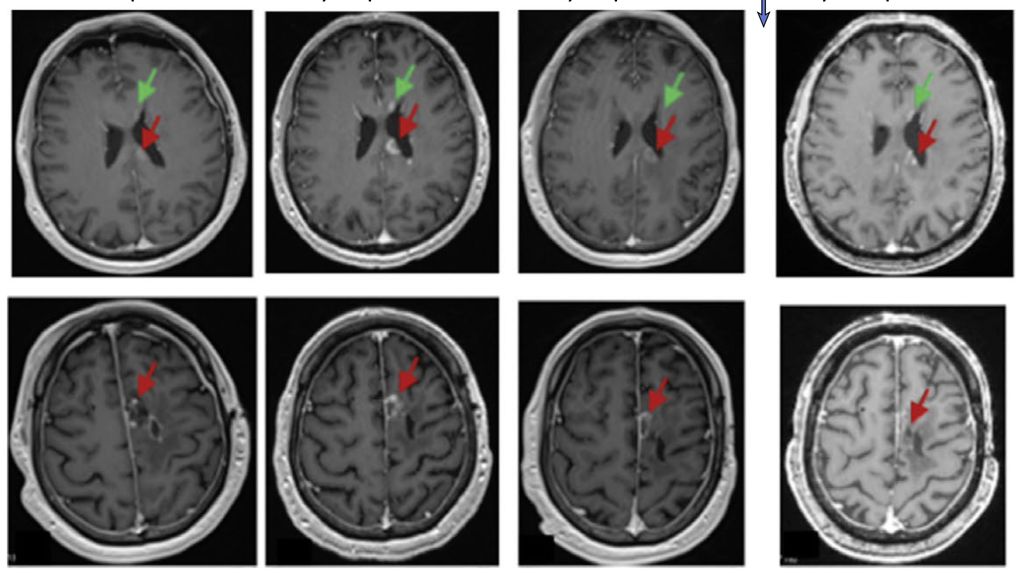
«Zu den Herausforderungen bei diesen Tumoren gehören die Heterogenität der exprimierten Tumorantigene und das immunsuppressive Tumormilieu», erklärte Prof. Dr. med. Denis Migliorini (Genf, Schweiz). Im vergangenen Jahr erregten verschiedene Publikationen zum Einsatz von CAR-T-Zellen beim Glioblastom grosse Aufmerksamkeit. Darunter war eine PhaseI-Studie zu intrathekal verabreichten CAR-T-Zellen, die sowohl gegen den epidermalen Wachstumsfaktor-Rezeptor (EGFR) als auch den Interleukin-13-Rezeptor-α2 (IL13Rα2) gerichtet sind (Abb.1).3
Abb. 1: Beispiel der MRT eines Patienten mit Glioblastom von einem Monat vor Verabreichung der CAR-T-EGFR-IL13Rα2-Zellen (Dosis-Level 2) bis zu drei Monaten nach der Verabreichung der CAR-T-Zellen. Axiale Gadolinium-verstärkte T1-gewichtete Bilder zeigten am Tag –1 vermehrt verstärkte Krankheitsherde, auch im Corpus callosum (oberes Feld, roter Pfeil), entlang der ependymalen Oberfläche des linken Seitenventrikels (oberes Feld, grüner Pfeil) und um die der linken frontalen Resektionshöhle (unteres Feld, roter Pfeil). Am Tag +1 aufgenommene Bilder, die vor der Verabreichung von Steroiden aufgenommen wurden, zeigen einen Rückgang an allen Stellen. Die Läsionen waren am Tag +28 stabil und blieben zum 3-Monats-MRT-Zeitpunkt unverändert (Quelle: Bagley SJ et al. 2024)3
«Wie wir anhand der Daten der ersten sechs Teilnehmenden dieser Studie gesehen haben, zeigte die Behandlung eine unmittelbare, potente Antitumoraktivität», so der Redner. Allerdings war die Ansprechdauer kurz und es wurde eine signifikante, wenn auch in allen Fällen reversible Neurotoxizität beobachtet. Prof. Migliorini und sein Team suchten gezielt nach weiteren Antigenen, die als Zielstrukturen für eine CAR-T-Zell-Therapie infrage kommen. Ihre Wahl fiel auf PTPRZ1 («protein tyrosine phosphatase receptor type Z1»).4 Zudem entschieden sie sich für eine mRNA-basierte Herstellung der CAR-T-Zellen, im Gegensatz zum üblichen Vorgehen der viralen Transduktion.
«Im klinischen Kontext eines Glioblastoms erscheint mir das interessant, da das Einbringen von mRNA nur zu einer vorübergehenden Expression des CAR führt und womöglich einen sicheren Ansatz darstellt», erklärte er. Zudem sei der Herstellungsprozess der CAR-T-Zellen dadurch weniger zeitintensiv, was ebenfalls einen Vorteil darstellt.
In einer präklinischen Studie zeigten gegen PTPRZ1 gerichtete CAR-T-Zellen spezifische Zytotoxizität gegenüber PTPRZ1-exprimierenden Glioblastomzellen.4 «Bemerkenswert war zudem, dass diese CAR-T-Zellen auch benachbarte Tumorzellen ohne PTPRZ1-Expression durch einen Bystander-Effekt zu zerstören vermochten, während gesundes Gewebe verschont blieb», so Prof. Migliorini.
Eine weitere Forschungsgruppe untersuchte an einem präklinischen Mausmodell den Effekt einer gegen ROBO1 («roundabout guidance receptor 1») gerichteten CAR-T-Zell-Therapie.5 Eine einzelne Dosis dieser CAR-T-Zellen führte zu einer Verdopplung der medianen Überlebenszeit bei rezidivierten Glioblastomen. Die gleiche Studie untersuchte die Wirksamkeit von ROBO1-CAR-T-Zellen bei anderen Hirntumoren.
In Modellen zum pädiatrischen rezidivierten Medulloblastom und zu Erwachsenen mit Hirnmetastasen bei einem Lungenkarzinom führten die ROBO1-CAR-T-Zellen bei 50% bis 100% der Mäuse zu einer Tumoreradikation. In einer Proof-of-Principle-Studie wurde schliesslich vor Kurzem der Einsatz von PTPRZ1-gerichteten TCR(«T-cell receptor engineered»)-T-Zellen untersucht, die von einem geimpften Glioblastompatienten stammten.6 «Eine klinische Studie dazu befindet sich in Vorbereitung», erklärte Prof. Migliorini.
CAR-T-Zell-Therapie bei Autoimmunerkrankungen
Neben dem Einsatz von CAR-T-Zellen bei soliden Tumoren war ein weiteres zentrales Thema des Meetings die Anwendung dieser Therapieform bei Autoimmunerkrankungen. So berichtete Dr. med. Johanna Richter über den Einsatz einer CD19-gerichteten CAR-T-Zell-Therapie bei fünf Personen mit multipler Sklerose.
«Unser Ziel war, die Wirksamkeit und Sicherheit dieser Therapie bei multipler Sklerose zu untersuchen», sagte sie. Ein Patient litt an einer primär progredienten multiplen Sklerose (MS), eine Patientin an einer sekundär progredienten MS und die drei übrigen an einer schubförmig-remittierend verlaufenden MS (die Resultate der zwei progredienten Personen wurden bereits publiziert).7 Das mittlere Alter lag bei 35 Jahren und die mittlere Krankheitsdauer bei acht Jahren. Alle fünf untersuchten Personen waren stark vorbehandelt, unter anderem mit Anti-CD20-Antikörpern. Nach einer Standard-Lymphodepletion erhielten alle Teilnehmenden 1,1x108 vollständig humane CD19-gerichtete CAR-T-Zellen der zweiten Generation (KYV-101).
«Alle Patientinnen und Patienten zeigten eine Expansion der CAR-T-Zellen im peripheren Blut, allerdings war die Persistenz relativ kurz», erklärte Richter. Bei allen konnte zudem eine CAR-T-Zell-Expansion im Liquor nachgewiesen werden. «Verglichen mit dem peripheren Blut zeigte sich im Liquor eine relative Anreicherung der CAR-T-Zellen», ergänzte sie.
Im MRI konnte bei drei der Teilnehmenden zu verschiedenen Zeitpunkten nach der CAR-T-Zell-Infusion eine einzelne, nicht Gadolinium-anreichernde Rückenmarksläsion nachgewiesen werden.
«Diese Läsionen gingen jedoch nicht mit klinischen Symptomen einher und ihre Ätiologie ist bis zum jetzigen Zeitpunkt unklar», so die Referentin. Der mittlere EDSS(«expanded disability status scale»)-Score blieb bei vier der fünf MS-Betroffenen über einen mittleren Zeitraum von 8,7 Monaten stabil.
«Die intrathekale Antikörperproduktion nahm bei vier der fünf Teilnehmenden prompt bis zum Tag 14 nach der CAR-T-Zell-Infusion ab. In einem Fall verschwanden die Antikörper vorübergehend ganz. Bei drei Teilnehmenden nahm die Antikörperproduktion anschliessend allmählich wieder zu, was für einen expansionsabhängigen Effekt spricht», sagte Richter.
Zufriedenstellendes Sicherheitsprofil
Das Sicherheitsprofil der CAR-T-Zell-Therapie erwies sich insgesamt als zufriedenstellend. Es trat kein Fall eines Immuneffektorzell-assoziierten Neurotoxizitätssyndroms (ICANS) auf. Bei vier Studienteilnehmenden kam es zu einem Zytokinfreisetzungssyndrom (CRS) vom Grad 1, das sich gut managen liess. Daneben traten verschiedene ebenfalls gut behandelbare hämatologische Toxizitäten (Anämie [Grad3], Neutropenie [Grad 2 bis 4], Thrombozytopenie [Grad 1]) sowie eine Erhöhung der Transaminasen auf (drei Patient:innen mit Grad 3).
Zweite CAR-T-Zell-Infusion durchgeführt
Der Studienteilnehmer mit der geringsten CAR-T-Zell-Expansion (primär progrediente MS) erhielt 265 Tage nach der ersten eine zweite KYV-101-Infusion. In der Folge zeigte sich jedoch keinerlei CAR-T-Zell-Expansion im peripheren Blut.
Richter fasste zusammen: «Unsere bisherigen Analysen zeigen, dass KYV-101 ein zufriedenstellendes Sicherheitsprofil bei stark therapierefraktären MS-Betroffenen aufweist. Die beobachtete Kinetik der CAR-T-Zellen weist auf einen vorübergehenden expansionsabhängigen Effekt hin. Zudem ist dies die erste Beschreibung einer zweiten CD19-gerichteten CAR-T-Zell-Infusion bei MS. Es ist nun wichtig, dass weitere Forschungen zu dieser Therapieform bei MS durchgeführt werden.»
Quelle:
7th European CAR T-cell Meeting, 6.–8.2.2025, Strassburg, Frankreich, und online
Literatur:
1 Spear P et al.: NKG2D ligands as therapeutic targets. Cancer Immun 2013; 13: 8 2 Weber JC: Development and preclinical assessment of ROR2-specific CAR-T cells for the treatment of clear cell renal cell carcinoma and multiple myeloma. Doctoral thesis for a doctoral degree at the Graduate School of Life Sciences, Julius-Maximilians-Universität Würzburg, Section Infection and Immunity. 2022. Verfügbar unter urn:nbn:de:bvb:20-opus-310399 3 Bagley SJ et al.: Intrathecal bivalent CAR T cells targeting EGFR and IL13Rα2 in recurrent glioblastoma: phase 1 trial interim results. Nat Med 2024; 30(5): 1320-9 4 Martinez Bedoya D et al.: PTPRZ1-targeting RNA CAR T cells exert antigen-specific and bystander antitumor activity in glioblastoma. Cancer Immunol Res 2024; 12(12): 1718-35 5 Chokshi CR et al.: Targeting axonal guidance dependencies in glioblastoma with ROBO1 CAR T cells. Nat Med 2024; 30(10): 2936-46 6 Chih YC et al.: Vaccine-induced T cell receptor T cell therapy targeting a glioblastoma stemness antigen. Nat Commun 2025; 16(1): 1262 7 Fischbacher F et al.: CD19-targeted chimeric antigen receptor T cell therapy in two patients with multiple sclerosis. Med 2024; 5(6): 550-558.e2
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...