CARs, TRUCKs und die nächste Generation der T-Zell-Therapie
Autor:innen:
Dr. Astrid Holzinger
Dr. Markus Barden
Prof. Dr. Hinrich Abken
Leibniz-Institut für Immuntherapie, Abteilung Gen-Immuntherapie, Regensburg
Korrespondenz:
E-Mail: hinrich.abken@ukr.de
Chimäre Antigenrezeptor(CAR)-T-Zellen sind synthetisch reprogrammierte Immunzellen („living drugs“) mit Effektorfunktionen für die zielgerichtete Therapie von Krebs, Autoimmunerkrankungen und chronischen Entzündungen. Während derzeit CAR-T-Zellen erfolgreich in der Behandlung hämatologischer Neoplasien eingesetzt werden, nutzt die nächste CAR-Generation zusätzlich Zytokine und deren Signale, um die T-Zell-Antwort gegen solide Tumoren zu stärken und weitere Immunzellen zu rekrutieren.
Keypoints
-
Die CAR-T-Zell-Therapie ist erfolgreich als Therapie von Leukämien und Lymphomen.
-
Das immunsuppressive Milieu solider Tumoren supprimiert die CAR-T-Zellen, was bisher größere Therapieerfolge verhindert hat.
-
Die Wirksamkeit der CAR-T-Zellen gegen solide Tumoren soll durch Integration eines Zytokinsignals gesteigert werden.
Wo stehen wir in der CAR-T-Zell-Therapie?
Das Konzept der CAR-T-Zell-Therapie basiert darauf, eigene T-Zellen von Patient:innen spezifisch gegen definierte Zielstrukturen auf den Tumorzellen zu richten, um die Tumoren erfolgreich zu eliminieren. Die CAR-vermittelte Aktivierung der Effektorfunktionen nach Bindung der T-Zelle an die Zielstrukturen spielt dabei eine entscheidende Rolle. CAR-T-Zellen werden erfolgreich in der Therapie hämatologischer Tumorerkrankungen eingesetzt, z.T. mit lang anhaltenden Remissionen und Persistenz der CAR-T-Zellen für mehr als zehn Jahre.1
In der EU sind derzeit sechs kommerzielle CAR-T-Zell-Produkte zugelassen,2 einige werden bereits in der Zweitlinientherapie eingesetzt.3 Die European Society for Blood and Bone Marrow Transplantation (EBMT) hat für Europa 10000 Patient:innen mit CAR-T-Zell-Therapie registriert,4 die Gesamtzahl der weltweit mit CAR-TZell-Produkten behandelten Patient:innen beläuft sich auf ein Vielfaches.
CAR-T-Zellen werden von der Europäischen Arzneimittelbehörde (EMA) als Arzneimittel für neuartige Therapien („advanced therapy medicinal products“, ATMP) klassifiziert und folgen als „living drugs“ nicht den klassischen Konzepten der Pharmakodynamik und Pharmakokinetik.5 Im Gegensatz zu klassischen Arzneimitteln stellen CAR-T-Zellen keine chemisch definierte Substanz dar, sondern eine heterogene Zellpopulation mit der Fähigkeit, in Gewebe einzuwandern und nach Bindung an die Zielstruktur und CAR-vermittelter Aktivierung zu proliferieren, immunmodulatorische Substanzen freizusetzen und Effektorfunktionen auszuüben.
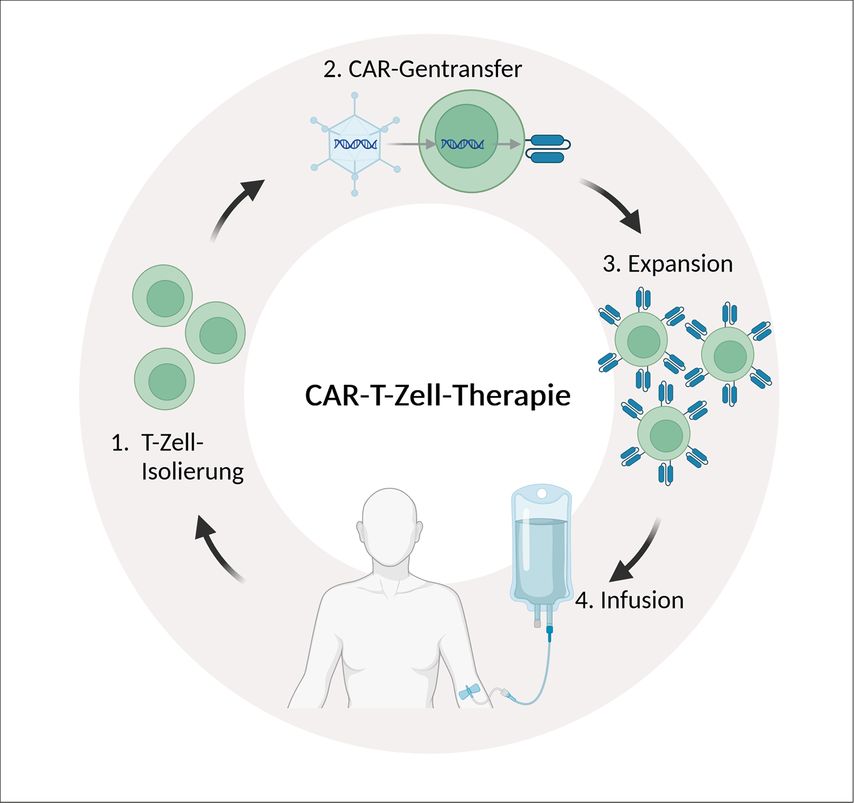
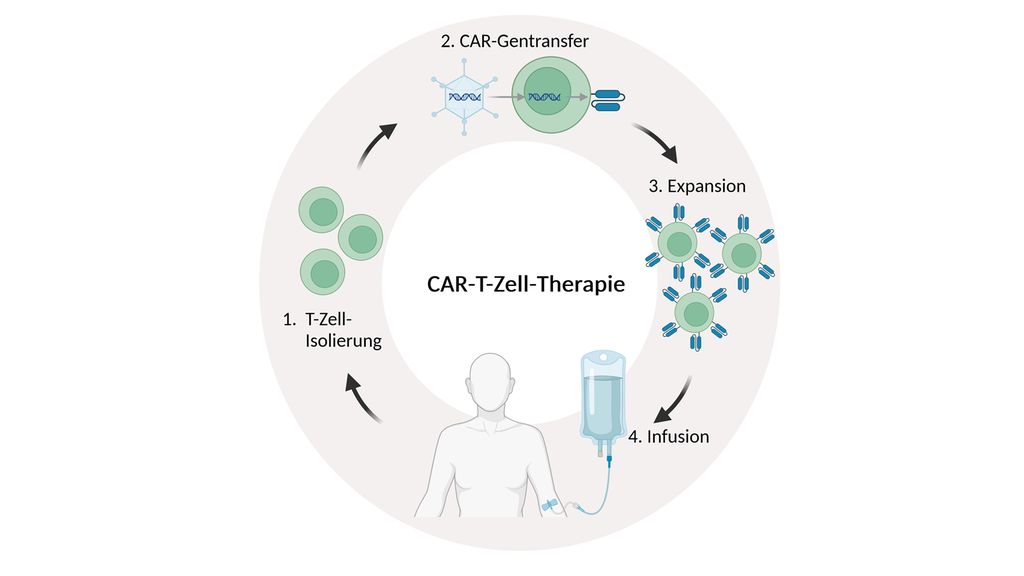
Die Herstellung der CAR-T-Zellen erfolgt ex vivo mittels „genetic engineering“; die CAR-codierende RNA oder DNA wird mithilfe viraler oder nonviraler Vektoren in T-Zellen übertragen und der CAR wird auf der T-Zell-Oberfläche exprimiert. Die individuell hergestellten CAR-T-Zellen werden expandiert und den Patient:innen nach Lymphodepletion („Präkonditionierung“) reinfundiert (Abb. 1). Neuere Entwicklungen streben die Herstellung allogener CAR-T-Zell-Produkte an, die für eine große Anzahl Patient:innen und im Voraus produziert werden können („Off-the-shelf“ CAR-T-Zellen).
Abb. 1: Herstellung der CAR-T-Zellen. Die T-Zellen des Patienten/der Patientin werden durch Leukapherese gewonnen, ex vivo zur Expression des CAR genetisch modifiziert und anschließend amplifiziert, sodass genügend CAR-T-Zellen zur Infusion zurück in den Patienten/die Patientin zur Verfügung stehen
CARs sind synthetische, modular aufgebaute Transmembranrezeptoren, die Bestandteile von Antikörpern als Bindestruktur und vom physiologischen T-Zell-Rezeptor (TCR) als Signalstruktur in einem „chimären Antigenrezeptor“ vereinen.
In der ersten Generation der CARs ist ein Einzelkettenantikörper („single chain fragment of variable regions“, scFv) als Bindedomäne mit der intrazellulären CD3ζ-Kette des TCR als Signaldomäne verknüpft. Die antikörpervermittelte, Haupt-histokompatibilitätskomplex(MHC)-unabhängige Erkennung ist ein Vorteil der CARs, da sich viele Tumorzellen durch Verlust der MHC-vermittelten Antigenpräsentation der T-Zell-Erkennung entziehen.
Die zweite CAR-Generation beinhaltet neben der CD3ζ-Kette eine kostimulatorische Signaldomäne, meist CD28 oder 4-1BB. Die Kostimulation ist zur Aufrechterhaltung der T-Zell-Antwort essenziell, verbessert die Persistenz der CAR-T-Zellen und ist für anhaltende Tumorremissionen entscheidend. Es wurde gezeigt, dass die CD28-Kostimulation den Glukosestoffwechsel beeinflusst und T-Zellen zu einem „Effector memory“-Phänotyp konvertiert, wohingegen die 4-1BB-Kostimulation die mitochondriale Atmungskette stimuliert und einen „Central memory“-Phänotyp induziert.6 Die derzeit zugelassenen CAR-T-Zell-Produkte sind CARs der zweiten Generation. Die dritte CAR-Generation beinhaltet zwei kostimulatorische Domänen.
Bei allem Erfolg in der Hämatoonkologie ist die Situation in der Behandlung solider Tumoren komplexer, da die Tumorzellen in einen kompakten Zellverband („Stroma“) mit immunsuppressiven Eigenschaften eingebunden sind, der den Angriff durch CAR-T-Zellen aktiv supprimiert. Diese Situation verlangt nach einem verbesserten CAR-Design und einer optimierten Pharmakologie, um die CAR-T-Zell-Therapie solider Tumoren erfolgreich zu machen.7
Derzeit werden mehrere Defizite der CAR-T-Zellen diskutiert, u.a. die zu kurze Dauer der T-Zell-Aktivierung. T-Zellen regulieren physiologisch ihre Aktivierung in einem selbstlimitierenden Prozess durch CD30-Interaktion mit dem CD30-Liganden (CD30L), was eine überschießende Immunantwort verhindert. Um eine anhaltende Aktivierung der CAR-T-Zellen zu erzielen, kann die CD30/CD30L-Interaktion blockiert werden, beispielsweise durch eine zusätzliche, CD30-blockierende Domäne im CAR. Derartige CAR-T-Zellen zeigen eine verlängerte Aktivität gegen solide Tumoren in präklinischen Modellen.8
Zytokine: Werkzeuge für verbes-serte Therapie solider Tumoren
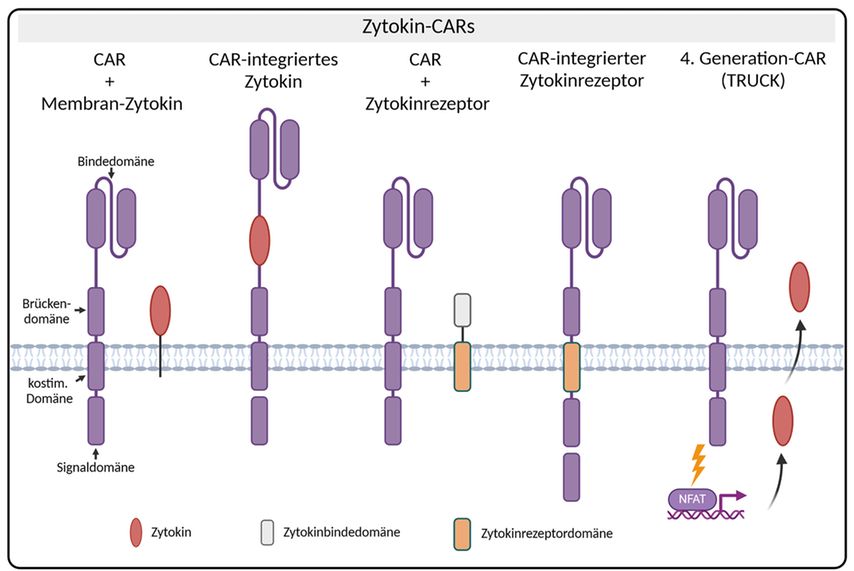
Zwar liefert der CAR der zweiten Generation das primäre und kostimulatorische Signal, nach dem „3-Signal-Paradigma“ der T-Zell-Aktivierung fehlt jedoch das Zytokinsignal als drittes Signal. Mithilfe der Strukturbiologie und den Möglichkeiten des molekularen Engineerings wurden verschiedene Konzepte entwickelt, wie das Zytokin in den CAR integriert werden kann (Abb. 2).
Abb. 2: Übersicht über Zytokin-CARs: Das Konzept der Zytokin-CARs beruht auf einem CAR der zweiten Generation, der durch ein zusätzliches Zytokinsignal verstärkt wird. Strukturell gibt es mehrere Möglichkeiten: die Verankerung des Zytokins in der Zellmembran oder im extrazellulären Teil des CAR, die Verankerung der Signaldomäne eines Zytokinrezeptors in der Zellmembran oder im intrazellulären Teil des CAR sowie die induzierte Freisetzung des Zytokins nach CAR-Aktivierung (TRUCK)
Grundsätzlich besteht die Möglichkeit, das Zytokin mit einer flexiblen Brücke in der Zellmembran der CAR-T-Zelle zu verankern, sodass das Zytokin an den jeweiligen Rezeptor binden kann. Des Weiteren kann verankertes IL-18 beispielsweise mit dem intrazellulären Toll-like-Rezeptor 4 (TLR4) und konstitutiv-aktivem CD40 in einem hybriden Transmembranprotein verbunden werden, das die Aktivierung mehrerer Signalwege vermittelt und somit die Effektorfunktionen der CAR-T-Zelle erhöht.9
Zytokine können alternativ in den extrazellulären Teil des CAR integriert werden, um dessen Aktivität weitgehend auf die CAR-T-Zelle zu beschränken. Ein Beispiel ist die Integration des IL-12 in den CAR, der neben der Tumorspezifität durch die Bindedomäne eine der NK-Zelle ähnliche Funktionalität in der T-Zelle induziert.10
Ein weiteres Konzept basiert auf einem hybriden Zytokinrezeptor, wobei die extrazelluläre Bindedomäne und die intrazelluläre Signaldomäne von unterschiedlichen Rezeptoren stammen. In einem „Switch“-Rezeptor kann die Bindung eines inhibierenden Zytokins einen aktivierenden Signalweg induzieren oder umgekehrt.11 Alternativ kann die intrazelluläre Zytokinrezeptordomäne in den intrazellulären Teil des CAR integriert sein. Hierbei ergibt sich die Schwierigkeit, die Signaldomäne so zu positionieren, dass die Rekrutierung der unterschiedlichen Signalmoleküle in dem hybriden Konstrukt noch gewährleistet ist.
Möglicherweise reichen CAR-T-Zellen allein nicht aus, um solide Tumoren vollständig zu eliminieren, und es bedarf der Hilfe weiterer Immunzellen, um auch diejenigen Tumorzellen zu erkennen, die durch Antigenverlust unsichtbar für die CAR-T-Zellen geworden sind. Die vierte CAR-Generation, sogenannte TRUCKs („T cells redirected for unrestricted cytokine killing“), kann durch induzierbare Freisetzung eines Zytokins oder auch eines anderen pharmazeutisch wirksamen Proteins im Zielgewebe andere Immunzellen aktivieren.12
Die Produktion des transgenen Zytokins ist an einen Transkriptionsfaktor gekoppelt, der nach CAR-Aktivierung und somit im Tumor in der T-Zelle bereitgestellt wird; sobald die CAR-T-Zelle das Tumorgewebe verlässt, enden die CAR-Aktivierung und somit die Produktion des Zytokins. Die meisten Zytokine üben pleiotrope Funktionen aus und wirken auf mehrere Zellen, was das Risiko für Nebenwirkungen bei einer systemischen Gabe erhöht und somit dosislimitierend ist. Durch die CAR-induzierbare Freisetzung vermeiden TRUCKs mögliche systemische Nebenwirkungen. Ein GD2-spezifischer CAR mit induzierbarer IL-18-Freisetzung zur Behandlung GD2-positiver solider Tumoren ist derzeit in der klinischen Erprobung (EU CT 2022-501725-21-00).13
Insgesamt ermöglichen die verschiedenen Konstruktionen eines Zytokin-CAR eine lokale Wirkung der Zytokine und eine Feinregulation der CAR-T-Zell-Antwort. Des Weiteren kann die endogene Antitumorantwort durch das Zytokinsignal nachhaltig moduliert werden, um die Effizienz der CAR-T-Zellen zu erhöhen und letztlich die Therapie solider Tumoren zu ermöglichen.
Literatur:
1 Melenhorst JJ et al.: Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature 2022; 602(7897): 503-9 2 Bellino S et al.: Cell-based medicinal products approved in the European Union: current evidence and perspectives. Front Pharmacol 2023; 14: 1200808 3 Westin J, Sehn LH: CAR T cells as a second-line therapy for large B-cell lymphoma: a paradigm shift? Blood 2022; 139(18): 2737-46 4 EBMT: The EBMT reaches major milestone: 10,000 CAR-T treated patients registered in its registry. Online unter https://www.ebmt.org/ebmt/news/ebmt-reaches-major-milestone-10000-car-t-treated-patients-registered-its-registry 5 Holzinger A, Abken H: Treatment with living drugs: pharmaceutical aspects of CAR T cells. Pharmacology 2022; 107(9-10): 446-63 6 Kawalekar OU et al.: Distinct signaling of coreceptors regulates specific metabolism pathways and impacts memory development in CAR T cells. Immunity 2016; 44(2): 380-90 7 Rojas-Quintero J et al.: Car T cells in solid tumors: overcoming obstacles. Int J Mol Sci 2024; 25(8): 4170 8 Hombach AA et al.: Blocking CD30 on T cells by a dual specific CAR for CD30 and colon cancer antigens improves the CAR T cell response against CD30− tumors. Mol Ther 2019; 27: 1825-35 9 Blokon-Kogan D et al.: Membrane anchored IL-18 linked to constitutively active TLR4 and CD40 improves human T cell antitumor capacities for adoptive cell therapy. J Immunotherap Cancer 2022; 10: e001544 10 Hombach A et al.: IL12 integrated into the CAR exodomain converts CD8+ T cells to poly-functional NK-like cells with superior killing of antigen-loss tumors. Mol Ther 2022; 30(2): 593-605 11 Mohammed S et al.: Improving chimeric antigen receptor-modified T cell function by reversing the immunosuppressive tumor microenvironment of pancreatic cancer. Mol Ther 2017; 25(1): 249-58 12 Chmielewski M et al.: Of CARs and TRUCKs: chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumor stroma. Immunol Rev 2014; 257(1): 83-90 13 Fischer-Riepe L et al.: Preclinical development of CAR T cells with antigen-inducible IL18 enforcement to treat GD2-positive solid cancers. Clin Cancer Res 2024; 30(16): 3564-577
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...