Chirurgische Behandlung von Lungenkrebs im Frühstadium
Autoren:
Prof. Dr. med. Isabelle Opitz
PD Dr. med. Sven Hillinger
Klinik für Thoraxchirurgie
Universitätsspital Zürich
E-Mail: isabelle.schmitt-opitz@usz.ch
Die operative Entfernung des primären Tumors mit den dazugehörigen Lymphknoten ist die leitliniengerechte Therapie des NSCLC im Frühstadium. Minimal invasive Techniken gelten heutzutage für die operative Behandlung als Standard. Parenchymsparende Segmentektomien werden bei Patienten mit funktioneller Einschränkung bei peripher gelegenen Tumoren mit kleinem Durchmesser bereits aktuell durchgeführt. Die postoperative Mortalität liegt in Zentren mit hohem Fallvolumen bei <1% und das onkologische Resultat minimalinvasiver Verfahren ist dem des offenen Vorgehens mindestens ebenbürtig. Die Früherkennung von Lungenkrebs mit Low-Dose-Computertomografie wird zukünftig in der Vorsorgemedizin Einzug halten und hierdurch können die Überlebensraten durch frühzeitige Diagnosestellung voraussichtlich noch weiter gesteigert werden.
Keypoints
-
Die chirurgische Therapie ist die leitliniengerechte Therapie des NSCLC im Frühstadium.
-
Minimal invasive Verfahren – VATS oder RATS – kommen dabei standardmässig zum Einsatz, die Mortalität liegt unter 1% und die Hospitalisationszeit beträgt nur wenige Tage. Gemäss den internationalen Fachgesellschaften sind jährlich mindestens 70anatomische Resektionen Voraussetzung, wünschenswert wären über 150 für ausgezeichnete Resultate.
-
Die Segmentektomie beim Lymphknoten-negativen Lungenkrebs <2cm ist voraussichtlich onkologisch äquivalent und erhält die Lungenfunktion der Patienten.
-
Die Lungenkrebsfrüherkennung mittels CT bei Risikokandidaten wird voraussichtlich zur Verbesserung des Langzeitüberlebens bei Lungenkrebspatienten beitragen.
Die chirurgische Resektion inklusive Lymphadenektomie ist ein zentraler Bestandteil der kurativen Behandlung des nicht kleinzelligen Bronchialkarzinoms (NSCLC), vor allem in den Frühstadien. Die Diskussion jedes einzelnen Patienten mit der Neudiagnose eines NSCLC in einem interdisziplinären Tumorboard ist heutzutage unabdingbar. Hierbei werden für diagnostische und therapeutische Modalitäten Zertifizierungen und eine standardisierte Qualitätssicherung gefordert. Gemäss der Deutschen Krebsgesellschaft sind mindestens 75 anatomische Resektionen pro Jahr Bedingung für eine Zertifizierung. Dem entspricht der Trend zur Etablierung sogenannter «High-volume»-Zentren, in welchen die Morbiditäts- und Mortalitätsraten durch die hohe Expertise aller beteiligten Spezialisten möglichst niedrig gehalten werden können, auch bei der Behandlung des Lungenkrebses.1–3
Entwicklung minimal-invasiver Techniken
Die videoassistierte thorakoskopische Chirurgie (VATS) wird heute standardmässig in den meisten Zentren eingesetzt.1;4–7 Speziell ältere Patienten und solche mit eingeschränkter Lungenkapazität profitieren hiervon sehr stark und es werden Mortalitätsraten <1% erreicht.5,7
Vergleichende Studien belegen die Überlegenheit der VATS gegenüber dem offenen Verfahren vor allem in der frühen postoperativen Phase.5 Durch die minimale Invasivität werden Gewebetrauma, Inflammation und postoperative Schmerzen vermindert und die Heilung wird beschleunigt.8 Die damit verbundene frühere Mobilisierung und die daraus resultierende Kostenersparnis durch die gesellschaftliche Wiedereingliederung wiegen den vordergründig höheren Kostenaufwand durch die modernere Technologie auf.8 Sogar eine bessere Compliance der Patienten für allfällig notwendige adjuvante Therapien konnte gezeigt werden.9 Eine prospektiv-randomisierte Studie an über 500 Patienten aus Grossbritannien (VIOLET) belegt einen klaren Vorteil der VATS gegenüber der offenen Technik in Bezug auf postoperative Schmerzen, Komplikationsrate, Hospitalisationszeit ohne Kompromisse hinsichtlich frühen onkologischen Outcomes einschliesslich Rezidivfreiheit und 1-Jahres-Überleben. Zusätzlich konnte eine bessere körperliche Funktion mit weniger Rehospitalisationen bei den minimal-invasiv operierten Patienten beobachtet werden.10
Die onkologischen Langzeitergebnisse unterscheiden sich nicht signifikant zwischen VATS und offener Resektion. In einer «Propensity-matched»-Analyse von über 1000 Patienten wurde sogar ein signifikant besseres «cancer specific survival» bei minimal-invasiv operierten Patienten festgestellt. In weiteren vergleichenden Studien wurde gezeigt, dass die VATS-Technik der offenen mindestens ebenbürtig ist.4,8
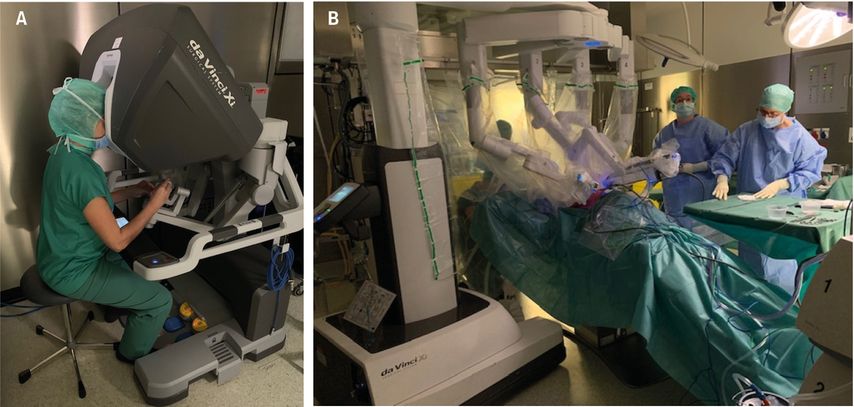
Als weiterer Fortschritt ist die Einführung der roboterassistierten thorakoskopischen Resektion (RATS) zu werten, wodurch anatomische Resektionen noch präziser11 (und für den Chirurgen ergonomischer) durchgeführt werden können. Dreidimensionale Sicht, zusätzliche Freiheitsgrade der Instrumente sowie zwei Operationskonsolen mit angekoppeltem Simulator eröffnen neue Dimensionen bei der täglichen Arbeit und auch bei der Weiterbildung (Abb. 1). Erwähnenswert ist hier der intuitive Umgang mit einer minimal invasiven Technik, welche den Umstieg von der offenen Chirurgie durch Anwendung moderner Technologien vereinfacht.12
Abb. 1: Roboterassistierte thorakoskopische Operation. A) Chirurg an der Konsole. B) Telemanipulator und Assistenten am Patienten
Die Kollegen in Shanghai konnten in einer grossen Metaanalyse mit über 11000 Patienten zeigen, dass die RATS der VATS in den relevanten Punkten wie Überleben, Rezidivfreiheit und Operationszeit mindestens gleichwertig ist, prospektive randomisierte Studien fehlen jedoch.13 Auch in einer retrospektiven multizentrischen Analyse der Datenbank der Society of Thoracic Surgeons für mehr als 13000 Stadium-I-und-II-NSCLC-Patienten bestätigte sich diese Äquivalenz von RATS und VATS-Resektionen.14
Zentral für die Wahl des Zugangs sind jedoch die entsprechende fachspezifische Expertise und Erfahrung des Chirurgen. Thoraxchirurgische Fachgesellschaften aus Europa bestätigen die Mindestzahl von 70 Lobektomien pro Jahr, wünschenswert wären über 150 für ausgezeichnete Resultate.15 Operationsdauer, Komplikationen und Hospitalisationszeit können so erheblich reduziert werden.2,3
Präzises Staging zur Optimierung der individualisierten Therapie
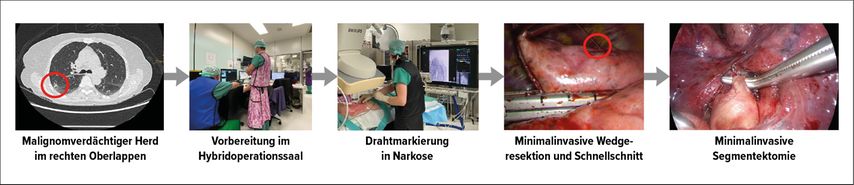
Ein exaktes prä-/intraoperatives Staging ist für eine korrekte und erfolgreiche Behandlung des NSCLC unverzichtbar. Zusätzlich zu den bekannten nicht invasiven bildgebenden Verfahren wie CT, MRT und PET kommen auch wenig invasive Biopsiemethoden zum Einsatz. Hier ist vor allem der endobronchiale Ultraschall (EBUS) zu erwähnen. Durch miniaturisierte Ultraschallköpfe (radiärer EBUS) lassen sich auch periphere Herde mit einer hohen Trefferquote (80%) erfassen.16 Die «rapid on-site»-Zytologie verkürzt die diagnostischen Wege und Wartezeiten und erlaubt so eine effizientere Behandlung des Patienten. Des Weiteren ist es durch die Einführung eines Hybridoperationssaales möglich, den kompletten Weg von der Diagnostik bis zur onkologisch korrekten Therapie in einem für die Patienten komfortablen «One-stop-shop»-Verfahren in einer Narkose zu durchlaufen (Abb. 2).
Abb. 2: Hybrid-OP, Klinik für Thoraxchirurgie, USZ: Hybridoperationssaal als «one stop shop» für Diagnose und Behandlung von Lungenkrebs
Die Frage, ob eine sublobäre anatomische Resektion (Segmentektomie) im Frühstadium des NSCLC onkologisch ausreichend ist, wird aktuell in vielen kontrolliert randomisierten Studien untersucht, jedoch konnte in einer umfangreichen Analyse der Daten der European Society of Thoracic Surgeons (ESTS) gezeigt werden, dass Morbiditäts- und Mortalitätsraten nach Segmentektomien mindestens ebenso niedrig sind wie nach Lobektomien.17
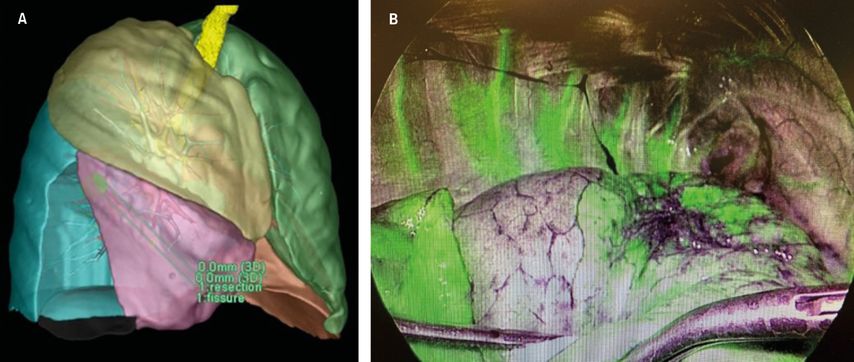
Für die präzise Festlegung der Resektionsgrenzen stehen sowohl präoperativ CT-gematchte anatomische Rekonstruktionen als auch intraoperative Injektionen (intravenös oder endobronchial) von fluoreszierenden Farbstoffen zur Verfügung (Abb. 3).18
Abb. 3: Neue Technologien zur Beurteilung der Segmentgrenzen. A: Virtual Reality Programme. B: Firefly (injizierter fluoreszierender Farbstoff)
Die Kollegen der japanischen Gesellschaft haben in einer prospektiven Studie die Sicherheit19 und einen signifikanten Überlebensvorteil bei Segmentektomien gegenüber Lobektomien bei Patienten mit nodal-negativem peripherem NSCLC <2cm Durchmesser und einem soliden Tumoranteil <50% zeigen können. Die Resultate weiterer prospektiv randomisierter Studien aus den USA und Europa werden in Kürze erwartet.
Lungenkrebs-Screening
Die Früherkennung des Lungenkrebses ist ebenso ein aktuelles Thema und scheint nach zwei internationalen Studien sehr vielversprechend hinsichtlich einer Verbesserung der Überlebensraten beim Lungenkrebs zu sein. So konnte in einer über 53000 Kandidaten umfassenden Risiko-Kohorte in den USA (NLST Trial) mittels Low-Dose-CT-Screenings eine Reduktion der krebsbedingten Mortalität um 20% gezeigt werden.20
Beim europäischen Pendant mit über 15000 Risiko-Kandidaten (NELSON-Trial) wurde diese Rate mittels Volumen-CT bei Männern um 26% und bei Frauen gar um über 40% gesenkt.21 Hierfür müssen nun an entsprechenden Zentren systematische Programme etabliert werden.
Im Rahmen einer offenen Beobachtungsstudie führen wir am USZ bei Raucherinnen und Rauchern, welche die Einschlusskriterien erfüllen (Alter: 55 bis 74 Jahre, 30 Jahre lang mindestens ein Paket pro Tag geraucht), eine Computertomografie zur Erkennung von Frühformen von Lungentumoren durch:
https://www.usz.ch/app/uploads/2020/11/Lungenkrebs-Screening.pdf (Kontakt: Lungenkrebs-Screening@usz.ch ). Eine schweizweite Initiative unter Einbezug aller involvierten Disziplinen (CH-LSIG) plant eine koordinierte Implementierung für die Schweiz.
Literatur:
1 Hoffmann H et al.: Surgical therapy for lung cancer: why it should be performed in high volume centers. Pneumologie 2020; 74(10): 670-7 2 Wang S et al.: Type and case volume of health care facility influences survival and surgery selection in cases with early-stage non-small cell lung cancer. Cancer 2019; 125(23): 4252-9 3 Stahel RA et al.: Survival outcome of non-small cell lung cancer patients: comparing results between the database of the Comprehensive Cancer Center Zürich and the Epidemiological Cancer Registry Zurich and Zug. Lung Cancer 2020; 146: 217-23 4 Petersen RH, Hansen HJ: Learning thoracoscopic lobectomy. Eur J Cardiothorac Surg 2010; 37: 516-20 5 Burt BM et al.: Thoracoscopic lobectomy is associated with acceptable morbidity and mortality in patients with predicted postoperative forced expiratory volume in 1 second or diffusing capacity for carbon monoxide less than 40% of normal. J Thorac Cardiovasc Surg 2014; 148: 19-29 6 Bendixen M et al.: Postoperative pain and quality of life after lobectomy via video-assisted thoracoscopic surgery or anterolateral thoracotomy for early stage lung cancer: a randomised controlled trial. Lancet Oncol 2016; 17: 836-44 7 Nasir BS et al.: Performing robotic lobectomy and segmentectomy: cost, profitability, and outcomes. Ann Thorac Surg 2014; 98: 203-8 8 Hartwig MG, D’Amico TA: Thoracoscopic lobectomy: the gold standard for early-stage lung cancer? Ann Thorac Surg 2010; 89: 2098-101 9 Petersen RP et al.: Thoracoscopic lobectomy facilitates the delivery of chemotherapy after resection for lung cancer. Ann Thorac Surg 2007; 83: 1245-9 10 Lim E et al.: Video-assisted thoracoscopic versus open lobectomy in patients with early-stage lung cancer: one-year results from a randomized controlled trial (VIOLET). J Clin Oncol 2021; 39(15 Suppl): 8504 11 Gallina FT et al.: Nodal upstaging evaluation after robotic-assisted lobectomy for early-stage non-small cell lung cancer compared to video-assisted thoracic surgery and thoracotomy: a retrospective single center analysis. Front Surg 2021; 8: 666158 12 Veronesi G et al.: Robot-assisted surgery for lung cancer: state of the art and perspectives. Lung Cancer 2016; 101: 28-34 13 Ma J et al.: Robot-assisted thoracic surgery versus video-assisted thoracic surgery for lung lobectomy or segmentectomy in patients with non-small cell lung cancer: a meta-analysis. BMC Cancer 2021; 21: 498-515 14 Louie BE et al.: Comparison of video-assisted thoracoscopic surgery and robotic approaches for clinical stage I and stage II non-small cell lung cancer using the Society of Thoracic Surgeons database. Ann Thorac Surg 2016; 102(3): 917-24 15 D’Amico T et al.: European guidelines on structure and qualification of general thoracic surgery. Eur J Cardiothorac Surg 2014; 45(5): 779-86 16 Herth FJ et al.: Endobronchial ultrasound-guided transbronchial lung biopsy in solitary pulmonary nodules and peripheral lesions. Eur Respir J 2002; 20: 972-4 17 Brunelli A et al.: Perioperative outcomes of segmentectomies versus lobectomies in high-risk patients: an ESTS database analysis. Eur J Cardiothorac Surg 2021; 59: 389-94 18 Wada H et al.: Near-infrared-guided pulmonary segmentectomy after endobronchial indocyanine green injection. Ann Thorac Surg 2020; 109(2): 396-403 19 Suzuki K et al.: Comparison of pulmonary segmentectomy and lobectomy: safety results of a randomized trial. J Thorac Cardiovasc Surg 2019; 158(3): 895-907 20 Aberle DR et al.: Reduced lung-cancer mortality with low-dose computed tomographic screening. NEngl J Med 2011; 365(5): 395-409 21 de Koning HJ et al.: Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020; 382(6): 503-13
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...