Ernährung, Mikrobiom und Krebs
Autorin:
Priv.-Doz. Priv.-Doz. Mag. Dr. Dr. Elisabeth Fabian, BSc
Klinische Abteilung für Innere Medizin II
Universitätsklinikum Krems an der Donau
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
E-Mail: elisabeth.fabian@krems.lknoe.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Ernährung ist ein Teil unseres Lebensstils. Neben dem präventiven Potenzial in Hinblick auf die Entstehung von Krebserkrankungen hat die täglich aufgenommene Nahrung auch einen erheblichen Einfluss auf die Zusammensetzung des intestinalen Mikrobioms. Dieses beeinflusst wiederum über komplexe Mechanismen u.a. das Ansprechen auf onkologische Therapien und die Progression vonKrebserkrankungen.
Keypoints
-
Ernährungsfaktoren verursachen schätzungsweise 5% bis 10% aller Krebserkrankungen.
-
Unsere Ernährungsweise hat einen erheblichen Einfluss auf die Zusammensetzung des intestinalen Mikrobioms, das durch verschiedene spezifische Mechanismen in die Kanzerogenese, das Ansprechen auf onkologische Therapien und die Progression der Erkrankung involviert ist.
-
Die spezifische Modulation des intestinalen Mikrobioms stellt daher zunehmend ein therapeutisches Ziel in der Onkologie dar.
-
Weitere Forschung wird benötigt, um das Potenzial der komplexen Interaktion zwischen Ernährung und intestinalem Mikrobiom in die klinische Anwendung zu bringen.
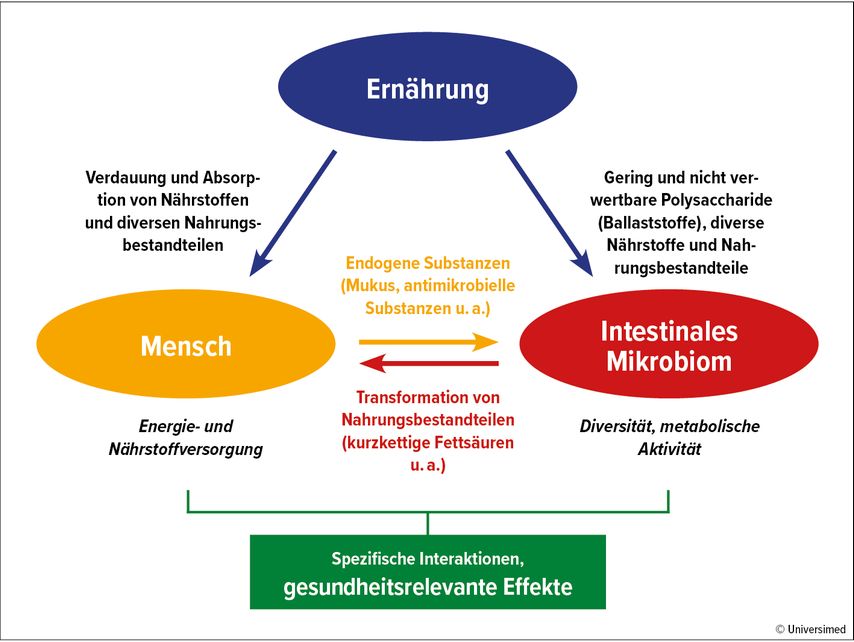
Ernährung ist ein Teil unseres Lebensstils, der einen starken Einfluss auf unsere Gesundheit hat. Sie liefert nicht nur dem menschlichen Körper Energie und Nährstoffe, sondern stellt auch das Substrat für Darmbakterien dar, wodurch sie das Wachstum einzelner Spezies begünstigt oder hemmt und somit die Zusammensetzung des intestinalen Mikrobioms maßgeblich beeinflusst (Abb. 1).5
Abb. 1: Einfluss von Ernährung auf den Menschen und das intestinale Mikrobiom und deren komplexe Interaktion. Ernährung hat sowohl direkte gesundheitsrelevante Effekte auf den Menschen als auch indirekte Effekte durch die Modulation des intestinalen Mikrobioms (modifiziert nach Fabian E, Krejs GJ)6
In den vergangenen Jahren hat die Forschung rund um das intestinale Mikrobiom gezeigt, dass eine Vielzahl von Erkrankungen mit einer veränderten Zusammensetzung des Spektrums der Darmbakterien assoziiert ist bzw. dass intestinale Keime einen zum Teil erheblichen Einfluss auf die Entstehung und/oder Progression von zahlreichen Erkrankungen haben können, so auch Krebserkrankungen.1–4
Die verschiedenen Mechanismen, die den komplexen Wechselwirkungen zwischen Mikrobiom und Mensch zugrunde liegen, werden aktuell intensiv beforscht und reichen von der bakterienspezifischen Modulation des Immunsystems bis hin zu Einflüssen auf Ebene der humanen Genexpression durch bakterielle Metaboliten.
Ernährung und Krebs
Eine Vielzahl von epidemiologischen Studien weist darauf hin, dass Ernährungsformen mit günstigem Ernährungsmuster (z.B. die mediterrane Diät) einen wesentlichen Einfluss auf die Prävention von verschiedenen Krebserkrankungen (z.B. Kolorektalkarzinom, Brust-, Magen-, hepatozelluläres und Prostatakarzinom) haben.7 Laut World Cancer Research Fund und International Agency for Research on Cancer stellen hinsichtlich des Zusammenhangs zwischen Ernährung und Krebsrisiko eine zu geringe Aufnahme an Ballaststoffen, Milch und Milchprodukten, Gemüse und Früchten sowie ein zu hoher Konsum an Alkohol und verarbeitetem Fleisch die wichtigsten Risikofaktoren dar.8 International wird geschätzt, dass Ernährungsfaktoren 5% bis 10% aller Krebsfälle verursachen;8 Berechnungen aus den USA geben den Anteil aller Krebserkrankungen, der auf suboptimale Ernährung und Übergewicht bzw. Adipositas zurückzuführen ist, sogar mit bis zu 18% an.9
Im Jahr 2022 wurden in Österreich etwa 42000 neue Krebsfälle diagnostiziert. Wenngleich die Ernährung als Risikofaktor je nach Tumorentität variiert, wären unter der allgemeinen Annahme eines Präventionspotenzials von rund 10% bis zu 4500 Krebsfälle durch eine ausgewogene Ernährung vermeidbar gewesen.8
Ernährung undintestinales Mikrobiom
Unsere Ernährungsweise hat einen erheblichen Einfluss auf die Zusammensetzung des intestinalen Mikrobioms. Eine eher pflanzlich betonte Kost fördert beispielsweise v.a. durch die Aufnahme von gering verwertbaren und unverdaulichen Polysacchariden (Ballaststoffen) das Wachstum von Spezies wie Faecalibacterium prausnitzii und Bakterien der Gattungen Prevotella, Roseburia und Akkermansia,1,10–12 die u.a. einen positiven Effekt auf das darmassoziierte Immunsystem und die Integrität der Darmbarriere haben.1
Je nach aufgenommener Ballaststoffart kommt es auch verstärkt zur bakteriellen Synthese von unterschiedlichen SCFA („short-chain fatty acids“: kurzkettige Fettsäuren, i.e. Acetat, Propionat, Butyrat), die nicht nur Energielieferanten für die Epithelzellen darstellen, sondern teils auch immunmodulierende Eigenschaften aufweisen. Pektine, Xylan, Cellulose und Gummi arabicum fördern z.B. insbesondere die Bildung von Acetat und Propionat, Butyrat entsteht hingegen durch Fermentation von Ballaststoffen wie resistenter Stärke und Fructooligosacchariden.13,14 V.a. Butyrat wird aufgrund seiner immunmodulierenden und antiinflammatorischen Eigenschaften eine krebspräventive Wirkung im Kolon zugeschrieben.15 Es gibt allerdings auch Hinweise darauf, dass diese SCFA die Hyperproliferation von intestinalen Epithelzellen begünstigt und die Zellseneszenz induziert,16,17 sodass die genaue Rolle von Butyrat in der Kanzerogenese weiterhin zu definieren bleibt.
Ein ungünstiges Ernährungsmuster (reich an Fett und rotem Fleisch, arm an komplexen Kohlenhydraten bzw. Ballaststoffen) fördert hingegen das Wachstum von intestinalen Bakterien (z.B. Bilophila wadsworthia), die vermehrt sekundäre Gallensäuren und weniger SCFA bilden.11 Diese mikrobiell modifizierten (sekundären) Gallensäuren gelangen durch den enterohepatischen Kreislauf wiederum in die Leber und die Zirkulation und können über Gallensäurerezeptoren u.a. metabolische Effekte im Körper maßgeblich beeinflussen.18 Weiters wird ihnen durch ihre immunmodulierende Wirkung ein Einfluss auf die Kanzerogenese zugeschrieben.19
Mikrobiom und Krebs
Krebspatient:innen weisen im Vergleich zu gesunden Menschen eine deutlich andere Zusammensetzung des intestinalen Mikrobioms bzw. eine Dysbiose auf.11,17,20 Beim Kolorektalkarzinom ist diese u.a. durch die Zunahme von Bakterien der Gattungen Bacteroides und Fusobacterium und durch die Reduktion von Bakterien der Ordnung Clostridiales charakterisiert.21 Insgesamt zeigt sich entlang der Adenom-Karzinom-Sequenz eine spezifische Veränderung des intestinalen Mikrobioms mit einer Vermehrung von Bakterien der Phyla Firmicutes und Actinobacteria sowie der Familie der Lachnospiraceae im Stadium von Adenomen und hyperplastischen Polypen und dem Anstieg von Bakterien aus den Familien Alcaligenaceae und Enterobacteriaceae (Phylum Proteobacteria) bei Vorliegen von Malignomen.4,22
Die Rolle des intestinalen Mikrobioms in der Pathogenese von Karzinomen ist komplex. Bakterien können das Tumorwachstum u.a. durch direkte Interaktion mit Krebszellen beeinflussen, produzieren aber auch Stoffwechselprodukte, die ihrerseits das Tumorwachstum fördern oder hemmen bzw. über die Stimulierung oder Unterdrückung der lokalen und systemischen Immunantwort das Tumorwachstum begünstigen oder unterdrücken.16,17,23
Eine durch Dysbiose gestörte intestinale Barriere und das Zusammenwirken von darmassoziiertem und systemischem Immunsystem stellen die Grundlage für den Einfluss des Mikrobioms auf die Pathogenese von Karzinomen auch außerhalb des Kolons dar. Zudem dürfte das jüngst entdeckte intratumorale Mikrobiom ebenfalls maßgeblichen Einfluss auf die Tumorprogression und das Therapieansprechen haben.24
V.a. Tumoren mit niedriger immunogener Aktivität zeigen ein schlechtes Ansprechen auf T-Zell-aktivierende Antitumortherapien (Anti-PD-1-, Anti-PD-L1-Therapie und Anti-CTLA4-spezifische monoklonale Antikörper). Aufgrund der immunmodulierenden Eigenschaften des intestinalen und intratumoralen Mikrobioms etabliert sich die spezifische Modifikation der Darmbakterien zunehmend als therapeutisches Ziel in der Onkologie.
Dabei zeigen erste Studien, dass das Ansprechen auf Anti-PD-1-Therapien bei initial therapierefraktären Melanompatient:innen durch fäkale Mikrobiomtransplantation und einen dadurch bedingten Anstieg von CD8+ zytotoxischen T-Zellen im Tumorgewebe induziert werden kann.25 Auch die Verabreichung von vier Clostridiales-Bakterienspezies (Roseburia intestinalis, Eubacterium hallii, Faecalibacterium prausnitzii und Anaerostipes caccae) wirkt über diesen Mechanismus im Tiermodell bei Melanomen und Kolorektalkarzinomen als alleinige systemische Immuntherapie.21 Weiters kann eine erhöhte Aufnahme von Ballaststoffen (>20g/Tag) über die damit einhergehende Modulation des intestinalen Mikrobioms das Therapieansprechen auf eine Anti-PD-1-Therapie verbessern und das progressionsfreie Überleben bei Melanompatient:innen signifikant verlängern. Die Verabreichung von probiotischen Bakterien wie Bifidobacterium longum 35624 und Lactobacillus rhamnosus GG hat hingegen keinen Effekt.26
Ernährung spielt als Einflussfaktor in Bezug auf das intestinale Mikrobiom aber nicht nur eine Rolle beim Ansprechen auf onkologische Therapien. So zeigte sich etwa bei Patient:innen mit Kolorektalkarzinom, dass ein durch Malnutrition verändertes Mikrobiom mit spezifischen immunologischen Veränderungen einhergeht, die in weiterer Folge eine Tumorprogression begünstigen.27 Diese Erkenntnisse unterstreichen das Potenzial des intestinalen Mikrobioms im therapeutischen Management von Krebspatient:innen und verdeutlichen den Stellenwert der Ernährung als Mikrobiom-modulierendes Element.
Zusammenfassung
Ernährung versorgt nicht nur den menschlichen Körper mit Energie und Nährstoffen, sondern stellt auch das Substrat und somit einen wesentlichen modulierenden Faktor für das intestinale Mikrobiom dar. Zunehmend wird nicht nur der präventive Effekt von Ernährung auf Krebserkrankungen, sondern auch deren Stellenwert in der Behandlung und im Langzeitmanagement von betroffenen Patient:innen deutlich. Wesentliche Effekte, wie ein verbessertes Ansprechen auf Immuntherapien oder die Progression der Krebserkrankung, werden dabei über komplexe immunologische Mechanismen durch das intestinale Mikrobiom vermittelt. Dessen spezifische Modifikation stellt daher zunehmend ein therapeutisches Ziel in der Onkologie dar. Weitere Forschung wird benötigt, um das Potenzial des intestinalen Mikrobioms in Hinblick auf die Prävention und Therapie von onkologischen Erkrankungen und den Stellenwert der Ernährung als Mikrobiom-modulierender Faktor in die klinische Anwendung zu bringen.
Dieser Artikel ist ein modifizierter Reprint: Fabian E: Ernährung, Mikrobiom und Krebs. wmw-skriptum 2024; 21(2): 4-6. Nachdruck mit freundlicher Genehmigung von Springer Verlag
Literatur:
1 Perler BK et al.: Annu Rev Physiol 2023; 85: 449-68 2 Solch RJ et al.: J Neurol Sci 2022; 434: 120166 3 Sepich-Poore GD et al.: Science 2021; 371(6536): eabc4552 4 Feng Q et al.: Nat Commun 2015; 6: 6528 5 Malesza IJ et al.: Cells 2021; 10(11): 3164 6 Fabian E, Krejs GJ: Universum Innere Medizin 2016; 3: 35-7 7 Schwingshackl L et al.: Nutrients 2017; 9: 1063 8 Rohrmann S: Ernährung aktuell 2024; 2: 12 9 Islami F et al.: CA Cancer J Clin 2018; 68(1): 31-54 10 Wu GD et al.: Science 2011; 334(6052): 105-8 11 Ou J et al.:Am J Clin Nutr 2013; 98(1): 111-20 12 De Filippo C et al.: Proc Natl Acad Sci U S A 2010; 107(33): 14691-6 13 Pryde SE et al.: FEMS Microbiol Lett 2002; 217(2): 133-9 14 Barcenilla A et al.: Appl Environ Microbiol 2000; 66(4): 1654-61 15 Singh N et al.: Immunity 2014; 40(1): 128-39 16 Hanahan D: Cancer Discov 2022; 12(1): 31-46 17 Tilg H et al.: Cancer Cell 2018; 33(6): 954-64 18 Ridlon JM et al.: Curr Opin Gastroenterol 2014; 30(3): 332-8 19 Sepich-Poore GD et al.: Science 2021; 371(6536): eabc4552 20 Bullman S et al.: Science 2017; 358(6369): 1443-8 21 Montalban-Arques A et al.: Cell Host Microbe 2021; 29(10): 1573-88.e7 22 Mori G et al.: Sci Rep 2018; 8(1): 10329 23 Xavier JB et al.: Trends Cancer 2020; 6(3): 192-204 24 Nejman D et al.:Science 2020; 368(6494): 973-80 25 Baruch EN et al.: Science 2021; 371(6529): 602-9 26 Spencer CN et al.: Science 2021; 374(6575): 1632-40 27 Chao X et al.: Clin Nutr 2022; 41(3): 632-44
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...