Mammakarzinom – S3-Leitlinien-Update
Bericht:
Dr. Kassandra Settele
Review von:
Prof. Dr. Vesna Bjelic-Radisic
Leiterin des Brustzentrums und der Abt. Senologie
Landesfrauenklinik
Helios Universitätsklinikum Wuppertal
Universität Witten/Herdecke
Die aktuelle Version 4 der S3-Leitlinie zu Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms wurde im Dezember 2017 veröffentlicht. Im Juni dieses Jahres gab es nun zum ersten Mal ein inhaltliches Update, das auf der Zulassung mehrerer CDK4/6-Inhibitoren für Patientinnen mit Fernmetastasen sowie positivem Hormonrezeptor- und negativem HER2-Status beruht.
Etwa drei Viertel aller Patientinnen mit Brustkrebs im Stadium IV weisen einen positiven Hormonrezeptor(HR)-Status und negativen HER2-Status auf. Während die endokrine Therapie für diese Patientinnen weiterhin das Therapiefundament bildet, kann durch die Kombination mit Cyclin-abhängigen Kinase(CDK)4/6-Inhibitoren eine verbesserte Wirksamkeit und eine eindrückliche Verlangsamung des Krankheitsprogresses erreicht werden.
Die Bindung von CDK4/6 an Cyclin D1 induziert das Startsignal für die Zellteilung durch die Phosphorylierung des Tumorsuppresorproteins Rb. Die Hemmung von CDK4 und CDK6 durch das Protein p16 ist bei Krebserkrankungen häufig gestört. Darüber hinaus findet sich insbesondere beim HR-positiven, HER2-negativen Mammakarzinom oft eine Überexpression von Cyclin D1, dem Bindungspartner von CDK4/6, und daher eine kontinuierliche Aktivierung des Cyclin-D1-CDK4/6-Komplexes. CDK4/6-Inhibitoren schreiten in den Zellzyklus ein und stören so die Proliferation maligner Zellen. 1
Mit Abemaciclib, Palbociclib und Ribociclib stehen derzeit drei Substanzen im Setting des metastasierten, HR-positiven und HER2-negativen Mammakarzinoms zur Verfügung.
Aktuelle Leitlinienempfehlungen
Die Leitlinienempfehlungen bei Patientinnen mit HR-positivem, HER2-negativem Brustkrebs, bei denen Fernmetastasen vorliegen, lauten wie folgt:
-
„Bei prämenopausalen Patientinnen sollte die endokrinbasierte Therapie mit einem CDK4/6-Inhibitor unter Ausschaltung der Ovarialfunktion und in Kombination mit einem Aromatasehemmer oder mit Fulvestrant erfolgen (in Abhängigkeit von der Vortherapie). (B, 1b)“2
-
Bei postmenopausalen Patientinnen wird in der Erstlinientherapie empfohlen: „Die Kombinationstherapien eines Aromatasehemmers oder Fulvestrant mit CDK 4/6-Inhibitoren sollte durchgeführt werden, sofern diese Substanzgruppe noch nicht eingesetzt wurde. (B, 1b)“2
-
In der Folgetherapielinie gilt für postmenopausale Patientinnen: „Sofern in der Erstlinie noch kein CDK4/6-Inhibitor eingesetzt worden war, sollte er in weiteren endokrinbasierten Therapielinien eingesetzt werden. (B, 1b)“2
Studienergebnisse
Diese Empfehlungen berufen sich auf die Ergebnisse der Studien MONARCH-2 und -3, PALOMA-1, -2 und -3 sowie MONALEESA-2, -3 und -7. Bis auf PALOMA-1 („open label“) handelt es sich bei all diesen Studien um randomisierte, kontrollierte und verblindete klinische Studien. Zum Zeitpunkt der Leitlinienerstellung zeigte die Evidenz sowohl für prä- als auch postmenopausale Patientinnen einen deutlichen Behandlungsvorteil der untersuchten CDK4/6-Inhibitoren in Bezug auf das progressionsfreie Überleben (PFS).
Die Studienergebnisse zum Gesamtüberleben (OS) waren zum Zeitpunkt der Leitlinienerstellung jedoch weniger eindeutig. Bei prä- bzw. perimenopausalen Patientinnen wurde ein signifikanter Überlebensvorteil lediglich unter Ribociclib beobachtet, wobei sich deutliche Effektunterschiede in Hinblick auf Alter, Therapielinie und Ethnie fanden. In der Erstlinientherapie der postmenopausalen Patientinnen hatte sich noch kein signifikanter OS-Vorteil gezeigt. Ein signifikanter Vorteil im OS wurde zwar bei Patientinnen in der Postmenopause in der Zweit- bzw. Folgelinientherapie mit Abemaciclib gesehen, für Palbociclib bzw. Ribociclib lag der OS-Vorteil in dieser Patientinnengruppe jedoch unter der Signifikanzgrenze.2
Es zeigte sich, dass unter Kombination mit CDK4/6-Inhibitoren im Vergleich zu alleiniger endokriner Therapie vermehrt unerwünschte Wirkungen auftraten, die jedoch mit supportiven Maßnahmen gut zu behandeln waren.2 Am häufigsten kam es zu Neutropenie (65%), Diarrhö (49%), Infektionen (44%), Übelkeit (40%), Fatigue (39%) und Leukopenie (35%). Diese treten meist früh im Behandlungsverlauf auf und können in vielen Fällen durch Dosisanpassung bzw. Behandlungsunterbrechung einfach gehandhabt werden, ohne dass ein negativer Effekt auf die Wirksamkeit entsteht.3
Die Datenlage ließ gemäß der Leitlinienautoren keine eindeutigen Rückschlüsse auf eine Verbesserung der Lebensqualität unter Therapie mit CDK4/6-Inhibitoren zu.2
Vor allem aufgrund der signifikanten Effekte auf das PFS entschieden die Ersteller der Leitlinie, dass die Evidenz insgesamt für den Einsatz einer Kombination aus CDK4/6-Inhibitoren und endokriner Therapie im Setting des metastasierten HR-positiven und HER2-negativen Mammakarzinoms, unabhängig vom Menopausenstatus, sprach.2 Mittlerweile wurden aktualisierte Ergebnisse zu den MONARCH-, PALOMA- und MONALEESA-Studien publiziert.
MONARCH-Studien
Die Phase-III-Studie MONARCH-2 untersuchte Abemaciclib plus Fulvestrant gegen Placebo plus Fulvestrant bei sowohl prä-/perimenopausalen Patientinnen unter Unterdrückung der Ovarialfunktion als auch postmenopausalen Patientinnen mit HR-positivem, HER2-negativem fortgeschrittenem Brustkrebs nach Progress unter einer endokrinen Therapie. Die Patientinnen wurden 2:1 randomisiert und erhielten kontinuierlich alle 12 Stunden 150mg Abemaciclib oder Placebo sowie 500mg Fulvestrant im empfohlenen Verabreichungsschema (im ersten Zyklus an Tag 1 und 15, danach am ersten Tag jedes 28-Tage-Zyklus).
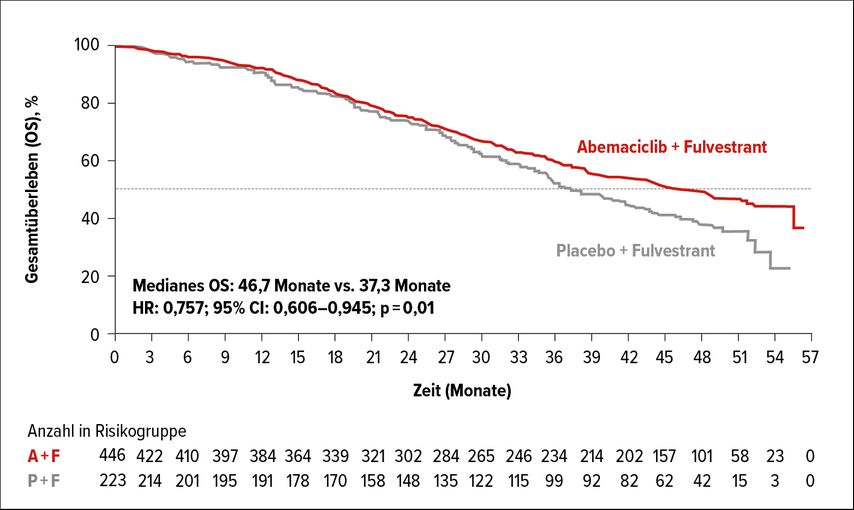
Nach einem medianen Follow-up von 47,7 Monaten konnte in der Interimsanalyse bereits ein signifikanter Vorteil für Abemaciclib hinsichtlich des OS gezeigt werden (HR: 0,757; 95% CI: 0,606–0,945; p=0,01). Das mediane OS betrug 46,7 Monate im Abemaciclib-Arm vs. 37,3 Monate im Placeboarm, entsprechend einer klinisch bedeutenden und statistisch signifikanten Verlängerung von 9,4 Monaten unter der Abemaciclib-Kombinationstherapie (Abb. 1).4
Abb. 1: Gesamtüberleben der Intention-to-treat-Population in der MONARCH-2-Studie (modifiziert nach Sledge GW et al.)4
In der aktuell im Journal „Breast Cancer Research“ publizierten Subgruppenanalyse der prämenopausalen Patientinnen aus MONARCH-2 betrug das mediane PFS zum zuvor spezifizierten Cut-off für die Interimsanalyse im Abemaciclib-Arm 28,6 Monate vs. 10,26 Monate im Placeboarm (HR: 0,477; 95%: CI: 0,302–0,755). In Bezug auf das OS konnte ein numerischer Vorteil für Abemaciclib beobachtet werden: Unter Abemaciclib war der Median noch nicht erreicht, während er unter Kombination mit Placebo bei 47,3 Monaten lag (HR: 0,689; 95% CI: 0,379–1,252). Diese Ergebnisse waren somit konsistent mit denen der Intention-to-treat-Population.5
In MONARCH-3 wurde die Therapie mit Abemaciclib/Placebo in der Erstlinie in Kombination mit Anastrozol oder Letrozol bei Patientinnen in der Postmenopause untersucht. Insgesamt waren 493 Patientinnen mit HR-positivem, HER2-negativem, fortgeschrittenem Brustkrebs ohne vorhergehende systemische Therapie in die Studie eingeschlossen. Die finale Analyse in Bezug auf den primären Endpunkt PFS wurde nach median 26,73 Monaten durchgeführt und zeigte einen statistisch signifikanten Vorteil für Abemaciclib mit einem medianen PFS von 28,18 Monaten vs. 14,76 Monate unter Placebo (HR: 0,540; 95% CI: 0,418–0,698; p=0,000002).6
PALOMA-3
Palbociclib wurde u.a. in der ebenfalls placebokontrollierten Phase-III-Studie PALOMA-3 in Kombination mit Fulvestrant bei Patientinnen mit HR-positivem, HER2-negativem Brustkrebs, die unter einer vorherigen endokrinen Therapie progredient waren, untersucht. Die Patientinnen erhielten 2:1-randomisiert 125mg Palbociclib oder Placebo p.o. 1x täglich für drei Wochen gefolgt von einer Woche Pause plus 500mg Fulvestrant im empfohlenen Schema.
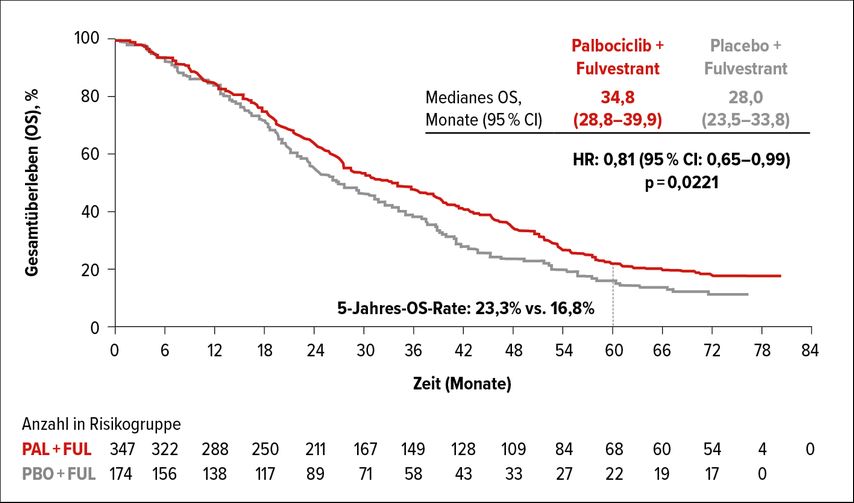
Beim Jahreskongress der American Society of Clinical Oncology (ASCO) 2021 stellte Dr. Massimo Cristofanilli die aktuellen Daten zum OS nach einem medianen Follow-up von 73,3 Monaten vor: Es konnte weiterhin ein Vorteil für Palbociclib gezeigt werden, mit einem medianen OS von 34,8 Monaten im Palbociclib-Arm vs. 28,0 Monate im Placeboarm. Dies entspricht einer klinisch bedeutsamen Reduktion des Risikos zu sterben um 19% (HR: 0,81; 95% CI: 0,65–0,99). Die OS-Rate nach fünf Jahren betrug 23,3% vs. 16,8% (Abb. 2). In der Subgruppenanalyse war ein OS-Benefit unabhängig vom Menopausenstatus zu sehen.7
Abb. 2: Gesamtüberleben in der PALOMA-3-Studie (modifiziert nach Cristofanilli M et al.)7
MONALEESA-7
MONALEESA-7 ist eine internationale, randomisierte, doppelt verblindete Phase-III-Studie, in der Ribociclib mit Placebo verglichen wird, jeweils in Kombination mit einer endokrinen Therapie. Im Gegensatz zu PALOMA-3 und den MONARCH-Studien wurden hier ausschließlich prämenopausale oder perimenopausale Patientinnen mit fortgeschrittenem HR-positivem und HER2-negativem Mammakarzinom eingeschlossen. In einer 1:1-Randomisierung erhielten die Probandinnen entweder 600mg Ribociclib p.o. 1x täglich für 21 Tage, gefolgt von 7 Tagen Pause, oder Placebo. Zu Beginn jedes 28-Tage-Zyklus wurden bei jeder Patientin einmalig 3,6mg Goserelin s.c. appliziert. Zusätzlich erhielten die Patientinnen entweder Letrozol (2,5mg), Anastrozol (1mg) oder Tamoxifen (20mg) einmal täglich p.o. Ein Cross-over zwischen den Gruppen war nicht gestattet.8
Die Kombination mit Ribociclib war derjenigen mit Placebo sowohl in Bezug auf den primären Endpunkt PFS als auch auf den sekundären Endpunkt OS signifikant überlegen: In der primären Analyse nach median 19,2 Monaten betrug das mediane PFS 23,8 Monate für Ribociclib (95% CI: 19,2 - nicht erreicht) vs. 13,0 Monate unter Placebo (95% CI: 11,0–16,4), entsprechend einer HR von 0,55 (95% CI: 0,44–0,69; p<0,0001). Der primäre Endpunkt war damit erreicht.9
In der vordefinierten Analyse nach 192 Todesfällen, die nach median 34,6 Monaten durchgeführt wurde, zeigte sich bei 37,6% der Patientinnen in der Ribociclib-Gruppe und 47,8% der Patientinnen in der Placebogruppe ein Krankheitsprogress. Die geschätzte OS-Rate nach 42 Monaten lag bei 70,2% (95% CI: 63,5–76,0) für Ribociclib vs. 46,0% (95% CI: 32,0–58,9) für Placebo. Das Risiko zu sterben war damit unter Ribociclib um 29% reduziert (HR: 0,71; 95% CI: 0,54–0,95).8
MONALEESA-2 & -3
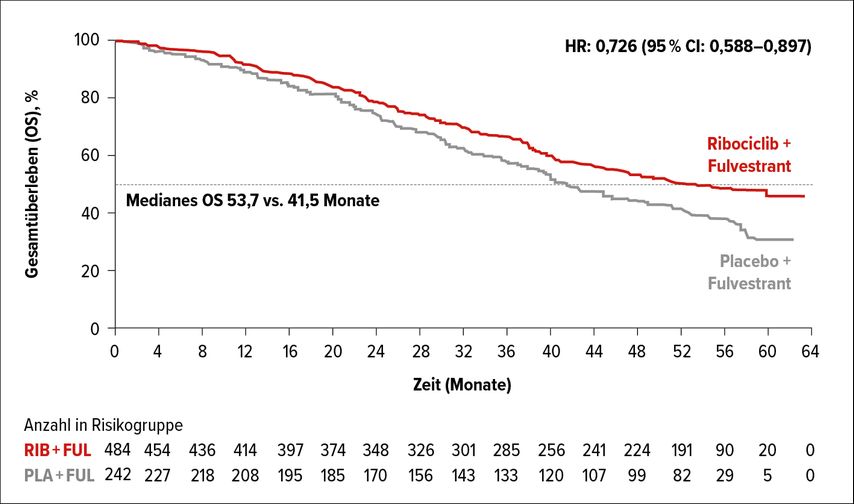
Auch die MONALEESA-3-Studie verglich bei Gabe von 500mg Fulvestrant i.m. im empfohlenen Schema 2:1- randomisiert Ribociclib in der oben angeführten Dosierung mit Placebo. Eingeschlossen wurden Frauen in der Postmenopause und Männer mit fortgeschrittenem HR-positivem und HER2-negativem Mammakarzinom in der Erst- oder Zweitlinie. Zum Zeitpunkt des Data-Cut-offs betrug das mediane OS unter Ribociclib 53,7 Monate vs. 41,5 Monate unter Placebo (HR: 0,73; 95% CI: 0,59–0,90), entsprechend einem signifikanten Vorteil für Ribociclib (Abb. 3). Die geschätzte 4- bzw. 5-Jahres-OS-Rate lag für Ribociclib bei 54% bzw. 46% und für Placebo bei 45% bzw. 31%.10
Abb. 3: Gesamtüberleben in der MONALEESA-3-Studie (modifiziert nach Slamon DJ et al.)10
In der MONALEESA-2-Studie wurde Ribociclib mit 2,5mg Letrozol bei postmenopausalen Patientinnen mit fortgeschrittenem, HR-positivem, HER2-negativem Brustkrebs in der Erstlinie angewendet. Das mediane PFS unter Ribocilib plus Letrozol war mit 25,3 Monaten gegenüber 16 Monaten unter Kombination mit Placebo ebenfalls verlängert (HR: 0,568; 95% CI: 0,457–0,704; p=9,63×10–8).11 Beim diesjährigen Jahreskongress der European Society of Medical Oncology (ESMO) wurden die OS-Daten nach einem medianen Follow-Up von 80 Monaten präsentiert: Das mediane OS betrug im experimentellen Arm 63,9 Monate vs. 51,4 Monate in der Kontrollgruppe (HR: 0,76; 95% CI: 0,63–0,93; p=0,004), entsprechend einer statistisch signifikanten und klinisch bedeutsamen Verlängerung um 12,5 Monate.12
Fazit und Ausblick
Insgesamt spricht die Evidenz sowohl bei prä-/perimenopausalen als auch postmenopausalen Patientinnen für einen Behandlungsvorteil der CDK4/6-Inhibitoren in Kombination mit endokriner Therapie gegenüber alleiniger endokriner Therapie.2 Das zeigte auch eine beim ASCO 2020 vorgestellte Metaanalyse der acht für die S3-Leitlinie herangezogenen Studien, die eine gepoolte HR für das PFS von 0,55 (95% CI: 0,50–0,59; p<0,00001) und für das OS von 0,75 (95% CI: 0,68–0,84; p<0,00001) ergab.13
Aktuell fehlen jedoch noch weitere Daten, um die optimale Einsatzstrategie von CDK4/6-Inhibitoren bestimmen zu können. Im Rahmen der niederländischen Studie SONIA, einer multizentrischen, randomisierten Phase-III-Studie, wird derzeit beispielsweise untersucht, ob eine Zugabe von CDK4/6-Inhibitoren zur endokrinen Therapie in der ersten oder zweiten Therapielinie den größeren Vorteil für die Patientinnen darstellt. Dabei werden auch Biomarkeranalysen durchgeführt, um zu ermitteln, welche spezifischen Patientinnensubgruppen von CDK4/6-Inhibitoren profitieren bzw. nicht profitieren. Patientinnen werden derzeit noch rekrutiert.14
CDK4/6-Inhibitoren wecken aufgrund der positiven Ergebnisse auch Interesse in der Anwendung beim frühen Mammakarzinom. Zwar war die Studie PALLAS mit Palbociclib beim frühen HR-positiven, HER2-negativen Mammakarzinom (Stadium II–III) negativ und wurde vorzeitig abgebrochen. Jedoch konnte die monarchE-Studie, die in diesem Setting den adjuvanten Einsatz von Abemaciclib bei Patientinnen mit prognostisch ungünstigen Risikofaktoren untersuchte, einen signifikanten Unterschied im Überleben frei von invasiver Erkrankung zeigen. Um den klinischen Benefit von CDK4/6-Inhibitoren im adjuvanten Setting genauer zu evaluieren, sind weitere Studiendaten mit längeren Follow-up-Zeiten vonnöten. Derzeit untersuchen neben monarchE beispielsweise PENELOPE-B (Palbociclib) und NATALEE (Ribociclib) den jeweiligen CDK4/6-Inhibitor im adjuvanten Setting.1
Kommentar von Prof. Dr. Vesna Bjelic-Radisic
Wesentliche Veränderungen in den Empfehlungen für die systemische Therapie des Mammakarzinoms beziehen sich auf die Therapie der prä-/peri- und postmenopausalen Patientinnen mit HR-positivem und HER2-negativem Mammakarzinom im fortgeschrittenen Stadium. Die Zulassung von CDK4/6-Inhibitoren, die auf den Ergebnissen mehrerer Phase-III-Studien beruht, hat dazu geführt, dass diese zielgerichteten Therapien in der Kombination mit einer endokrinen Therapie (Aromataseinhibitoren, Fulvestrant) zum Standard für das metastasierte Mammakarzinom werden. Die Ergebnisse dieser Studien zeigten einen PFS-Vorteil sowohl in der ersten als auch in der zweiten Therapielinie. Kurz darauf wurden auch Daten, die einen Überlebensvorteil gegenüber alleiniger endokriner Therapie für die verschiedenen CDK4/6-Inhibitoren zeigten, publiziert.
CDK4/6-Inhibitoren (Abemaciclib, Palbociclib und Ribociclib) inhibieren die Cyclin-abhängigen Kinasen, die das Zellwachstum beeinflussen und in Brustkrebszellen überdurchschnittlich aktiv sind. Durch die Verabreichung einer Kombinationstherapie aus CDK4/6-Inhibitor und endokriner Therapie ist es möglich, das Fortschreiten der Erkrankung zu bremsen. Bei prä- und perimenopausalen Patientinnen wird die endokrine Therapie zusätzlich durch die ovarielle Suppression ergänzt. Eine alleinige endokrine Therapie bleibt den Patientinnen, denen eine Kombinationstherapie nicht zumutbar ist, weiterhin erhalten. Das Kapitel „5.4. Fernmetastasen“ wurde dementsprechend in Form eines Amendements überarbeitet.
Literatur:
1 Braal CL et al.: Inhibiting CDK4/6 in breast cancer with palbociclib, ribociclib, and abemaciclib: similarities and differences. Drugs 2021; 81(3): 317-31 2 Leitlinienprogramm Onkologie: Interdisziplinäre S3 Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. Langversion 4.4. Juni 2021. Online unter: https://www. leitlinienprogramm-onkologie.de/ fileadmin/user_upload/ Downloads/Leitlinien/ Mammakarzinom_4_0/Version_4.4/ LL_Mammakarzinom_Langversion_4.4.pdf 3 Cazzaniga ME et al.: Management of toxicities associated with targeted therapies for HR-positive metastatic breast cancer: a multidisciplinary approach is the key to success.Breast Cancer Res Treat 2019; 176(3): 483-94 4 Sledge GW Jr et al.: The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial. JAMA Oncol 2020; 6(1): 116-24 5 Neven P et al.: Abemaciclib plus fulvestrant in hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in premenopausal women: subgroup analysis from the MONARCH 2 trial. Breast Cancer Res 2021; 23(1): 87 6 Johnston S et al.: MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer 2019; 5: 5 7 Cristofanilli M et al.: Overall survival (OS) with palbociclib (PAL) + fulvestrant (FUL) in women with hormone receptor–positive (HR+), human epidermal growth factor receptor 2–negative (HER2–) advanced breast cancer (ABC): Updated analyses from PALOMA-3. ASCO 2021; Abstr. #1000 8 Im SA et al.: Overall survival with ribociclib plus endocrine therapy in breast cancer. N Engl J Med 2019; 381(4): 307-16 9 Tripathy D et al.: Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial. Lancet Oncol 2018; 19(7): 904-15 10 Slamon DJ et al.: Ribociclib plus fulvestrant for postmenopausal women with hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer in the phase III randomized MONALEESA-3 trial: updated overall survival. Ann Oncol 2021; 32(8): 1015-24 11 Yardley DA: MONALEESA clinical program: a review of ribociclib use in different clinical settings. Future Oncol 2019; 15(23): 2673-86 12 Hortobagyi G et al.: Overall survival (OS) results from the phase III MONALEESA-2 (ML-2) trial of postmenopausal patients (pts) with hormone receptor positive/human epidermal growth factor receptor 2 negative (HR+/HER2−) advanced breast cancer (ABC) treated with endocrine therapy (ET) ± ribociclib (RIB). ESMO 2021; LBA17 13 Kunwor R et al.: Meta-analysis of cyclin-dependent kinase (CDK) 4/6 inhibitors with endocrine therapy versus endocrine therapy alone on progression-free survival (PFS) and overall survival (OS) for metastatic breast cancer (MBC). J Clin Oncol 2020; 38(15_suppl): 1060 14 van Ommen-Nijhof A et al.: Selecting the optimal position of CDK4/6 inhibitors in hormone receptor-positive advanced breast cancer - the SONIA study: study protocol for a randomized controlled trial. BMC Cancer 2018; 18(1): 1146
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...