Multimodales Konzept im Schmerzmanagement beim Pankreaskarzinom
Autorin:
Dr. Marita Windpassinger, MBA
Universitätsklinik für Anästhesie, Allgemeine Intensivmedizin und Schmerztherapie der Medizinischen Universität Wien
Das Pankreaskarzinom ist weltweit die siebthäufigste, in Europa und den USA die vierthäufigste krebsbedingte Todesursache, mit einer 5-Jahres-Überlebensrate von unter 9%.1–5 Die Pathophysiologie des Schmerzes bei Pankreaskarzinom ist meist multifaktoriell und führt zu einer entsprechend komplexen Schmerzsymptomatik, welche in Qualität wie auch Intensität individuell stark variieren kann. Zwischen 70 und 80% der betroffenen Patienten leiden bei Erstdiagnose unter Schmerzen, mit über 90% im fortgeschrittenen Stadium der Erkrankung.6
Keypoints
-
WHO-Stufenschema zur Titration der Analgetika heranziehen
-
„Start low and go slow“ – langwirksame Opioide, niedrig dosiert beginnen & langsam steigern
-
Individuelle Schmerzmitteldosierung: Kombination Basis- mit Rescuemedikation
-
ABC – Antiemetic for the first week, Breakthrough medication, laxatives for Constipation
Trotz Entwicklung und Einsatz neuartiger Behandlungskonzepte stellt bereits bei Diagnosestellung ein multimodaler Therapieansatz, basierend auf dem WHO-Stufenschema, im Schmerzmanagement des Tumorschmerzes einen zunehmend wichtigen und integralen Bestandteil dar. Die Internationalen Leitlinien der Weltgesundheitsorganisation empfehlen eine stufenweise Adaptierung der Dosierungsregime bei Tumorschmerz, wobei Opioide nach wie vor eine zentrale Rolle einnehmen. Trotz medikamentösen Therapieansatzes zeigt sich bei weiterhin 55% der Patienten eine unzureichende Schmerzreduktion.7 Der Einsatz hoch dosierter Opioidgaben ist in den meisten Fällen, trotz deutlichen analgetischen Nutzens, mit zahlreichen Nebenwirkungen und einem Gewöhnungseffekt unter Langzeitbehandlung verbunden. Ziel sollte es hinsichtlich dieser Problematik sein, entsprechend multimodale Therapiekonzepte im Schmerzmanagement zu implementieren, um speziell im palliativen Setting eine adäquate Schmerzlinderung und die damit verbundene Verbesserung der Lebensqualität zu ermöglichen.
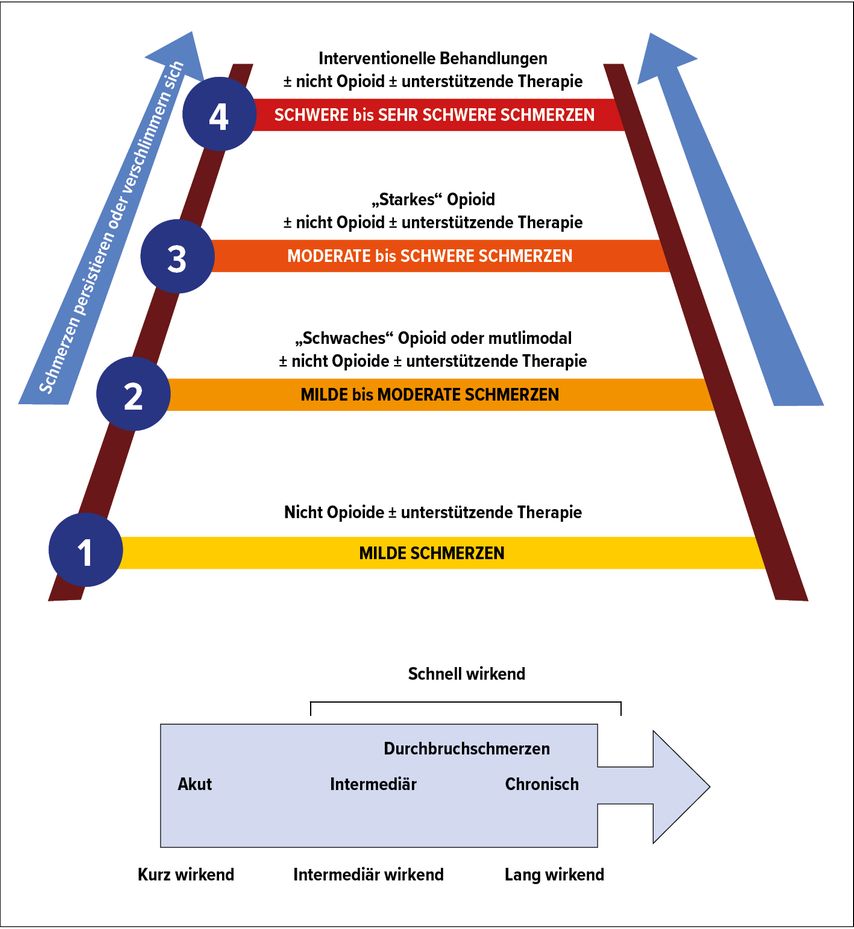
Die genaue Diagnose und Differenzierung des Schmerzes ist entscheidend für die optimale Wahl der Therapiestrategie. Nach dem Grund ihrer Entstehung unterscheidet man tumorbedingte (Tumor und Metastasen), tumorassoziierte, tumortherapiebedingte und tumorunabhängige Schmerzen. Aufbauend auf dem WHO-Stufenschema zur Tumorschmerztherapie (Abb. 1) sollte das Schmerzmanagement aus mehreren Ansatzpunkten bestehen, wobei die medikamentöse Behandlung mit Nicht-Opioid-Analgetika (NOPA), niedrigpotenten und hochpotenten Opioiden sowie Koanalgetika bzw. Adjuvanzien weiterhin im Zentrum steht.
Abb. 1: Aktualisierte Version der Schmerzleiter der WHO mit einer ergänzenden vierten Stufe, welche invasive Blockadetechniken vorsieht (modifiziert nach Pergolizzi JV, Raffa RB)8
Die klinischen Leitlinien und Empfehlungen seitens der WHO zur Tumorschmerztherapie (Initiierung und Behandlung) gliedern sich in drei Schwerpunktbereiche, die Analgesie des Tumorschmerzes, den Einsatz adjuvanter Koanalgetika und die Behandlung des Metastasenschmerzes. Das ursprünglich dreistufige WHO-Schema sieht eine Kombination von Nicht-Opioid-Analgetika (NOPA, Stufe I), Opioiden (Stufe II und III) und Koanalgetika vor, wobei eine ergänzende 4. Stufe interventionelle Verfahren empfiehlt. Im Folgenden werden auf WHO-Schema basierte Therapieansätze im Rahmen des Schmerzmanagements bei Pankreaskarzinompatienten aufgezeigt.
Stufe I: NOPA
Nicht-Opioid-Analgetika stellen einen etablierten Bestandteil der perioperativen Akutschmerztherapie und eines multimodalen Analgesiekonzepts bei chronischen Schmerzsymptomen, wie die der Tumorschmerztherapie, dar. Zu den NOPA zählen Paracetamol, Metamizol und die NSAID („non-steroidal anti-inflammatory drugs“).
Paracetamol
Das pharmakologische Profil von Acetaminophen (Paracetamol) ist dem von selektiven COX-2-Hemmern (Coxibe) sehr ähnlich. Paracetamol ruft in empfohlenen Einzeldosen keine toxische Wirkung auf den Magen-Darm-Trakt hervor,9 hemmt nicht die Thrombozytenfunktion10 und provoziert selten eine Bronchokonstriktion. In Studien konnte nachgewiesen werden, dass eine Einmaldosis Paracetamol die Blutmonozyten-Cyclooxygenase(COX)-2 um mehr als 80% hemmt, d.h. in einem vergleichbaren Ausmaß wie NSAID und selektive COX-2-Hemmer.11 Angesichts der COX-2-Hemmung wird empfohlen, das individuelle kardiovaskuläre Risiko unter Paracetamol-Dauertherapie zu berücksichtigen.12,13 Paracetamol weist eine geringe therapeutische Breite mit einer dosisabhängigen Hepatotoxizität auf. Eine maximale Tagesdosis von 4g (ohne Vorliegen von Komorbiditäten) sollte nicht überschritten werden.
Eine Dosisreduktion auf maximal 2g/Tag sollte nicht nur bei Leberzirrhosepatienten mit Risikofaktoren einer zusätzlichen Lebertoxizität (Alkoholkonsum, Mangelernährung) erfolgen, sondern auch bei einer Komedikation mit Carbamazepinen, Phenytoin, oralen Antikoagulanzien (INR-Erhöhung) oder einer Nierenfunktionseinschränkung (Kreatinin-Clearance <30ml/min).14,15
Metamizol
Das Pyrazolon-Derivat, dessen Wirkmechanismus noch nicht endgültig geklärt ist, wird vorwiegend bei akuten postoperativen Schmerzen, Koliken und Tumorschmerzen eingesetzt. Trotz unselektiver Hemmung der COX durch den aktiven Metaboliten 4-N-Methylaminoantipyrin (4-MAA) wird keine periphere antiphlogistische Wirkung beschrieben.11,12 Es wird angenommen, dass eine zentrale COX-Inhibition, eine Hemmung der Prostaglandin(PG)-Synthese im Hinterhorn des Rückenmarkes initiiert wird, wodurch die Sensitivität von Nozizeptoren gegenüber Schmerzmediatoren abnimmt.16
Weiterhin wurde entdeckt, dass die Metaboliten 4-MAA und 4-Aminoantipyrin (AA) mit Arachidonsäure durch die Fettsäureamidhydrolase (FAAH) mit höchster Aktivität in der Leber und ZNS zu Amiden reagieren können. Die Arachidonsäureamide wirken im ZNS agonistisch am Cannabinoid-Rezeptor des Typs1 (CB1), der Teil des absteigenden antinozizeptiven Systems ist.17
Metamizol gilt als gut verträglich, vor allem bei älteren, multimorbiden Patienten im Hinblick auf deren Komorbiditäten. Es ist, verglichen mit einer NSAID-Medikation, für den Gastroinstestinaltrakt besser verträglich und hat eine größere therapeutische Breite. Bei der i.v. Applikation ist zu beachten, dass es bei zu rascher Verabreichung zu dosisabhängigen kritischen Hypotensionen, vor allem bei hypovolämem Status oder beginnendem Kreislaufversagen, kommen kann. Kardiovaskuläre Nebenwirkungen, auch bei kardialen Risikopatienten, wurden in Zusammenhang mit Metamizol nicht beschrieben. Zu beachten ist allerdings, dass bei gleichzeitiger kardioprotektiver Acetylsalicylsäure(ASS)-Therapie die Metamizoleinnahme erst nach mindestens 30 Minuten erfolgen sollte, ansonsten würde die Thrombozytenaggregationshemmung durch die ASS aufgehoben werden.18 Anaphylaktische Reaktionen werden mit einer Häufigkeit von 1:5000 angegeben, wobei Patienten mit Analgetikaasthma, chronischer Urtikaria und Analgetikaintoleranz ein höheres Risiko zeigen.
Potenziell lebensbedrohliche Komplikationen wurden durch das Auftreten einer Agranulozytose beschrieben, welche ein sehr seltenes Ereignis mit einer Inzidenz von 0,96 Fällen pro Million Einwohner pro Jahr, mit einer Letalität von 10% darstellt.19–21 Die Symptome, welche auch nach Beendigung einer Metamizol-Therapie auftreten können, zeigen sich als Schüttelfrost, Fieberanstieg, Abgeschlagenheit, Halsschmerzen, Myalgien, Arthralgien, Stomatitis aphthosa, einer Pharyngitis oder Tonsillitis. Ein Großteil der Agranulozytose-Fälle tritt dabei in den ersten 2 Wochen nach Therapiebeginn auf, mit einer deutlich kürzeren Latenz bei einer bereits praktizierten Metamizol-Therapie. Die zusätzliche Einnahme von Methotrexat ist mit einer höheren Sterblichkeitsrate durch eine Agranulozytose verbunden und somit zu vermeiden. Nichtsteroidale Antiphlogistika (NSAID) können, ebenso wie Paracetamol, ihrerseits eine Agranulozytose hervorrufen, wenn auch seltener als Metamizol.
NSAID und Coxibe
Die NSAID, welche in den letzten Jahren aufgrund kardiovaskulärer Ereignisse vermehrt untersucht worden sind, werden in nicht selektive COX-Inhibitoren und selektive COX-2-Inhibitoren (Coxibe) unterteilt. Das kardiovaskuläre Risiko steigt bei Patienten nach einem Myokardinfarkt bereits nach sieben Tagen NSAID-Therapie an, bei Diclofenac bereits ab Therapiebeginn und bleibt noch für mindestens fünf Jahre post Myokardinfarkt erhöht.22,23 Bei Patienten mit kardiovaskulären Risikofaktoren sollte Ibuprofen nur niedrig dosiert (1200mg/Tag) eingesetzt werden. Die präferenziellen COX-1-Inhibitoren Ibuprofen oder Naproxen sind bei der schweren Herzinsuffizienz, Diclofenac, Parecoxib und Celecoxib (selektive COX-2-Inhibitioren) bei einer Herzinsuffizienz NYHA II–IV, KHK, PAVK oder zerebrovaskulären Erkrankungen kontraindiziert. Bei Dosisreduktion der NSAID wird zwar das Risiko kardiovaskulärer Komplikationen reduziert, gleichzeitig aber auch dessen analgetische Wirkung. Interaktionen zwischen ASS und NSAID wurden für Ibuprofen und Naproxen beschrieben.24 NSAID sind bei einer entzündlich-somatischen Schmerzkomponente eine kurzfristige Option (bis zu zwei Wochen), wenn die Basismedikation bereits durch Opioide erfolgt. In der Langzeittherapie können Kortikoide erwogen werden.
Stufe II und III: schwach und stark wirksame Opioide
Opioide wirken bei nozizeptiven, neuropathischen und viszeralen Schmerzen. Die Einstellung eines Opioid-naiven Tumorpatienten erfolgt nach der Grundregel „Start slow and go slow“, wobei die Opioidmedikation unter Berücksichtigung der ABC-Regel („Antiemetic for the first week – Breakthrough medication – laxatives for Constipation“) mit niedrig dosierten, retardierten Darreichungsformen von Opioiden der Stufe II bzw. III durchgeführt werden sollte. Die Dosis wird dabei unter engmaschiger Reevaluierung der Schmerzintensität bedarfsmäßig gesteigert und bei Schmerzspitzen mit unretardierten, kurz wirksamen Opioiden ergänzt, bis eine subjektiv ausreichende Schmerzlinderung eintritt. Die Basisdosis sollte nach 1–2 Tagen, entsprechend dem Verbrauch an Bedarfsmedikation, adaptiert werden.
Retardiertes Tramadol stellt eine Option für die ersten Wochen zur Eintitrierung vor dem Übergang zu einem Stufe-III-Präparat dar, wobei eine frühzeitige Umstellung auf ein niedrig dosiertes Stufe-III-Präparat zu erwägen ist. Dabei dürfen Stufe-II-Präparate nicht mit Stufe-III-Präparaten kombiniert werden. Bei Leber- oder Niereninsuffizienz muss die Dosis reduziert werden. Eine Kombination mit selektiven Serotonin-Reuptake-Inhibitoren (SSRI) kann zu einem serotonergen Syndrom führen.
Nach den drei Grundprinzipien des WHO-Schemas „By the clock, by the mouth and by the ladder“ sollte der orale Applikationsweg als Darreichungsform priorisiert werden. Sollte dieser nicht umsetzbar sein, stehen transdermale (Fentanyl, Buprenorphin), intravenöse („patient-controlled analgesia“ [PCA] Schmerzpumpen: Morphin, Hydromorphon; Basis-Bolus-Prinzip) oder subkutane Darreichungsformen zur Verfügung. Die medikamentöse Therapie erfolgt als Dauertherapie mit fixen Einnahmezeiten unter Einsatz von Retard-Wirkung, um eine 24-Stunden-Abdeckung der analgetischen Wirkung sicherzustellen. Die Dauermedikation wird durch eine kurz wirksame Bedarfsmedikation, welche bei Schmerzspitzen eingenommen wird, ergänzt, wobei Opiate der gleichen WHO-Stufe verwendet werden sollen. Die Schmerzmedikamente werden je nach individuellen Komorbiditäten adaptiert, wobei Koanalgetika, Opioidwechsel (Opioidrotation, „opioid switch“) und komplementärmedizinische Verfahren additiv eingesetzt werden sollten, um die Opioidtherapie zu optimieren.
Bei transdermalen Systemen muss beachtet werden, dass vor allem in fortgeschrittenen Erkrankungsstadien Resorptionsstörungen (Kachexie, Hyperhidrosis, Fieber) auftreten können. Transdermales Fentanyl ist eine Therapieoption bei mittelstarken bis starken Tumorschmerzen, Buprenorphin besonders bei Tumoren im gastrointestinalen Bereich und Hydromorphon wird aufgrund seiner guten Verträglichkeit präferiert eingesetzt. Bei Niereninsuffizienz sollten die Opioide Tilidin, Hydromorphon und Buprenorphin bevorzugt werden, bei Leberinsuffizienz Hydromorphon und Fentanyl. Bei der Therapie mit Opioiden der Stufe II und III nach WHO müssen Leber- und Nierenfunktionseinschränkungen beachtet werden.
Opioidanalgetika können bei Leberfunktionsstörungen und Zirrhosepatienten unter genauer Observatio mit steigender Dosierung (Cave: Risiko der Auslösung einer hepatischen Enzephalopathie) gegeben werden (Startdosis vierteln/halbieren und langsam steigern; Dosisintervall verdoppeln).15
Durch die Kombination von NOPA und Opioiden können sowohl der Opioidbedarf als auch das Nebenwirkungsprofil wie Übelkeit, Erbrechen oder Sedierung deutlich reduziert werden.25
Adjuvanzien und Koanalgetika
Ergänzend zum WHO-Stufenschema werden je nach Grunderkrankung Adjuvanzien bzw. Koanalgetika wie Steroide, Antidepressiva, Antiepileptika, NMDA-Antagonisten oder Cannabinoide eingesetzt. Bei einer neuropathischen Schmerzkomponente stellen Antidepressiva wie Amitriptylin oder Antikonvulsiva wie Carbamazepin, Gabapentin oder Pregabalin eine Option dar, wobei insbesondere Pregabalin nicht nur bei einschießenden Schmerzen, sondern auch bei Angst- und Schlafstörungen gute Wirkung zeigt. Auch Kortikoide können bei neuropathischen Schmerzen wirken. Sie werden neben Nervenschmerzen auch bei Leberkapselspannungsschmerz eingesetzt. Patienten mit opioidbedingter Obstipation sind meist langfristig auf eine adjuvante Behandlung mit Natrium-Picosulfat oder Macrogol angewiesen. Übelkeit und Erbrechen treten oft nur für wenige Tage zu Beginn der Einstellungsphase auf und werden mit Metoclopramid und Haloperidol behandelt. Die Therapie mit Cannabinoiden stellt eine wirksame Add-on-Schmerztherapie bei begleitender Übelkeit dar. Bisphosphonate, sollten dauerhaft, auch nach eingetretener Schmerzreduktion von skelettmetastatisch hervorgerufenen Tumorschmerzen eingesetzt werden. Kontraindikationen wie Niereninsuffizienz oder Risiko für Kieferosteonekrosen oder Hypokalzämie müssen dabei beachtet werden.
Stufe IV: interventionelle Therapie
Studien berichteten, dass ein zusätzliches perioperatives, epidurales Katheterverfahren hinsichtlich Schmerzreduktion, kardiovaskulärer Ereignisse, Extubationszeitpunkt, gastrointestinalen Blutungsrisikos und Intensivaufenthaltsdauer nach abdominellen Operationen verglichen mit einer singulären intravenösen Opioidtherapie zu favorisieren ist.26
Ein signifikanter Anteil der Pankreastumorpatienten klagt über viszerale und neuropathische Schmerzen aufgrund einer perineuralen Infiltration oder einer Beteiligung des Plexus coeliacus durch die Tumorausbreitung. Dieser Schmerz ist schwer kontrollierbar und kann gegenüber der konventionellen Schmerztherapie refraktär werden. In diesem Fall stellt die Plexus-coeliacus-Neurolyse („celiac plexus neurolysis“, CPN) eine erweiterte Therapieoption im Schmerzmanagement dieser Patienten dar, um die neuronale Signaltransduktion dauerhaft zu unterbrechen. CPN ist ein neurodestruktives, invasives Verfahren, bei dem Alkohol injiziert wird, um den Plexus coeliacus bei malignen abdominellen Erkrankungen längerfristig zu schädigen. Abzugrenzen von diesem Verfahren ist die Plexus-coeliacus-Blockade (CPB), die bei nicht neoplastischen abdominellen Schmerzsymptomatiken eingesetzt wird und bei der die Plexus-Funktion durch z.B. Steroidinjektion vorübergehend blockiert wird. Unterschiedliche Applikationstechniken, wie die der intraoperativen CPN, der perkutanen CT-gezielten CPN, die hinsichtlich Schmerzreduktion und Schmerzmittelbedarf miteinander vergleichbar sind, die ultraschallgezielte perkutane CPN (US-CPN), endoskopisch Ultraschall(EUS)-gezielte Radiofrequenz-Ablation (EUS-RFA) oder die EUS-geführte CPN werden diesbezüglich angeführt.27,28 Vor allem bei Tumorbeteiligung des Pankreaskopfes stellt die CPN als analgetisches Adjuvans eine günstige Therapieoption dar.29 CPN wird für Patienten empfohlen, welche unter unkontrollierten Schmerzen (Schmerzeskalation) leiden, inakzeptable Opioid-Nebenwirkungen oder einen stark steigenden Analgetikabedarf aufweisen. Die CPN sollte bei entsprechender Schmerzsymptomatik frühzeitig in Betracht gezogen werden, um die kurz- und langfristige Schmerzkontrolle und Lebensqualität zu verbessern. Es gibt auch wissenschaftliche Hinweise darauf, dass die Lebenserwartung durch diese Intervention verlängert werden kann.30
Es muss jedoch betont werden, dass sich das Schmerzbild bei der Diagnose Pankreaskarzinom im zeitlichen Verlauf meist multifaktoriell präsentiert und eine alleinige Therapie mittels CPN in den meisten Fällen keine ausreichende Schmerzlinderung bringt.
Im Krankheitsverlauf wird neben einem frühzeitigen Einsatz dieser Neurolysetechnik ein multifaktorieller Ansatz im Schmerzmanagement laut WHO-Schema („WHO pain ladder“) (Abb. 1) empfohlen.33
Literatur:
1 Bray F et al.: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68(6): 394-424 2 Carrato A et al.: A systematic review of the burden of pancreatic cancer in europe: real-world impact on survival, quality of life and costs. J Gastrointest Cancer 2015; 46(3): 201-11 3 Golan T et al.: Short- and long-term survival in metastatic pancreatic adenocarcinoma, 1993-2013. J Natl Compr Canc Netw 2017; 15(8): 1022-7 4 Ilic M, Ilic I: Epidemiology of pancreatic cancer. World J Gastroenterol 2016; 22(44): 9694-705 5 Rawla P et al.: Epidemiology of pancreatic cancer: global trends, etiology and risk factors. World J Oncol 2019; 10(1): 10-27 6 Mercadante S et al.: Breakthrough pain in patients with abdominal cancer pain. Clin J Pain 2014; 30(6): 510-4 7 Azevedo Sao Leao Ferreira K et al.: The WHO analgesic ladder for cancer pain control, twenty years of use. How much pain relief does one get from using it? Support Care Cancer 2006; 14(11): 1086-93 8 Pergolizzi JV, Raffa RB: The WHO pain ladder: do we need another step? Practical Pain Management 2014; 14(1) 9 Garcia Rodriguez LA, Hernandez-Diaz S: Relative risk of upper gastrointestinal complications among users of acetaminophen and nonsteroidal anti-inflammatory drugs. Epidemiology 2001; 12(5): 570-6 10 Catella-Lawson F et al.: Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345(25): 1809-17 11 Hinz B et al.: Acetaminophen (paracetamol) is a selective cyclooxygenase-2 inhibitor in man. FASEB J 2008; 22(2): 383-90 12 Hinz B, Brune K: Paracetamol and cyclooxygenase inhibition: is there a cause for concern? Ann Rheum Dis 2012; 71(1): 20-5 13 Chan AT et al.: Nonsteroidal antiinflammatory drugs, acetaminophen, and the risk of cardiovascular events. Circulation 2006; 113(12): 1578-87 14 Soleimanpour H et al.: Opioid drugs in patients with liver disease: a systematic review. Hepat Mon 2016; 16(4): e32636 15 Chandok N, Watt KD: Pain management in the cirrhotic patient: the clinical challenge. Mayo Clin Proc 2010; 85(5): 451-8 16 Rezende RM et al.: Different mechanisms underlie the analgesic actions of paracetamol and dipyrone in a rat model of inflammatory pain. Br J Pharmacol 2008; 153(4): 760-8 17 Rogosch T et al.: Novel bioactive metabolites of dipyrone (metamizol). Bioorg Med Chem 2012; 20(1): 101-7 18 Dannenberg L et al.: Dose reduction, oral application, and order of intake to preserve aspirin antiplatelet effects in dipyrone co-medicated chronic artery disease patients. Eur J Clin Pharmacol 2019; 75(1): 13-20 19 Huber M et al.: Metamizole-induced agranulocytosis revisited: results from the prospective Berlin Case-Control Surveillance Study. Eur J Clin Pharmacol 2015; 71(2): 219-27 20 Klose S et al.: Metamizole and the risk of drug-induced agranulocytosis and neutropenia in statutory health insurance data. Naunyn Schmiedebergs Arch Pharmacol 2020; 393(4): 681-90 21 Andrade S et al.: Safety of metamizole: a systematic review of the literature. J Clin Pharm Ther 2016; 41(5): 459-77 22 Schjerning O et al.: The impact of selective and non-selective non-steroid anti-inflammatory drugs on secondary hemostasis in healthy volunteers. Thromb Res 2009; 124(2): 208-12 23 Schjerning Olsen AM et al.: Duration of treatment with nonsteroidal anti-inflammatory drugs and impact on risk of death and recurrent myocardial infarction in patients with prior myocardial infarction: a nationwide cohort study. Circulation 2011; 123(20): 2226-35 24 Alqahtani Z, Jamali F: Clinical outcomes of aspirin interaction with other non-steroidal anti-inflammatory drugs: a systematic review. J Pharm Pharm Sci 2018; 21(1s): 29854 25 Martinez V et al.: Non-opioid analgesics in adults after major surgery: systematic review with network meta-analysis of randomized trials. Br J Anaesth 2017; 118(1): 22-31 26 Guay J, Kopp S: Epidural pain relief versus systemic opioid-based pain relief for abdominal aortic surgery. Cochrane Database Syst Rev 2016; 2016(1): CD005059 27 Bang JY et al.: EUS-guided celiac ganglion radiofrequency ablation versus celiac plexus neurolysis for palliation of pain in pancreatic cancer: a randomized controlled trial (with videos). Gastrointest Endosc 2019; 89(1): 58-66.e3 28 Abdelbaser I et al.: Direct intraoperative versus percutaneous computed tomographyguided celiac plexus neurolysis in non-resectable pancreatic cancer: a randomized, controlled, non-inferiority study. Rev Esp Anestesiol Reanim (Engl Ed) 2021; S0034-9356(21)00141-9 29 Rykowski JJ, Hilgier M: Efficacy of neurolytic celiac plexus block in varying locations of pancreatic cancer: influence on pain relief. Anesthesiology 2000; 92(2): 347-54 30 Staats PS et al.: The effects of alcohol celiac plexus block, pain, and mood on longevity in patients with unresectable pancreatic cancer: adouble-blind, randomized, placebo-controlled study. Pain Med 2001; 2(1): 28-34 31 Mekky MA, Abbas WA: Endoscopic ultrasound in gastroenterology: from diagnosis to therapeutic implications. World J Gastroenterol 2014; 20(24): 7801-7 32 Urits I et al.: Comprehensive review of the celiac plexus block for the management of chronic abdominal pain. Curr Pain Headache Rep 2020; 24(8): 42 33 Wyse JM et al.: Celiac plexus neurolysis in the management of unresectable pancreatic cancer: when and how? World J Gastroenterol 2014; 20(9): 2186-92
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...