Myeloproliferative Neoplasien: gute Ergebnisse an vielen Fronten
Autor:
Univ.-Prof. Dr. Klaus Geissler
Facharzt für Hämatologie und internistische Onkologie
Professor für Hämatoonkologie
Sigmund Freud PrivatUniversität, Wien
E-Mail: geissler.klaus@gmx.at
Auf dem 28. Jahreskongress der European Hematology Association (EHA) wurde eine Reihe neuer Therapiekonzepte bei BCR-ABL-negativen myeloproliferativen Neoplasien präsentiert, die unsere zukünftigen therapeutischen Möglichkeiten deutlich erweitern könnten.
Keypoints
-
Die MDM2-Inhibition ist ein vielversprechendes neues Therapieprinzip für Patient:innen mit MF, welches nicht nur zu einem klinischen Benefit führt, sondern auch eine krankheitsmodifizierende Wirkung hat.
-
BET-Inhibitoren sind aufgrund ihres antiinflammatorischen Potenzials als Monotherapie oder in Kombination mit JAK2-Inhibitoren vielversprechende Substanzen für die Behandlung unterschiedlicher MPN-Formen.
-
Pegyliertes IFN zeigt nun erstmals klinisch relevante Effekte in den frühen Stadien der MF.
-
Orales Decitabin/Cedazuridin (auch in Kombination mit Venetoclax) scheint für Patient:innen mit MDS/MPN eine vollständig orale Therapie zu ermöglichen.
MDM2-Inhibitoren
MDM2 ist einer der wichtigsten negativen Regulatoren von p53. p53 wird konstitutiv exprimiert, bei intakter DNA aber sofort wieder abgebaut. Auf diese Weise wird die Konzentration von p53 äußerst gering gehalten. Der Abbau wird durch die E3-Ubiquitinligase-Funktion von MDM2 initiiert.
Navtemadlin (NVTM) ist ein selektiver oraler MDM2-Inhibitor, der in TP53-Wildtyp-Myeloblasten durch eine Überwindung einer dysregulierten MDM2-Funktion eine Apoptose induziert. Eine Monotherapie mit NVTM zeigte eine klinisch relevante krankheitsmodifizierende Aktivität bei Patient:innen mit rezidivierender/refraktärer Myelofibrose (MF).
Die Kombination von NVTM und Ruxolitinib (RUX) entfaltet durch komplementäre Mechanismen, die im Bereich der Bcl-2-Proteinfamilie konvergieren, einen hemmenden Effekt auf das „pro-survival signaling“ maligner Zellen. In einer Phase-IB/II-Studie wurden Sicherheit, Wirksamkeit und Toxizität von NVTM untersucht. NVTM wurde als Zusatz zu einer RUX-Therapie bei MF-Patient:innen gegeben, die ein suboptimales Ansprechen auf RUX gezeigt haben.1
Um die empfohlene Dosis für die Phase II zu ermitteln, wurden in einem Phase-Ib-3+3-Design drei Dosen von NVTM evaluiert, welche nach einer mindestens 18-wöchigen vorangegangenen RUX-Therapie im Sinne einer Add-on-Gabe verabreicht wurden.
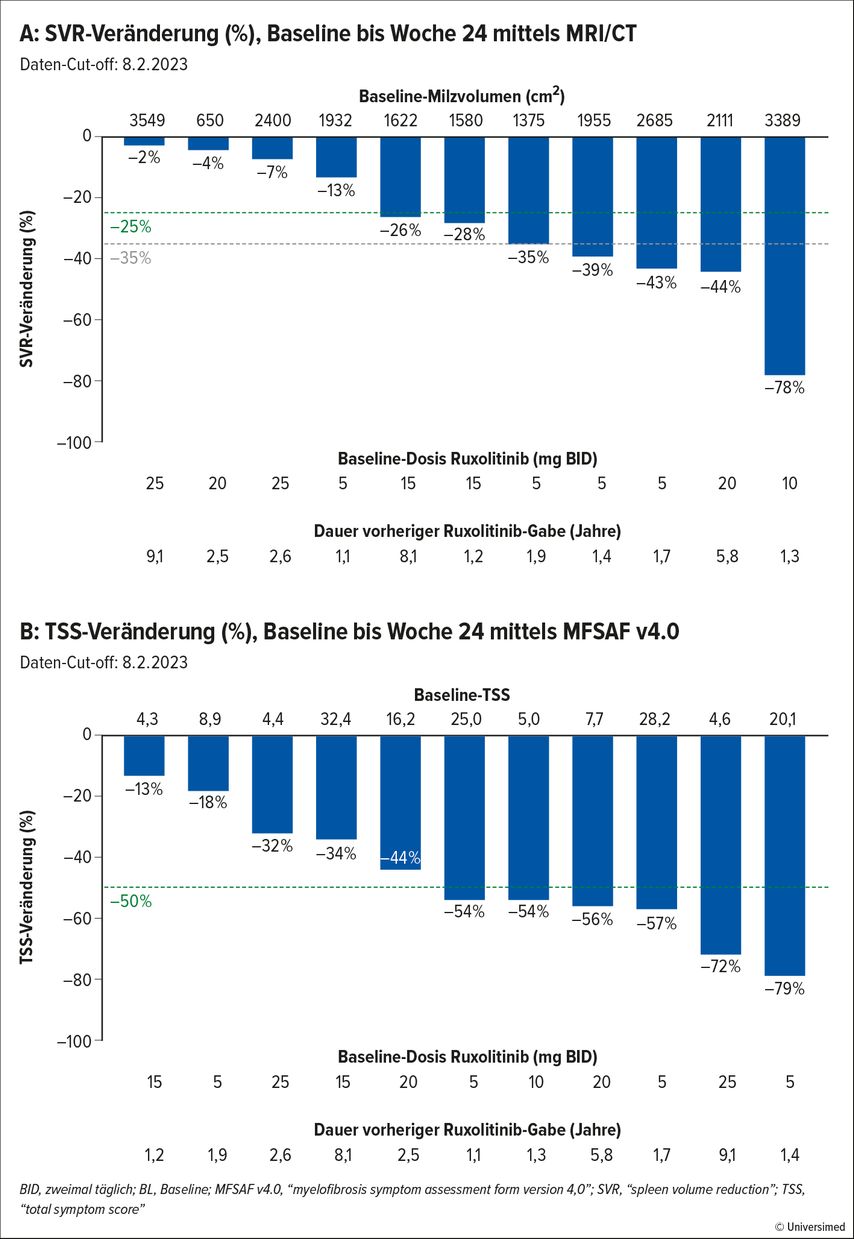
Die primären Endpunkte dieser Studie waren die Ermittlung der RP2D (empfohlene Phase-II-Dosis) und das Milzvolumen-Ansprechen (SVR) in Woche 24. Die sekundären Endpunkte inkludierten die Verbesserung des „total symptom score“ um >50% (TSS-50). 32 Patient:innen wurden in die Studie eingeschlossen.
Die RP2D wurde mit 240mg ermittelt, die präliminären Ergebnisse von 24 Patient:innen wurden präsentiert. In der ITT-Analyse (n=16) zeigten sieben Patient:innen ein SVR-25 (44%) und fünf Patient:innen ein SVR-35 (31%), während sechs Patient:innen einen TSS-50 (38%) erreichten (Abb. 1). Wenn in der ITT-Analyse ausschließlich Patient:innen aus Woche 24 (n=11) betrachtet wurden, zeigten 64% ein SVR-25, 45% ein SVR-35 und 55% einen TSS-50.
Der mediane Abfall zirkulierender CD34+-Zellen betrug in Woche 12 81% und in Woche 24 86%. Unerwünschte Effekte, unabhängig von der Kausalität, wurden bei 88% der Patient:innen registriert, 33% waren Toxizitäten von Grad 3/4. Die unerwünschten Effekte betrafen in erster Linie den Gastrointestinaltrakt und Zytopenien.
In einer Begleitstudie wurde die Korrelation von krankheitsassoziierten Biomarkern und Outcome-Parametern evaluiert.2 Als Biomarker wurden die Allelfrequenz (VAF) der jeweiligen Treibermutation sowie die Anzahl zirkulierender CD34+-Zellen herangezogen.
Bei Patient:innen, bei denen gepaarte Proben vorlagen und bei denen die VAF der jeweiligen Treibermutation um mindestens 20% zurückging, war das mediane Überleben signifikant länger als bei jenen Patient:innen, bei denen kein Abfall der VAF feststellbar war (25,6 Monate vs. 13,0 Monate; p=0,041). Bei Patient:innen mit einem erhöhten Wert zirkulierender CD34+-Zellen, bei denen es zu einem Abfall der CD34+-Zellen in oder unter den Normalbereich kam, wurde das mediane Überleben noch nicht erreicht, verglichen mit 10,7 Monaten bei Patient:innen, bei denen das nicht der Fall war (p=0,018).
Betreffend das Gesamtüberleben (OS) zeigte sich ein Trend zu einer Verlängerung sowohl bei Patient:innen mit einem VAF-Abfall um mindestens 20% (mNR [median nicht erreicht] vs. 34,4 Monate; p=0,12) als auch bei Patient:innen mit einer Normalisierung der Anzahl der CD34+-Zellen (mNR vs. 35,2; p=0,086).
Patient:innen mit einer Blastenphase (BP) einer myeloproliferativen Neoplasie (MPN) haben nach wie vor eine extrem schlechte Prognose. Aus diesem Blickwinkel betrachtet ist eine Studie von Wang X et al. von besonderem Interesse.3
In dieser Studie wurde das vielversprechende therapeutische Potenzial von NVTM in einem präklinischen Mausmodell gezeigt, bei dem eine MPN-BP in PDX(„patient-derived xenograft“)-Mäusen generiert wurde. Dabei wurden humane TP53-Wildtyp-Zellen mit Aberrationen in KRAS, RAD21, KMT2A, ASXL1 und del[20q] in subletal bestrahlte NSG[„NOD scid gamma“]-Mäuse transplantiert. Am Tag 35 wurden Mäuse mit einer ähnlichen MPN-BP-Last mit NVTM (Tag 1–7) oder mit Decitabin durch intraperitoneale Injektion, 3x wöchentlich verabreicht, behandelt.
In diesem Tiermodell konnte gezeigt werden, dass NVTM hCD45dimCD33+ und CD34+ leukämische Blasten in Blut und Gewebe eliminieren konnte und zu einem leukämiefreien Langzeitüberleben führte. Diese Ergebnisse zeigen einen eindeutigen krankheitsmodifizierenden Effekt von NVTM, der auch bei Patient:innen mit einer TP53-Wildtyp-BP therapeutisch interessant sein könnte.
BET-Inhibitoren
Pelabresib (PELA) ist ein oraler BET-Inhibitor, der schon relativ weit in seiner klinischen Entwicklung steht. Rationale für den Einsatz von PELA ist die Tatsache, dass eine progressive Knochenmarksfibrose Ergebnis einer aberranten Megakaryopoese und Expression proinflammatorischer Zytokine ist, zweier Prozesse, die durch die „bromodomain“- und „extraterminal domain“(BET)-proteinmediierte Expression bestimmter Gene (NF-kB, MYC, BCL-2) zu Myeloproliferation und Zytopenie führen.
Ergebnisse der Phase-II-Studie MANIFEST zeigten ermutigende klinische Wirksamkeit bei Patient:innen mit MF. In der Präsentation von Passamonti F et al. wurden die Ergebnisse des Armes 4 der MANIFEST-Studie zu einer PELA-Monotherapie bei Patient:innen mit essenzieller Thrombozythämie (ET) mit Hochrisiko vorgestellt, die sich als refraktär oder intolerant gegenüber Hydroxyurea (HU) zeigten.4
Eingeschlossene Patient:innen hatten Thrombozytenwerte >600G/l und >2 Symptome (durchschnittlicher Score >3 im TSS, >15 im „myeloproliferative neoplasm symptom assessment form“ [MPN-SAF]). 20 Patient:innen mit Hochrisiko-ET erhielten eine PELA-Monotherapie. 18/20 (90%) Patient:innen zeigten ein hämatologisches Ansprechen, eine bestätigte komplette Remission wurde bei 8/20 (40%) beobachtet. Eine Verminderung des TSS wurde bei 12/14 (86%) festgestellt.
Übelkeit (60%, 10% Grad 3), Durchfall (35%, 5% Grad 3) und Geschmacksstörung (35%, kein Grad 3) waren die häufigsten Nebenwirkungen. Hämorrhagische oder thromboembolische Ereignisse wurden bei 30% der Patient:innen berichtet. Von sechs Patient:innen mit einer JAK2-Mutation zeigten die beiden Patient:innen mit der höchsten Mutationslast einen Abfall der VAF. Ein Cluster 7 proinflammatorischer Zytokine war nach 2-wöchiger PELA-Therapie bei allen Patient:innen herunterreguliert, ein Abfall der IL-8-Genexpression um 65% und eine Verringerung der Milzgröße wurden bereits vier Stunden nach der ersten PELA-Einnahme verzeichnet.
Die präliminären Ergebnisse in Arm 4 der MANIFEST-Studie zeigen somit einen potenziellen klinischen Vorteil einer PELA-Monotherapie bei Patient:innen mit einer Hochrisiko-ET, die gegen HU refraktär oder intolerant waren, was sich in Form eines hämatologischen Ansprechens und/oder einer Symptomverbesserung darstellte. Die molekularen Daten und pharmakodynamischen Analysen weisen auch auf eine Beeinflussung krankheitsassoziierter Biomarker hin.
BMS-986158 ist ein weiterer oraler BET-Inhibitor, der bei Patient:innen mit MF alleine oder in Kombination mit den JAK-Inhibitoren RUX oder Fedratinib (FEDRA) in der CA011-023-Studie untersucht wurde. In Part 1A, in dem Patient:innen BMS-986158 und RUX erhielten, erreichten 5/6 (83%) der Patient:innen ein SVR35 in Woche 12 und 6/6 (100%) in Woche 24. In Part B, in dem Patient:innen BMS-986158 und FEDRA erhielten, erreichten 0/6 Patient:innen (0%) ein SVR35 in Woche 12 und 1/3 (33%) ein SVR35 in Woche 24.
JAK2-VAF-Analysen zeigten eine Verminderung der Allellast in beiden Studienarmen. Behandlungsassoziierte Nebenwirkungen, die bei 82% der Patient:innen in Part 1A und bei 75% in Part 1B beobachtet wurden, waren in erster Linie hämatologischer Natur. Die vorläufigen Ergebnisse zeigen ein robustes Ansprechen der Splenomegalie mit der Kombination von BMS-986158 und RUX.
Pegyliertes Interferon
Während pegyliertes Interferon in der Therapie der Polycythaemia vera (PV) und der ET als gut etabliert gilt, ist die Rolle dieses Medikaments bei Patient:innen mit MF noch unklar. Beim diesjährigen EHA-Meeting wurde nun eine Phase-II-Studie zu monopegyliertem Interferon alpha-2b (Peg-IFN) bei Patient:innen mit pre-PMF (präfibrotische primäre Myelofibrose) und PMF mit niedrigem/intermediärem Risiko nach DIPSS vorgestellt.5
Daten zu 56 Patient:innen, die 24 Wochen in der Studie absolviert hatten, und zu 35 Patient:innen, die 48 Wochen absolviert hatten, wurden ausgewertet. Nach 24 Wochen war das Ansprechen im Bereich des Hämoglobins (Hb >10g/dL) 76,6%, bei den Leukozyten (WBC <10x10G/L) 87,2% und im Bereich der Thrombozyten (Thrombo <400G/L) 78,8%. 92% (36/39) der evaluierbaren Patient:innen mit JAK2-Mutation hatten eine stabile oder verbesserte JAK2-Allellast mittels droplet-PCR.
Drei Patient:innen (8%) hatten eine Reduktion der JAK2V617F-VAF von mehr als 50%, inklusive eines Patienten, der eine komplette molekulare Remission erreichte. Bei drei Patient:innen wurde die Therapie beendet, keine:r der Patient:innen entwickelte eine offene PMF, eine Transformation in eine BP wurde nicht beobachtet.
Die häufigsten unerwünschten Effekte waren Unwohlsein (n=29, 47%; Grad 3–4: n=1), Anämie (n=26, 42%; Grad 3–4: n=4), und Haarverlust (n=23, 37%; Grad 3–4: n=0). Acht asymptomatische Patient:innen (13%) zeigten eine Störung der Schilddrüsenfunktion; neuropsychiatrische Störungen oder andere Autoimmunerkrankungen wurden nicht beobachtet.
Zusammenfassend ist zu sagen, dass Peg-IFN bei Patient:innen mit pre-PMF und PMF mit niedrigem/intermediärem Risiko nach DIPSS gut vertragen wurde, zytoreduktiv wirksam und mit molekularem Ansprechen assoziiert war.
Orales Decitabin/Cedazuridin
Patient:innen mit chronischer myelomonozytärer Leukämie (CMML) und myelodysplastischem Syndrom (MDS) mit Hochrisiko werden standardmäßig mit hypomethylierenden Medikamenten behandelt, die derzeit parenteral verabreicht werden müssen. Die Kombination dieser Medikamente mit Venetoclax (VEN) hat zu einem verbesserten Ansprechen und zu einer Verlängerung des OS bei Patient:innen mit akuter myeloischer Leukämie (AML) geführt und gilt derzeit als Standardtherapie für diese Patient:innengruppe.
Kürzlich wurde eine neue orale Formulierung einer hypomethylierenden Substanz (orales Decitabin/Cedazuridin, ASTX727) von der FDA zur Behandlung von MDS zugelassen. In einer Phase-I/II-Studie wurden behandlungsnaive Patient:innen mit CMML oder MDS mit Hochrisiko mit einer Kombination aus ASTX727 und VEN behandelt.6
37 Patient:innen wurden eingeschlossen (MDS mit Blastenüberschuss 1, n=6, 16%; MDS mit Blastenüberschuss 2, n=24, 65%; CMML-2, n=6, 16%; atypische CML, n=1, 3%). Das zytogenetische Risiko nach IPSS war gering (30%), intermediär (32%) und hoch (38%). Die mediane Zahl von Mutationen war 3 (1–14). Die häufigsten Mutationen waren in folgenden Genen nachweisbar: ASXL1 (49%), RUNX1 (38%), SRSF2 (30%), TET2 (22%) und TP53 (19%).
Da keine dosislimitierende Toxizität zu beobachten war, wurde für die Phase II für ASTX727 eine Dosis von 100/35mg an den Tagen 1–5 plus VEN 400mg an den Tagen 1–14 festgelegt. Die durchschnittliche Ansprechrate betrug 94,5%, eine komplettes Ansprechen (CR) war bei 35,1%, ein Knochenmarksansprechen (marrowCR) mit hämatologischer Verbesserung (mCR-HI) bei 29,7% und ein medianes komplettes Ansprechen (mCR) ohne HI („hematologic improvement“) bei 29,7% nachweisbar (Abb. 2).
Abb. 2: Ergebnisse einer Therapie behandlungsnaiver Patient:innen mit Hochrisiko mit einer Kombination aus ASTX727 und VEN. Modifiziert nach Bataller A et al.6
Insgesamt scheint also die Kombination von ASTX727 eine vielversprechende und vollständig orale Therapiekombination zu sein, die gut verträglich ist und eine hohe Wirksamkeit aufweist.
Literatur:
1 Mascarenhas J et al.: An open-label, global, phase (ph) 1b/2 study adding navtemadlin (nvtm) to ruxolitinib (rux) in patients (pts) with primary or secondary myelofibrosis (mf) who have a suboptimal response to rux. EHA 2023; Abstr. #S210 2 Vachhani P et al.: Disease-modifying activity of navtemadlin (NVTM) correlated with survival outcomes in janus kinase inhibitor (JAKI) relapsed or refractory (r/r) myelofibrosis (MF) patients (pts). EHA 2023; Abstr. #214 3 Wang X et al.: Navtemadlin, an oral MDM2 inhibitor, eliminates myeloproliferative neoplasm-blast phase (MPN-BP) initiating cells and prolongs leukemia-free survival (LFS) in an MPN-BP PDX model. EHA 2023; Abstr. #S207 4 Passamonti F et al.: Pelabresib (CPI-0610) monotherapy in patients with high-risk essential thrombocythemia refractory or intolerant to hydroxyurea: preliminary results from manifest study. EHA 2023; Abstr. #S168 5 Gill H et al.: Efficacy and safety of ropeginterferon alfa-2b for pre-fibrotic primary myelofibrosis and dipss low/intermediate-1 risk myelofibrosis: updated results and genomic characteristics. EHA 2023; Abstr. #S211 6 Bataller A et al.: Phase 1/2 study of oral decitabine/cedazuridine in combination with venetoclax in treatment-naïve higher-risk myelodysplastic syndromes or chronic myelomonocytic leukemia. EHA 2023; Abstr. #S172
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...