Pankreaszysten und andere Krebsvorstufen: kontrollieren oder operieren?
Autor:
Assoc. Prof. Priv.-Doz. Dr. Klaus Sahora
Universitätsklinik für Allgemeinchirurgie
Abteilung für Viszeralchirurgie
Comprehensive Cancer Center Vienna
Medizinische Universität Wien
E-Mail: klaus.sahora@meduniwien.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nach gegenwärtigen Prognosen wird das Pankreaskarzinom bis 2030 die zweithäufigste Krebstodesursache in der westlichen Welt sein.1 Trotz intensiver Forschung und Fortschritt in der Radiologie besteht bei der Mehrheit der Patienten bei Diagnose bereits ein lokal fortgeschrittenes oder metastasiertes Stadium.
Biomarker und neue Verfahren in der Bildgebung zur Identifizierung von nicht invasiven Vorstufen des Pankreaskarzinoms werden dringend benötigt. Zu den wichtigsten Vorläuferläsionen des Pankreaskarzinoms zählen die intraepitheliale Pankreasneoplasie (PanIN; duktales Adenokarzinom) und diverse zystische Neoplasien (Zystadenokarzinome). Während benigne zystische Läsionen mittels Computertomografie (CT) und Magnetresonanztomografie (MRT) meist zufällig und immer häufiger entdeckt werden, ist es heutzutage nicht möglich, PanIN schnittbildgebend darzustellen und zu lokalisieren. Die frühzeitige Erkennung von PanIN wird jedoch in Zukunft eine Möglichkeit darstellen, Patienten zu heilen, bevor sie an invasivem Bauchspeicheldrüsenkrebs erkranken. Die geschätzte 10-Jahres-Gesamtüberlebensrate bei frühzeitiger Diagnose und Resektion für Stadium 0, Stadium I TS1a und Stadium I TS1b sind geschätzt 95%, 94% bzw. 79%.2
PanIN und duktales Adenokarzinom
Die PanIN ist eine mikroskopische (meist <5mm), flache bis papilläre Neoplasie, die ihren Ursprung in den kleinen intralobulären Pankreasgängen nimmt. Diese Läsionen sind charakteristisch asymptomatisch und schnittbildgebend nicht auflösbar. Die Pathogenese folgt einer klassischen Adenom-Karzinom-Sequenz mit Low-, Medium- und High-Grade-Dysplasie. Im Rahmen der Tumorprogression steht ein mehrstufiger Prozess mit Akkumulation multipler genetischer Veränderungen (KRAS, CDKN2A, SMAD4, Telomerverkürzung, TP53, Hypermethylierung).3 Bei Patienten mit hohem familiärem Risiko für die Entwicklung eines Pankreaskarzinoms ist jedoch nach wie vor die engmaschige Kontrolle mit MRT und EUS in kurzen Intervallen (3–6 Monate) die Methode der Wahl. Alterationen des Pankreashauptgangs und/oder fokale Atrophie des Pankreasparenchyms sollten hierbei immer als suspekt gewertet werden. Darüber hinaus bietet lediglich die serielle zytologische Untersuchung von Pankreassaftaspiration als invasive diagnostische Methode mittels endoskopischer retrograder Cholangiopankreatikografie (ERCP) eine Option für die frühzeitige Diagnose höhergradiger Dysplasien. Liegen diese vor, ist infolge des Mangels an Möglichkeiten zur genaueren Lokalisation und Diagnostikeine totale Duodenopankreatektomie die einzige konsequente Therapie für High-Risk-Patienten.
Auf die Entwicklung hoch sensitiver und spezifischer Biomarker sowie neuer Verfahren in der molekularen Bildgebung ist in Zukunft zu hoffen.
Zystisch-neoplastische Vorstufen
Echte neoplastische Zysten der Bauchspeicheldrüse machen ca. 10–15% aller zystischen Läsionen des Pankreas aus.4 Wichtigste prämaligne Vorstufen sind die intraduktale papillär-muzinöse Neoplasie (IPMN) des Pankreas, welche Seitenäste und/oder den Hauptast des Pankreasgangs betreffen kann, und die muzinös-zystische Neoplasie (MCN).5 Die Prävalenz der Subtypen muss im Wandel der Zeit interpretiert werden, da es in früheren chirurgischen Serien oftmals zur fälschlichen Zuordnung von MCN als IPMN gekommen ist. Eine aktuelle Übersichtsarbeit vom Massachusetts General Hospital anhand von 1290 Patienten der letzten 30 Jahre zeigt diesen Trend. War das Verhältnis MCN zu IPMN 1990–2000 24% vs. 31%, so lag es 2000–2010 bei 18% vs. 49% und 2010–2020 bei 10% vs. 58%. Die Prävalenz zystischer Läsionen liegt in CT-Untersuchungen bei ca. 4% und bei 17% in der MRT. Infolge des höheren Alters liegt in Autopsiestudien die Rate an Zysten der Bauchspeicheldrüse bei bis zu 50%. Eine kürzlich veröffentlichte populationsbasierte Studie aus Deutschland zeigte, dass bei 1077 gesunden Probanden in einer primären MRT bei 49,1% mindestens eine zystische Läsion des Pankreas gefunden wurde (durchschnittlich 4 multilokuläre Zysten, Durchmesser 2–29mm). Bei 676 Personen wurde nach 5 Jahren eine weitere Vorsorge-MRT durchgeführt und in 13% wurden neu aufgetretene Zysten nachgewiesen. Bei 57% wurde im 5-Jahres-Follow-up eine Größenzunahme beschrieben, jedoch entwickelte keine der untersuchten Personen ein Pankreaskarzinom.6 Eine an der Medizinischen Universität Wien retrospektiv durchgeführte Analyse ergab, dass bei 5,5% aller Patienten (n=376/6817; 2003–2009), welche an der Klinik eine CT- oder MRT-Untersuchung hatten, bildmorphologisch der Verdacht auf eine IPMN bestand. Obwohl die Mehrzahl dieser Patienten kein zystenspezifisches Follow-up hatten, lag die Rate an Patienten mit Pankreaskarzinom in dieser Kohorte nach 5 Jahren bei nur 1,3%.7 Ein Großteil der Patienten (75%) starb während des Follow-ups an den bestehenden Komorbiditäten oder altersbedingt.
Es zeigt sich hier das zugrunde liegende Dilemma: die konstant steigende Anzahl neu diagnostizierter Pankreaszysten durch moderne Schnittbildverfahren und die Notwendigkeit der Selektion, welche Patienten überhaupt ein kontinuierliches Follow-up benötigen. Vice versa belegen große chirurgische Serien das eindeutig maligne Potenzial der IPMN und die Gefahr, auch bei Patienten unter kontinuierlicher Observanz die Entstehung eines Zystadenokarzinoms zu verkennen. Daten der chirurgischen Universitätsklinik Heidelberg zeigen das Problem eindrucksvoll. 1493 Pankreasoperationen für IPMN im Zeitraum 2001–2009 wurden nachuntersucht und kategorisiert. Patienten mit IPMN und Low-Grade-Dysplasie (30%) wurden folglich „zu früh“ operiert, da nicht gesichert ist, dass es in jedem dieser Fälle zu einer malignen Progression gekommen wäre. Als richtig gewählter Zeitpunkt und Operationsindikation wurden IPMN mit Borderline- oder High-Grade-Dysplasien eingestuft (35%). Ein baldiger Progress in ein invasives Karzinom ist in diesen Fällen wahrscheinlich. Durchaus alarmierend ergab die Studie jedoch, dass 34% der Patienten zum Operationszeitpunkt bereits ein IPMN-Karzinom entwickelt hatten, also „zu spät“ diagnostiziert wurden. 24% der Patienten mit IPMN-Karzinom standen zuvor überdies unter radiologischer Observanz!8
In Zusammenschau dieser Daten muss die Situation als sehr polarisiert gesehen werden. Einerseits eine steigende Zahl an diagnostizierten Zysten, welche die strukturellen Möglichkeiten einer kontinuierlichen Observanz in allen Fällen bei Weitem übersteigen würde. Andererseits die nicht unbeachtliche Anzahl an vermeidbaren invasiven Karzinomen des Pankreas, welche eine noch gewissenhaftere Observanz und ein aggressiveres chirurgisches Vorgehen rechtfertigen könnten. Die Guidelines der European Study Group on Cystic Tumours of the Pancreas und International Association of Pancreatology in ihrer aktuellen Version empfehlen bei gesicherter Diagnose des Zysten-Subtyps derzeit eine Resektion bei allen MCN, solid-pseudopapillären Neoplasien (SPN), Hauptast- bzw. gemischten IPMN bei chirurgisch fitten Patienten.9,10 Ein konservatives Vorgehen hingegen ist gerechtfertigt bei asymptomatischen Patienten mit Seitenast-IPMN ohne suspekte radiomorphologische oder zytologische Veränderungen sowie bei noch kleinen (<2cm), nicht klassifizierbaren zystischen Läsionen in Abwesenheit von Symptomen und „worrisome features“ oder „high-risk stigmata“.
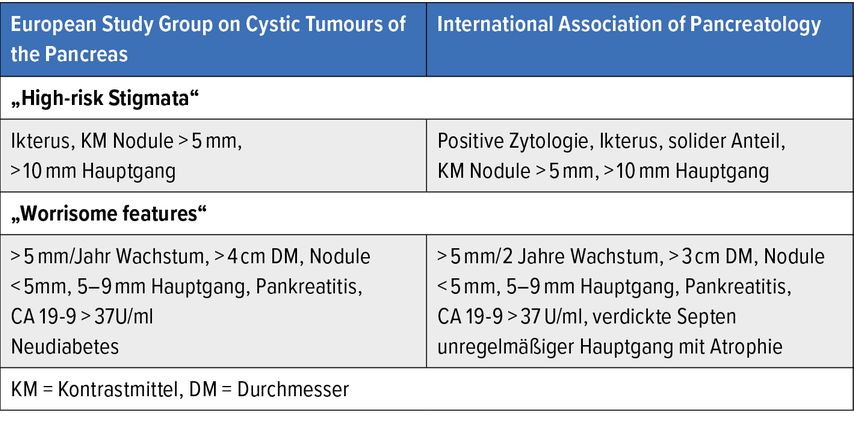
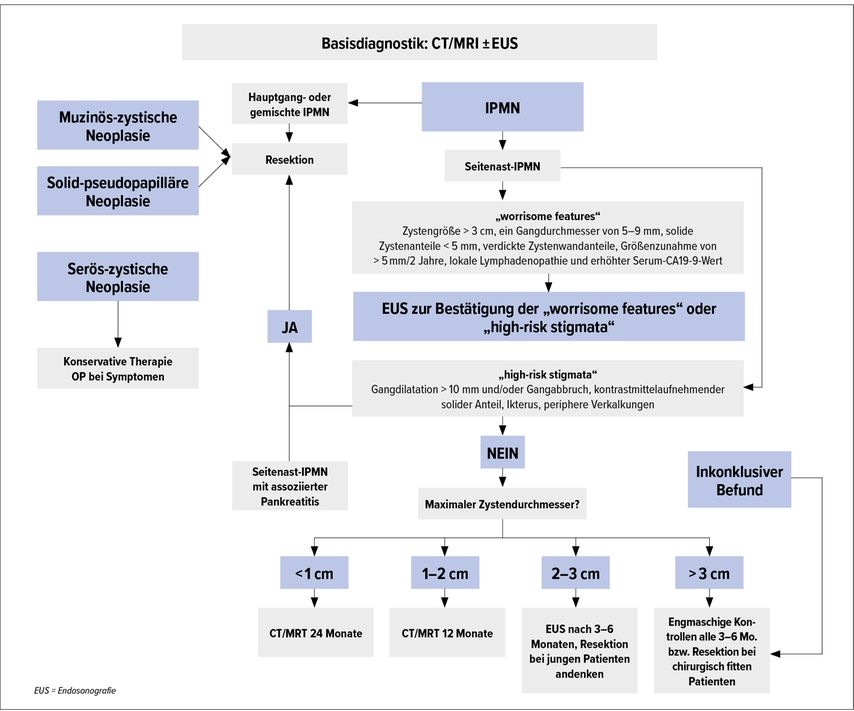
Unabhängig von der Zystenentität besteht der Verdacht auf das Vorliegen eines invasiven zystischen Karzinoms bei „high risk stigmata“: Gangdilatation >10mm und/oder Gangabbruch, kontrastmittelaufnehmendem solidem Anteil, Ikterus sowie peripheren Verkalkungen. Suspekt auf eine beginnende maligne Transformation sind sogenannte „worrisome features“: Zystengröße ≥3cm, ein abrupter Wechsel des Gangkalibers, ein Gangdurchmesser von 5–9mm, solide Zystenanteile <5mm, verdickte Zystenwandanteile, Größenzunahme um >5mm/2a, lokale Lymphadenopathie und ein erhöhter Serum-CA-19-9-Wert. Geringfügige Unterschiede zwischen den Guidelines sind in Tabelle 1 dargestellt, Abbildung 1 zeigt den entsprechenden Behandlungspfad.
Tab. 1: Guidelines der European Study Group on Cystic Tumours of the Pancreas und International Association of Pancreatology (modifiziert nach European Study Group on Cystic Tumours of the Pancreas; Tanaka M et al.)9, 10
Abb. 1: Diagnostischer Algorithmus der International Association of Pancreatology (modifiziert nach Tanaka M. et al.)10
Literatur:
1 Siegel RL et al.: Cancer statistics, 2016. CA Cancer J Clin 2016; 66(1): 7-30 2 Shaib WL et al.: Role of adjuvant therapy in resected stage IA subcentimeter (T1a/T1b) pancreatic cancer. Cancer 2019; 125(1): 57-67 3 Hosoda W et al.: Genetic analyses of isolated high-grade pancreatic intraepithelial neoplasia (HG-PanIN) reveal paucity of alterations in TP53 and SMAD4. J Pathol 2017; 242(1): 16-23 4 Adsay NV: Cystic neoplasia of the pancreas: pathology and biology. J Gastrointest Surg 2008; 12(3): 401-4 5 Brugge WR et al.: Cystic neoplasms of the pancreas. NEngl J Med 2004; 351(12): 1218-26 6 Kromrey ML et al.: Prospective study on the incidence, prevalence and 5-year pancreatic-related mortality of pancreatic cysts in a population-based study. Gut 2018; 67(1): 138 7 Surci N et al.: The faith of non-surveilled pancreatic cysts: a bicentric retrospective study. Eur J Surg Oncol 2021; S0748-7983(21)00569-2 8 Tjaden C et al.: Risk of the watch-and-wait concept in surgical treatment of intraductal papillary mucinous neoplasm. JAMA Surg 2021; 156(9): 818-25 9 European Study Group on Cystic Tumours of the Pancreas: European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018; 67(5): 789-804 10 Tanaka M et al.: Revisions of international consensus Fukuoka guidelines for the management of IPMN of the pancreas. Pancreatology 2017; 17(5): 738-53
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...