Sarkome: what’s new?
Autor:
PD Dr. med. Attila Kollár
Leitender Arzt
Co-Zentrumsleiter Sarkomzentrum
Universitätsklinik für Medizinische Onkologie
Inselspital, Universitätsspital Bern
E-Mail: attila.kollar@insel.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Sarkome stellen eine ausserordentlich heterogene Tumorentität dar und werden in über hundert Subtypen eingeteilt. Dies spiegelt sich auch in den präsentierten Forschungsarbeiten am diesjährigen Treffen der American Society of Clinical Oncology (ASCO) wider. Folgender Bericht gibt einen Überblick über ausgewählte neue Daten und die wichtigsten Highlights zum Thema «Sarkome».
Keypoints
-
Die neoadjuvante, konkomitierende Radio-/Chemotherapie ist mit einer akzeptablen Verträglichkeit durchführbar und scheint mit einer besseren objektiven Ansprechrate assoziiert zu sein. Das leicht erhöhte postoperative Komplikationsrisiko gilt es jedoch zu berücksichtigen.
-
Die Kombination von Immuntherapie mit Zytostatika/TKI zur Behandlung von metastasierten STS zeigt höhere Ansprechraten als üblich. Der Stellenwert sollte jedoch im Rahmen prospektiver, randomisierter Studien geklärt werden.
-
Das dedifferenzierte Lipo- und dedifferenzierte Chondrosarkom sprechen generell wenig auf Systemtherapien an. Die Wirksamkeit von MDM2-p53-Antagonisten bei dedifferenzierten Liposarkomen ist vielversprechend.
-
Die Wirksamkeit von Tyrosinkinase-Inhibitoren zur Behandlung von GIST ist abhängig von der Art der entstehenden Resistenzmutationen.
-
Gamma-Sekretase-Inhibitoren stellen eine neue systemtherapeutische Option zur Behandlung von Desmoid-Tumoren dar.
Weichteilsarkome
Lokalisiertes Tumorstadium: konkomitierende Radio-/Chemotherapie im neoadjuvanten Therapiesetting
Die additive und in der Regel neoadjuvant applizierte Radiotherapie (RT) zur Reduktion des Lokalrezidivrisikos und gegebenenfalls zur Verlängerung des Gesamtüberlebens (OS) bei Hochrisiko-Weichteilsarkomen (STS) der Extremitäten stellt einen Therapiestandard dar.
Basierend auf den kürzlich publizierten Daten von Pasquali S et al. verlängern drei Zyklen einer neoadjuvanten Chemotherapie mit Epirubicin und Ifosfamid (EI) bei STS der Extremitäten das OS bei Patient:innen mit einer ungünstigen Sarculator-ermittelten Prognose (10-Jahres-OS <60%).1 Ob in dieser Indikation die RT sequenziell oder konkomitierend mit der Chemotherapie gegeben werden soll und kann, ist unklar, wobei eine Kombination dieser zwei Therapiemodalitäten primär aus Verträglichkeitsgründen infrage gestellt wird.
Am diesjährigen ASCO-Jahrestreffen wurde über die Durchführbarkeit und Aktivität dieser Kombinationsstrategie basierend auf einer prospektiven Studie von Gronchi A et al. berichtet.2 Die RT wurde nach dem ersten Chemotherapiezyklus parallel mit dem zweiten und dritten Zyklus mit einer Dosis von 44–50Gy appliziert. Die Kombinationstherapie-Kohorte (n=146) wurde mit einer Population (n=143) verglichen, die eine sequenzielle Gabe in Form einer neoadjuvanten Chemotherapie und postoperativen RT erhielt.
In der Kombinationskohorte konnten sowohl die RT (96,6%) wie auch die Tumorresektion (98,6%) in der Regel wie geplant durchgeführt werden. Die Chemotherapie musste bei 8,2% vorzeitig abgebrochen werden. Im Vergleich zum sequenziellen Therapiekonzept wurde kein Unterschied in der Hämatotoxizität berichtet, jedoch ein erhöhtes Risiko für eine Wunddehiszenz (9% vs. 3,5%; p=0,053) und eine Seromentwicklung (10,5% vs. 3%; p=0,009). Die Rate an partiellen Remissionen (PR) war in der Kombinationsgruppe mit 19% vs. 10% signifikant höher.
Zusammengefasst erscheint die simultane Gabe einer RT und Chemotherapie mit einer akzeptablen Verträglichkeit durchführbar und mit einer besseren objektiven Ansprechrate assoziiert zu sein. Das postoperative Komplikationsrisiko gilt es jedoch zu berücksichtigen.3
Lokal fortgeschrittenes/metastasiertes Tumorstadium: Kombinationstherapien mit Immuncheckpoint-Inhibitoren
Der Stellenwert der Immuntherapie (IO) in der Therapie der STS wird weiterhin intensiv erforscht und debattiert. Der Einsatz von Immuntherapie stellt aufgrund der leider nur limitierten Wirksamkeit in einer unselektionierten STS-Kohorte keinen Standard dar. Der Nutzen ist u.a. abhängig vom Sarkom-Subtyp (gute Wirksamkeit bei undifferenzierten pleomorphzelligen Sarkomen [UPS], «Alveolar soft part»-Sarkomen und kutanen Angiosarkomen); der Nachweis von tertiären lymphoiden Strukturen im Tumorgewebe scheint eine prädiktive Bedeutung zu haben.
Im Rahmen einer explorativen einarmigen Phase-II-Studie wurde der Einsatz von Doxorubicin in Kombination mit Balstilimab (PD-1-Inhibitor) und Zalifrelimab (CTLA-4-Inhibitor) in der ersten und zweiten Therapielinie bei STS untersucht.
Während in einer ersten Kohorte mit alleiniger IO begonnen und verzögert mit Doxorubicin therapiert wurde, begann in einer zweiten Kohorte die Kombinationstherapie simultan. Der primäre Endpunkt, definiert als Rate des progressionsfreien Überlebens über sechs Monate (PFS6mo; 52%), wie auch die sekundären Endpunkte wie das mediane PFS (25,6 Wochen) sowie die objektive Ansprechrate (ORR; 36%) waren in der Gesamtkohorte verglichen mit historischen Daten zur Wirksamkeit von Doxorubicin-Monotherapie tendenziell besser.
Die immuntherapeutische Therapieeinleitung gefolgt von Doxorubicin war interessanterweise bei PFS6mo (56,3% vs. 25,0%), medianem PFS (31,7 v. 25,3 Wochen) und ORR (56% v. 8,3%) mit einem deutlich besseren Ergebnis assoziiert. Das Nebenwirkungsprofil entsprach den erwarteten Toxizitäten der jeweiligen Medikamente.
Zusammengefasst scheint die Hinzugabe einer PD1/CTLA4-Kombinationsimmuntherapie im Vergleich zu Doxorubicin einen Vorteil zu bringen. Die Sequenz zwischen der Applikation von Immun- und Chemotherapie scheint von Relevanz zu sein. Welche STS von dieser Therapie in Zukunft profitieren könnten, bleibt abzuwarten.4
Die Phase-Ib/II-Studie ImmunoSarc2 untersuchte die Kombination von Doxorubicin+Dacarbazin und Nivolumab und fokussierte hierbei primär auf Leiomyosarkome (LMS). Die Kombination Doxorubicin+Dacarbazin stellte sich vorgängig in einer retrospektiven Analyse als potenziell wirksamste Chemotherapiekombination bei LMS dar (medianes PFS: 9,2 Monate, ORR: 30,9%).5
Nivolumab wurde in der Studie alle drei Wochen in einer Dosis von 360mg an Tag 2 verabreicht. Es traten keine dosislimitierenden Toxizitäten auf. Insbesondere die Ansprechrate stellte sich mit 56,2% als sehr vielversprechend dar, mit einem medianen PFS von 8,67 Monaten. Die HMGB1Konzentration im Blut («high-mobility group protein B1», ein Protein, das eine Rolle in der Tumorentwicklung und Immunabwehr spielt) korrelierte mit der Ansprechdauer.
Welchen Stellenwert ein immuntherapeutischer Ansatz in der ersten Therapielinie bei LMS haben wird, ist noch ungewiss. In naher Zukunft soll basierend auf den Resultaten von internationalen, teils randomisierten Studien die bestwirksame Chemotherapiekombination geprüft werden (Doxorubicin in Kombination mit Dacarbazin oder Trabectedin oder Lurbinectedin).6 Notabene präsentierten Cote GM et al. Phase-Ib-Studiendaten für Doxorubicin+Lurbinectedin bei STS. Die Ansprechrate war bei jedoch limitierter Patient:innenzahl (n=10) sowohl in der Gesamtkohorte der STS wie auch bei den LMS mit 60% hoch.7
Der Einsatz einer Immuntherapie insbesondere bei kutanen Angiosarkomen ist sehr vielversprechend. Ein Zusammenhang zwischen UV-exponierter Haut und hoher Mutationslast ist wahrscheinlich. Eine Doxorubicin- oder Paclitaxel-haltige Systemtherapie stellt in der Regel den aktuellen Therapiestandard bei Angiosarkomen in der ersten Therapielinie dar.
Aufgrund präklinischer synergistischer Effekte wurde im Rahmen der Phase-II-Studie Alliance A091902 die Wirksamkeit der Kombination von Nivolumab (480mg alle vier Wochen) mit Cabozantinib (60mg tgl.) nach Versagen/Intoleranz auf Paclitaxel getestet.8
Die ORR, der primäre Endpunkt, lag bei 59%; das mediane PFS bei 9,6 Monaten (n=22). Interessanterweise war die Ansprechrate bei nichtkutanen Angiosarkomen mit 67% vs. 54% sogar höher. Die Resultate zu dieser hoffnungsvollen Kombination als Erstlinientherapie stehen noch aus. Der Stellenwert der Kombination bleibt abzuwarten.
MDM2-p53-Antagonist: ein neuer systemtherapeutischer Ansatz beim dedifferenzierten Liposarkom
Dedifferenzierte Liposarkome (DDLS) werden mit einer Ansprechrate von ca. 11% bei Anthrazyklin- oder Ifosfamid-haltiger Therapie als relativ chemoresistente Sarkom-Subtypen bezeichnet.
«Mouse double-minute 2» (MDM2), ein Onkogen, ist bei fast 100% der DDLS amplifiziert/überexprimiert und stellt nach heutigem Wissensstand wohl das wichtigste Driver-Gen bei dieser Entität dar. MDM2 kann als Onkogen die Funktion des p53-Wildtyps unterdrücken, der somit als negativer Regulator von MDM2 ausfällt.
LoRusso P und Kolleg:innen berichten nun über die im Rahmen einer Phase-Ib-Studie analysierte Verträglichkeit und über präliminäre Daten zur Wirksamkeit von BI 907828, einem MDM2-p53-Antagonisten. Zu den häufigsten Nebenwirkungen gehörten Nausea, Müdigkeit und Myelotoxizität. Die Ansprechrate bei 42 eingeschlossenen DDLS lag bei 19%, die Kontrollrate (objektives Ansprechen und Tumorstabilisierung) lag bei 88,1%; das mediane PFS bei 8,1 Monaten.
Basierend auf diesen Daten scheinen MDM2-p53-Antagonisten eine Erfolg versprechende neue Therapieoption bei fortgeschrittenen DDLS darzustellen. Im Rahmen der laufenden Phase-II/III-Studie Brightline-1 wird dieser Wirkstoff bereits mit Doxorubicin in der Erstliniensituation bei DDLS verglichen.9
Knochensarkome
Dedifferenziertes Chondrosarkom: Stellenwert der Immuntherapie
Das dedifferenzierte Chondrosarkom (DDCS) repräsentiert 5–10% aller Chondrosarkome und ist mit einem höchst aggressiven Krankheitsverlauf, ungenügendem Therapieansprechen und einer sehr ungünstigen Prognose assoziiert.
In einer aktuell präsentierten Phase-II-Studie wurde die Wirksamkeit von Atezolizumab, einem Anti-PD-L1-Antikörper, untersucht. Bei drei von sieben Proband:innen konnte eine kurz anhaltende Tumorstabilisierung erzielt werden; notabene keine Regredienz nach RECIST-Kriterien. Obwohl die Interpretation der Resultate aufgrund der sehr geringen Anzahl eingeschlossener DDCS limitiert ist, scheinen PD-L1-Inhibitoren als Monotherapie wenig wirksam zu sein.10
Gastrointestinale Stromatumoren
Analyse des Gesamtüberlebens: Update der INTRIGUE-Studie
Die INTRIGUE-Studie verglich im Rahmen eines Phase-III-Designs die Wirksamkeit und Verträglichkeit von Ripretinib und Sunitinib als Zweitlinientherapie zur Behandlung von gastrointestinalen Stromatumoren (GIST).11
Die Studienresultate wurden bisher noch nicht abschliessend publiziert; der Vergleich hinsichtlich des Gesamtüberlebens war bisher ausstehend. Im Rahmen der aktuellen zweiten Interimsanalyse konnte in der Gesamtpopulation wie auch in den Exon-11-GIST kein Unterschied im Nutzen detektiert werden (median 35,5 vs. 30,9 Monate; HR: 0,88; 95% CI: 0,66–1,18; p=0,39).
25,6% im Sunitinib-Arm erhielten im Verlauf der Studie Ripretinib; 61,5% im Ripretinib-Arm später Sunitinib.12 Erwähnenswert und von womöglich hoher therapeutischer Implikation sind diese in der diesjährigen «ASCO plenary session» präsentierten Daten von Bauer S et al. Die Wirksamkeit von Ripretinib und Sunitinib scheint basierend auf explorativen Daten inkl. ctDNA-Analysen von der Art der Resistenzmutation nach Imatinibversagen abhängig zu sein. Bei Exon-11+17/18-mutierten GIST war Ripretinib im Vergleich zu Sunitinib mit einem signifikant längeren PFS assoziiert (14,2 vs. 1,5 Monate). Im Gegensatz dazu profitierten GIST mit einer KIT-Exon-13/14-Mutation mehr von Sunitinib (15 vs. 4 Monate). Diese höchst interessanten Beobachtung soll nun prospektiv und randomisiert im Rahmen der INSIGHT-Studie nachgegangen werden (NCT05734105).
Abhängigkeit der Wirksamkeit von Avapritinib von der KIT-Resistenzmutation
Avapritinib, ein neuerer KIT/PDGFR-alpha-Inhibitor, wurde basierend auf den Resultaten der NAVIGATOR-Studie zur Behandlung von fortgeschrittenen/metastasierten GIST mit Nachweis einer PDGFRA-D842V-Mutation in Europa zugelassen.
In der selbigen Studie wurden jedoch auch KIT-mutierte GIST nach mindestens einer Vortherapie eingeschlossen. Basierend auf den aktuell präsentierten ASCO-Daten, welche post hoc erhoben wurden und eine asiatische Kohorte miteinschlossen, war die Wirksamkeit von Avapritinib vom KIT-Genotyp abhängig. Sowohl die Ansprechrate wie auch das PFS waren bei Exon-17/18-mutierten GIST («activation loop») im Vergleich zu KIT-Mutationen anderer Lokalisation signifikant höher; das partielle Therapieansprechen lag bei 16,7% vs. 12% und das mediane PFS bei 9,1 Monaten vs. 3,4 Monate. Bei austherapierten GIST (≥4 Vortherapien) mit Exon-9-Mutation wurde ebenfalls eine klinisch relevante Wirksamkeit beschrieben.13
Zusammengefasst deuten diese beiden Studienresultate darauf hin, dass die Art der Resistenzmutation nach Imatinib-Vortherapie von hoher prädiktiver Relevanz ist und in Zukunft zum Beispiel mittels ctDNA detektiert und analysiert werden sollte.
Desmoid-Tumoren
Desmoid-Tumoren (DT) stellen eine seltene, lokal infiltrativ wachsende, jedoch nicht metastasierende Tumorerkrankung dar, die durch eine monoklonale, fibroblastische Proliferation charakterisiert ist.
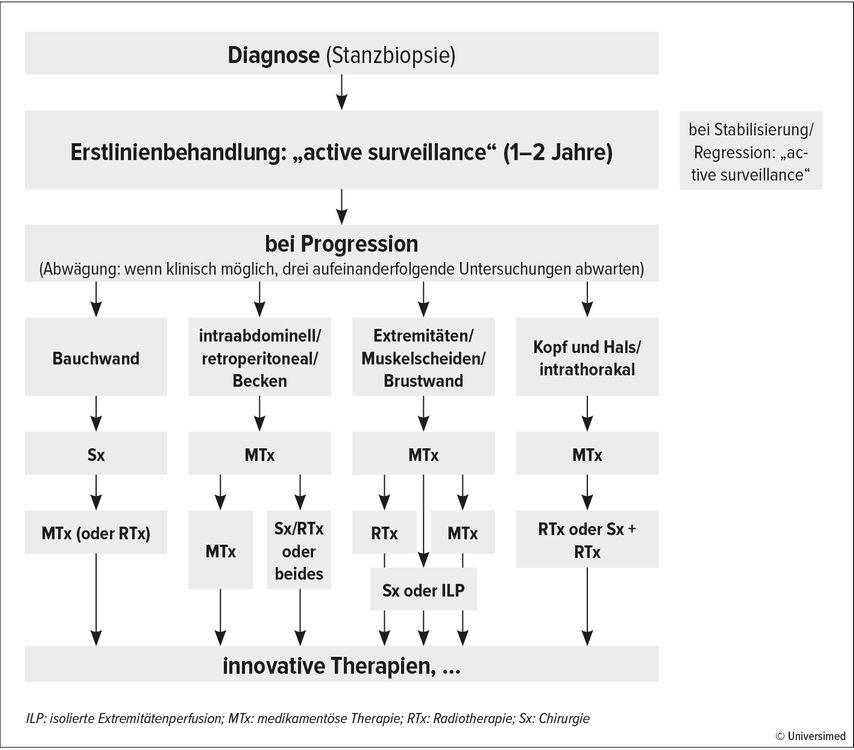
Der klinische Verlauf gestaltet sich sehr variabel mit spontanem Sistieren des Wachstums oder sogar Tumorregredienz in bis zu 50% der Fälle. Entsprechend stellt die «active surveillance», sofern klinisch vertretbar, die primäre Handlungsstrategie dar. Besteht die Indikation für ein aktives therapeutisches Vorgehen, gilt es, chirurgische, radio- und systemtherapeutische Optionen zu evaluieren (Abb. 1).
In den letzten Jahren, wie auch am diesjährigen ASCO-Jahrestreffen, wurden interessante, Erfolg versprechende Daten zu neuen medikamentösen Therapieoptionen präsentiert.
Neue medikamentöse Therapieoptionen
Die Aktivierung der zellulären Wnt- und Notch-Signaltransduktionskaskade bzw. deren Interaktion scheinen bei DT eine wichtige Rolle als Proliferationsstimulus einzunehmen. Gamma-Sekretase-Inhibitoren (GSI), konkret Nirogacestat, zeigten im Rahmen einer randomisierten, placebokontrollierten Phase-III-Studie (DeFi) eine eindrückliche antitumorale Wirksamkeit.14
Auf der diesjährigen ASCO-Konferenz wurden auch die Phase-II-Daten der RINGSIDE-Studie vorgestellt, in deren Rahmen die Wirksamkeit und Toxizität von AL102, einem weiteren oralen GSI, bei progredienten und/oder symptomatischen DT untersucht wurde.
44 Patient:innen wurden analysiert. 69% der Involvierten waren vortherapiert. Die Ansprechrate nach RECIST lag bei 50% in der Gruppe mit kontinuierlicher Tabletteneinnahme, jedoch niedriger bei intermittierender Therapie (zwei Tage «on», fünf Tage «off»). Nach 10,5 Monaten Beobachtungszeit lag die Krankheitskontrollrate bei 100%.15
Zu den häufigsten Nebenwirkungen gehörten insbesondere Diarrhö, Nausea, Müdigkeit sowie Alopezie, in der Regel mit einer Ausprägung von Grad 1 und 2.
Diese Studienresultate bestätigen die hohe und anhaltende Wirksamkeit von GSI bei DT. Dem Nebenwirkungsprofil (Alopezie und hormonelle, die Fertilität beeinflussende Toxizität) gilt es jedoch in Zukunft und mit längerer Nachbeobachtungszeit Beachtung zu schenken. Unabhängig davon erweitern GSI das therapeutische Armamentarium bei dieser Tumorentität.
Die Studie (DART) SWOG S1609 untersucht im Rahmen eines Phase-II-Studiensettings die Kombination von Ipilimumab (1mg i.v. alle sechs Wochen) und Nivolumab (3mg i.v. alle zwei Wochen) bei unterschiedlichsten Malignomen. Die Kohorte Nummer 27 wurde den DT gewidmet.16
Die Kombinationstherapie zeigte eine Ansprechrate nach RECIST von 18,8% sowie ein medianes PFS von 17,9 Monaten mit teils lang anhaltendender Tumorkontrolle. Die Interpretation dieser Studienergebnisse ist schwierig; sie bedürfen in Zukunft sicherlich weiterer Erforschung, insbesondere hinsichtlich prädiktiver Faktoren.
Welchen Einfluss spielt Schwangerschaft bei Frauen mit DT?
Basierend auf klinischen Beobachtungen und meist retrospektiven Serien wird immer wieder ein Zusammenhang zwischen Hormonstatus und Krankheitsentstehung sowie -entwicklung postuliert. Fiore M et al. untersuchten im Rahmen einer internationalen, retrospektiven Beobachtungsstudie mögliche Zusammenhänge zwischen DT und Schwangerschaft (SS). Hierfür wurden 483 Proband:innen befragt.17
Die geschätzten Progressionsraten gemäss RECIST-Kriterien betrugen 12,0% (CI: 2,0–48,4) während der SS und 15,8% (CI: 5,6–37,5) nach der SS. Die geschätzte spontane Regressionrate betrug dementsprechend 3,6% (CI: 0,2–40,7) und 7,1% (CI: 0,3–67,2). In einer multivariaten Analyse ergab sich, dass das Alter und die Tumorgrösse mit einem höheren Risiko für eine Progression einherzugehen scheinen. Eine Indikation zur Therapieeinleitung während der Schwangerschaft trat nur bei 6,3% auf.
Das Risiko für Komplikationen bei der Geburt war vergleichbar mit der gesunden Bevölkerung. Diese Ergebnisse erlauben uns, DT-Patient:innen zukünftig zu dieser Thematik besser informieren und beraten zu können.
Literatur:
1 Pasquali S et al.: The impact of chemotherapy on survival of patients with extremity and trunk wall soft tissue sarcoma: revisiting the results of the EORTC-STBSG 62931 randomised trial. Eur J Cancer 2019; 109: 51-60 2 Gronchi A et al.: Neoadjuvant chemotherapy in highrisk soft tissue sarcomas: a randomised clinical trial from the Italian Sarcoma Group, the Spanish Sarcoma Group (GEIS), the French Sarcoma Group (FSG) and the Polish Sarcoma Group (PSG). Lancet Oncol 2017; 18(6): 812e22 3 Palassini E et al.: A phase III randomized trial of neo-adjuvant chemotherapy in high-risk soft tissue sarcoma (ISG-STS 1001): feasibility and activity of concurrent chemotherapy and radiation therapy. ASCO 2023; Abstr. #11506 4 Wilky BA et al.: A single-arm, open-label phase 2 trial of doxorubicin plus zalifrelimab, a CTLA-4 inhibitor, with balstilimab, a PD-1 inhibitor, in patients with advanced/metastatic soft tissue sarcomas. ASCO 2023; Abstr. #11501 5 D’Ambrosio L et al.: Doxorubicin plus dacarbazine, doxorubicin plus ifosfamide, or doxorubicin alone as a first-line treatment for advanced leiomyosarcoma: a propensity score matching analysis from the European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. 2020; 126(11): 2637-47 6 Broto JM et al.: ImmunoSarc2: a Spanish Sarcoma Group (GEIS) phase Ib trial of doxorubicin and dacarbazine plus nivolumab in first line treatment of advanced leiomyosarcoma. ASCO 2023; Abstr. #11502 7 Cote GM et al.: Efficacy of combination lurbinectedin (LURBI) + doxorubicin (DOX) from the phase 1B soft-tissue sarcoma (STS) lead-in to a randomized phase 2 trial in leiomyosarcoma (LMS). ASCO 2023; Abstr. #11507 8 Grilley-Olson JE et al.: A multicenter phase II study of cabozantinib + nivolumab for patients (pts) with advanced angiosarcoma (AS) previously treated with a taxane (Alliance A091902). ASCO 2023; Abstr. #11503 9 LoRusso P et al.: A phase Ia/Ib, dose-escalation/expansion study of the MDM2–p53 antagonist BI 907828 in patients (pts) with solid tumors: Safety and efficacy in patients with dedifferentiated liposarcoma (DDLPS). ASCO 2023; Abstr. #11554 10 Salkeni MA et al.: A phase 2 study of an anti–PD-L1 antibody (atezolizumab) in dedifferentiated chondrosarcoma. ASCO 2023; Abstr. #11533 11 Bauer S et al.: Ripretinib versus sunitinib in patients with advanced gastrointestinal stromal tumor after treatment with imatinib (INTRIGUE): a randomized, open-label, phase III trial. J Clin Oncol 2022; 40(34): 3918-28 12 Lewis Jones R et al.: Overall survival and long-term safety in patients with advanced gastrointestinal stromal tumor previously treated with imatinib: updated analyses from INTRIGUE. ASCO 2023; Abstr. #11524 13 Heinrich MC et al.: Clinical efficacy of avapritinib in gastrointestinal stromal tumors (GIST) with different KIT genotypes: Post hoc analysis of the phase 1 NAVIGATOR and phase 1/2 CS3007-101 trials. ASCO 2023; Abstr. #11523 14 Gounder MM et al.: Nirogacestat, a γ-secretase inhibitor for desmoid tumors. NEng J Med 2023; 388(10): 898-912 15 Gounder MM et al.: RINGSIDE phase 2/3 trial of AL102 for treatment of desmoid tumors (DT): Phase 2 results. ASCO 2023; Abstr. #11515 16 Chae YK et al.: A phase II basket trial of dual anti–CTLA-4 and anti–PD-1 blockade in rare tumors (DART) SWOG S1609: the desmoid tumors (cohort 27). ASCO 2023; Abstr. #11516 17 Fiore M et al.: Impact of pregnancy in women with desmoid fibromatosis: An international retrospective observational study. ASCO 2023; Abstr. #11513 18 Desmoid Tumor Working Group: The management of desmoid tumours: a joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer 2020; 127: 96-107
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...