Auf der Suche nach der idealen Strategie
Redaktion und Übersetzung aus dem Englischen:
Dr. med. Judith Moser
Autorin:
Prof. Dr. med. Christina Fotopoulou, PhD
Gynaecological Cancer Surgery
Imperial College London, UK
E-Mail: c.fotopoulou@imperial.ac.uk
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die systemische Therapie des Ovarialkarzinoms hat sich in den letzten dreizehn Jahren dank der Einführung zielgerichteter Substanzen wie der PARP-Inhibitoren massgeblich verbessert. Dennoch sind weitere Forschungsarbeiten notwendig, da Rezidive häufig auftreten und die Identifikation des optimalen Therapieplans im Einzelfall eine besondere Herausforderung darstellt.
Bei der systemischen und chirurgischen Therapie des Ovarialkarzinoms (OC) konnten in den letzten Jahrzehnten grosse Fortschritte erzielt werden. Ungeachtet dessen besteht nach wie vor ein signifikanter Bedarf an optimierten Erstlinienoptionen. Laut einer Schätzung von 2013 rezidivieren rund 70% der Patient:innen innerhalb von drei Jahren nach der Erstlinientherapie.1 Obwohl sich diese Zahl durch die Implementation potenter Erhaltungstherapien in nächster Zeit ändern könnte, wird ein grosser Teil der Patient:innen auch weiterhin Rezidive erleiden.
Lange Zeit bildeten zytoreduktive Chirurgie und Chemotherapie die Säulen des therapeutischen Managements. Ab der Einführung von Bevacizumab im Jahr 2011 durchlief die Therapielandschaft einen grundlegenden Wandel, der auf der Zugabe zielgerichteter Substanzen sowohl zur Chemotherapie als auch zur Erhaltungstherapie beruhte. Eine wichtige Studie ist die randomisierte, doppelblinde Phase-III-Studie PRIMA, die den PARP-Inhibitor Niraparib als Erhaltungstherapie mit Placebo verglich. Patient:innen mit neu diagnostiziertem, hochgradig serösem oder endometrioidem fortgeschrittenem Ovarialkarzinom nahmen teil, nachdem sie unter einer platinbasierten Erstlinien-Chemotherapie ein komplettes oder partielles Ansprechen entwickelt hatten. Rund ein Drittel befand sich im Stadium IV, und fast alle Patient:innen im Stadium III wiesen nach dem Debulking einen Resttumor auf. Eine homologe Rekombinationsdefizienz (HRD) lag bei der Hälfte der 733 randomisierten Patient:innen vor.
Update der PRIMA-Studie
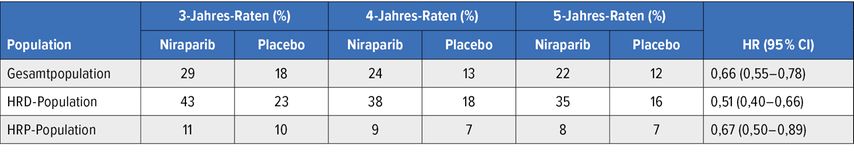
Gemäss der Primäranalyse war das progressionsfreie Überleben (PFS) in der Gesamtpopulation unter Niraparib unabhängig vom homologen Rekombinationsstatus signifikant länger als unter Placebo (13,8 vs. 8,2 Monate; HR: 0,62; p<0,001).2 Das am Kongress der European Society of Medical Oncology (ESMO) 2024 präsentierte Update zeigte einen anhaltenden PFS-Vorteil sowohl in der Gesamtgruppe als auch in der HRD-Kohorte (Tab. 1).3 Bei HR-profizienten (HRP) Tumoren wurde kein relevanter Vorteil festgestellt. Wie erwartet profitierte die HRD-Kohorte am stärksten, wobei die PFS-Rate nach fünf Jahren unter Niraparib jene unter Placebo um das Doppelte überstieg (35% vs. 16%). Dieses Ergebnis ist bemerkenswert, da eine 5-Jahres-PFS-Rate von 35% in einer Population mit derart ungünstigen Charakteristika noch vor wenigen Jahren nicht denkbar gewesen wäre. Die PFS-Kurven in der Gesamtgruppe und der HRD-Kohorte blieben trotz der langen Nachbeobachtungszeit von fast 90 Monaten getrennt.
Tab. 1: Progressionsfreies Überleben unter Niraparib vs. Placebo in der PRIMA-Studie (modifiziert nach González-Martín A et al.)3
Allerdings wurde hinsichtlich des Gesamtüberlebens kein signifikanter Unterschied zwischen den beiden Armen der PRIMA-Studie festgestellt, was auf alle Populationen zutraf. Die Autor:innen weisen darauf hin, dass die Beurteilung der Langzeitwirksamkeit beim fortgeschrittenen Hochrisiko-OC durch Faktoren wie Folgetherapien erschwert sein kann. Tatsächlich erhielt der Placeboarm etwa dreimal häufiger eine anschliessende PARP-Inhibition als der Niraparib-Arm; dieser Unterschied war in der HRD/BRCA-mutierten Kohorte besonders auffällig. Andere mögliche Erklärungen beziehen sich auf die sehr guten Outcomes im Kontrollarm und das hohe Rezidivrisiko dieser Patient:innen. Insgesamt stellen die Ergebnisse den Wert der PARP-Inhibition in der Erstlinientherapie des OC nicht infrage.
PARP-Inhibitoren als Game Changer
Auch nach einem Follow-up von bis zu sieben Jahren wurden in der PRIMA-Studie keine neuen Sicherheitssignale beobachtet. Die Raten an myelodysplastischen Syndromen (MDS) und akuten myeloischen Leukämien (AML) waren mit 2,3% vs. 1,6% niedrig und entsprachen den MDS/AML-Raten aus den Phase-III-Studien zu den PARP-Inhibitoren Olaparib und Rucaparib. Bei Verwendung der weltweit zugelassenen Niraparib-Anfangsdosis, die an Körpergewicht und Thrombozytenzahl angepasst wird, resultierte eine geringere Häufigkeit hämatologischer Toxizitäten als bei Verordnung der fixen Dosis. Der Conclusio der Autor:innen zufolge sprechen die Langzeitergebnisse unabhängig vom homologen Rekombinationsstatus für den Benefit der Erstlinien-Erhaltungstherapie mit Niraparib.
In Anbetracht der Datenfülle zur PARP-Inhibition können wir unseren Patient:innen mitteilen, dass diese Behandlung sicher ist. Die Erhaltungstherapie mit PARP-Inhibitoren stellt zweifellos nach wie vor einen «Game Changer» dar, insbesondere bei HRD-Tumoren. Bei Fehlen von Kontraindikationen sollte für die Gruppe mit HRD und Resterkrankung die zusätzliche Gabe von Bevacizumab erwogen werden. Im Setting des OC mit HRP besteht natürlich ein Bedarf an anderen Substanzen. Wir müssen für jede Patientin in Abhängigkeit von Faktoren wie Biomarkern, chirurgischen Outcomes, dem Ansprechen auf die Chemotherapie und dem Toxizitätsprofil die ideale systemische Therapie und «Maintenance» auswählen, was sich als herausfordernd erweisen kann.
Daten zur Immuntherapie
Während die Immuntherapie die Behandlung anderer gynäkologischer Krebsarten wie des Endometriumkarzinoms revolutioniert hat, gibt es beim OC noch viel zu lernen. Ein Beispiel für enttäuschte Erwartungen ist die Phase-III-Studie ATHENA-COMBO, in der beim neu diagnostizierten OC im Stadium III–IV eine Erhaltungstherapie mit der Kombination aus Rucaparib und Nivolumab getestet wurde.4 Der Kontrollarm erhielt eine Rucaparib-Monotherapie. Die Patient:innen hatten nach der «Frontline»-Gabe einer Platin-Doublette und der Operation ein vollständiges oder partielles Ansprechen erreicht. Obwohl Rucaparib die zu erwartende Performance an den Tag legte, war die Kombination mit Nivolumab der Rucaparib-Monotherapie nicht nur nicht überlegen, sondern sogar unterlegen (medianes PFS: 15,0 vs. 20,2 Monate; HR: 1,29).
Insgesamt lässt sich festhalten, dass beim hochgradig serösen OC auf die Zugabe von PD-(L)1-Inhibitoren zur Chemotherapie verzichtet werden soll, da erst noch weitere Forschungen notwendig sind. Das bedeutet nicht, dass die Immuntherapie nicht weiter evaluiert werden sollte, aber offensichtlich herrschen beim OC diesbezüglich kompliziertere Verhältnisse als bei anderen Krebsarten.
Derzeit befinden sich weltweit fast 190 Antikörper-Wirkstoff-Konjugate in Entwicklung, und die Menge an Angriffspunkten wächst kontinuierlich. Hier haben wir die Büchse der Pandora geöffnet, wobei das OC keine Ausnahme darstellen kann. Allerdings wird es erforderlich sein herauszufinden, wie sich diese neuen Therapien in die Behandlungslandschaft des OC einfügen sollen.
Fazit
In den letzten Jahren haben wir viel gelernt und speziell bei Patient:innen mit BRCA-mutierten/HRD-Tumoren zahlreiche Fortschritte erzielt. Während sich die systemische Therapielandschaft rasch verändert hat, besteht die aktuelle Herausforderung darin festzustellen, welche Werkzeuge im Einzelfall zuerst eingesetzt und welche für später aufgespart werden sollen. Dies bringt die Notwendigkeit mit sich, Patient:innengruppen besser zu charakterisieren, robuste Biomarker zu identifizieren und konkrete Behandlungsalgorithmen zu definieren.
Gegenwärtig ist der HRD-Status der einzige valide Biomarker, obwohl letztlich das Ansprechen auf die Platintherapie und die chirurgische Qualität den Ausschlag geben. Natürlich müssen die Belastung durch die chirurgischen und systemischen Therapien sowie deren Toxizitäten gegen den tatsächlichen Behandlungsnutzen abgewogen werden.
Literatur:
1 Ledermann JA et al.: Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(Suppl. 6): vi24-32 2 González-Martín A et al.: Niraparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med 2019; 381(25): 2391-402 3 González-Martín A et al.: Final overall survival in patients with newly diagnosed advanced ovarian cancer treated with niraparib first-line maintenance: Results from PRIMA/ENGOT-OV26/GOG-3012. ESMO 2024; Abstract LBA29 4 Monk BJ et al.: ATHENA-COMBO, a phase III, randomized trial comparing rucaparib (RUCA) + nivolumab combination therapy vs RUCA monotherapy as maintenance treatment in patients with newly diagnosed ovarian cancer. Ann Oncol 2024; 35 (Suppl. 2): 1-72
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...