Vorläuferläsionen des Pankreaskarzinoms
Autorinnen:
Rita Vesce
Dr. Lena Häberle
Univ.-Prof. Dr. Irene Esposito
Institut für Pathologie
Heinrich-Heine-Universität Düsseldorf
Korrespondenz:
Aufgrund der Heterogenität und des unterschiedlichen Entartungspotenzials von Vorläuferläsionen des Pankreaskarzinoms ist es notwendig, diese Neoplasien exakt zu diagnostizieren, um eine adäquate Patientenversorgung zu gewährleisten. In diesem Artikel werden die wichtigsten morphologischen und molekularen Charakteristika zur Klassifizierung dieser Präkanzerosen erläutert.
Keypoints
-
Die Vorläuferläsionen des pankreatischen duktalen Adenokarzinoms («pancreatic ductal adenocarcinoma», PDAC) sind eine heterogene Gruppe von Entitäten mit unterschiedlichem Progressionsrisiko.
-
Die Unterschiede der PDAC-Vorläufer in Morphologie, molekularem Profil und biologischem Verhalten lassen sich möglicherweise durch einen unterschiedlichen zellulären Ursprung erklären.
-
Die makroskopischen Vorläufer des PDAC manifestieren sich meist als zystische Läsionen, deren Diagnose durch die kombinierte Feinnadelpunktionsdiagnostik und genetische Untersuchung der Zystenflüssigkeit mittels «Next-Generation Sequencing»(NGS)-Verfahren mit hoher Treffsicherheit möglich ist. Trotzdem ist es notwendig, neue Marker zu identifizieren, um «High-grade»-Läsionen sicher zu erkennen.
Um die sehr ungünstige Prognose des Pankreaskarzinoms zu verbessern, ist es notwendig, neue Früherkennungsmethoden zu entwickeln. Screeningverfahren sind aber in der Allgemeinbevölkerung aufgrund der niedrigen Prävalenz der Erkrankung nicht sinnvoll.1
Die exakte Diagnose der Vorläuferläsionen des pankreatischen duktalen Adenokarzinoms (PDAC) kann die Chance auf eine genaue Stratifizierung bieten: Läsionen mit hohem Progressionsrisiko können rechtzeitig erkannt und reseziert werden, während «Low-risk»-Läsionen im Verlauf beobachtet werden können.2,3
Mikroskopische Läsionen
PanIN: «low-grade» vs. «high-grade»
Pankreatische intraepitheliale Neoplasien (PanIN) sind mikroskopische (<5mm) Läsionen, die meistens in peripheren Ästen des Gangsystems zu finden sind.3 Sie werden nach Dysplasiegrad als «Low-grade»- und «High-grade»-Läsionen klassifiziert (Abb. 1, A-F).4 Molekulargenetisch kommen Mutationen von KRAS («Kirsten rat sarcoma virus») und CDKN2A («cyclin-dependent kinase inhibitor 2A») häufig bei «Low-grade»-PanIN vor. Im Gegensatz dazu sind Mutationen von TP53 («tumor protein p53») und SMAD4 («mothers against decapentaplegic homolog 4») ausschliesslich in «High-grade»-PanIN zu finden, wenn auch äusserst selten.5,6
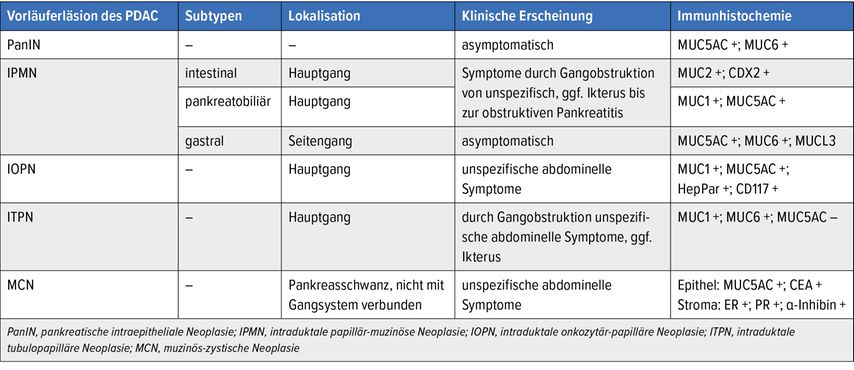
Tab. 1: Übersicht über Klassifikationsmerkmale, klinische und immunhistochemische Eigenschaften von Vorläuferläsionen des pankreatischen duktalen Adenokarzinoms (PDAC)2,3,23,26,31
«Low-grade»-PanIN sind in Pankreata von über der Hälfte von Erwachsenen über 50 Jahre zu finden.7 «High-grade»-PanIN werden im Gegensatz dazu fast ausschliesslich in PDAC-Resektaten diagnostiziert.7,8 Darüber hinaus kommen «High-grade»-Pan-IN ohne invasives Karzinom in Pankreata von Patienten mit genetischer Prädisposition für das Pankreaskarzinom gehäuft vor.9
PanIN als Nebenbefund
Aufgrund ihrer Grösse können PanIN durch bildgebende Verfahren nicht detektiert werden und werden i.d.R. in Pankreasresektaten als Nebenbefund diagnostiziert.10 Bei der intraoperativen Diagnostik können «Low-grade»-PanIN im Pankreasabsetzungsrand wegen ihres niedrigen Malignitätspotenzials ignoriert werden.4,11 Wenngleich Literaturdaten suggerieren, dass «High-grade»-PanIN im Pankreasabsetzungsrand auch beim Verzicht auf eine Nachresektion die Prognose nicht verschlechtern,11 wird eine Nachresektion beim Vorkommen einer «High-grade»-PanIN im Pankreasabsetzungsrand meistens angestrebt.4
Makroskopische Läsionen
Aufgrund der heutzutage häufigen Anwendung von neuen bildgebenden Verfahren beträgt die Prävalenz für inzidentell diagnostizierte zystische Pankreastumoren in der älteren Bevölkerung bis zu 13,5%.12,13 Um überflüssige operative Eingriffe zu vermeiden, die mit hohen Komplikationsraten verbunden sind,14 ist eine genaue diagnostische Abklärung z.B. mittels Feinnadelpunktionsdiagnostik erforderlich.
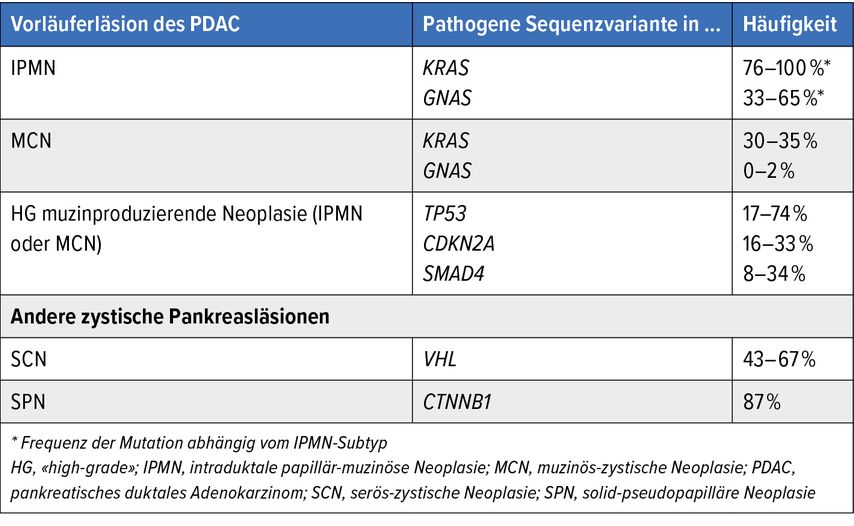
Aufgrund der geringen Menge an gewonnenem Gewebe kann die exakte Diagnose eine Herausforderung darstellen. «Next-Generation Sequencing»-Methoden können die diagnostische Treffsicherheit erheblich erhöhen.15 Mittels Detektion spezifischer pathogener Sequenzvarianten können Pankreasneoplasien schon anhand der Analyse in Zystenflüssigkeit vorhandener zellfreier DNA (cfDNA) sicher klassifiziert werden. Die wichtigsten charakteristischen pathogenen Sequenzvarianten sind in Tabelle 2 zusammengefasst.16
Intraduktale papillär-muzinöse Neoplasien
Intraduktale papillär-muzinöse Neoplasien (IPMN) sind intraduktale, makroskopische (≥1cm) Neoplasien mit muzinbildendem Epithel.2,10 IPMN sind die häufigsten makroskopischen Pankreasläsionen, sie betreffen Männer und Frauen ab der 60. Lebensdekade gleich häufig. Sie können nach Lokalisation und histopathologischem Typ unterteilt werden. Diese Klassifikation ist für die Einschätzung des Malignitätsrisikos erforderlich.2 IPMN werden ebenfalls in «Low-grade»- und «High-grade»-Läsionen unterteilt.4
Hauptgang-IPMN entstehen im D. Wirsungianus und sind meistens im Pankreaskopf lokalisiert. Sie können sich im Verlauf in die Seitengänge ausbreiten. Wenn die Seitengangbeteiligung makroskopisch und/oder in der Bildgebung zu sehen ist, werden sie als Mischtyp-IPMN klassifiziert.2 Fast 40% der Hauptgang-IPMN zeigen zum Zeitpunkt ihrer chirurgischen Resektion eine invasive Komponente.17
Seitengang-IPMN sind in den peripheren Pankreasgängen im Pankreaskopf und bevorzugt im Processus uncinatus zu finden. Sie sind typischerweise als Zufallsbefund diagnostiziert und entarten selten.18,19
Auf histologischer Ebene kann man IPMN anhand der Morphologie und des immunhistochemischen Profils in drei Subtypen unterteilen: intestinal, pankreatobiliär und gastral (Tab. 1; Abb. 1, G–L).
Tab. 2: Übersicht über die wichtigsten Genalterationen in Vorläuferläsionen des pankreatischen duktalen Adenokarzinoms (PDAC)15,28–30
Abb. 1: Morphologie und immunhistochemische Markerexpression der häufigsten Vorläuferläsionen des Pankreaskarzinoms. PanIN (A, D) sind durch ein hochprismatisches, muzinreiches Epithel und einen gastralen Phänotyp mit Positivität für MUC5AC (B, E) und MUC6 (C, F) charakterisiert. «Low-grade»-PanIN (A) zeigen eine regelmässige Architektur mit einem flachen bis mikropapillären Epithel und basal gelegenen, kleinen Kernen. «High-grade»-PanIN (D) zeigen Ausknospungen, kribriforme Strukturen und verschiedene zelluläre Atypien, wie Zellpolaritätsverlust, vergrösserte, hyperchromatische Zellkerne mit prominenten Nukleolen und eine erhöhte Mitoserate. IPMN vom gastrischen Typ (G) zeigen ebenfalls einen gastralen Phänotyp mit einem hochprismatischen, muzinbildenden Epithel, welches für MUC5AC (H) und MUC6 (I) positiv ist. Dagegen zeigen intestinale IPMN (J) erhebliche Unterschiede sowohl in der Morphologie als auch in der Expression von immunhistochemischen Markern: Histopathologisch bestehen sie aus papillär-villösen Strukturen, welche Dickdarmadenomen ähneln und für intestinale Marker wie MUC2 (K) und CDX2 (L) positiv sind. MCN (M) sind auch durch ein muzinreiches Zylinderepithel charakterisiert, aber unterscheiden sich histopathologisch durch ein zellreiches „ovarian-like“ Stroma, welches für Östrogen (N) und Progesteron (O) positiv ist. 10-fache Vergrösserung, die Massstabsleiste beträgt 100 μm
Intestinale IPMN
Intestinale IPMN sind meistens im Pankreashauptgang zu finden.17KRAS-Mutationen sind bei dieser IPMN häufig, jedoch kommen Mutationen von GNAS («guanine nucleotide binding protein alpha stimulating») am häufigsten vor (>80% der Fälle).3,20,21 Intestinale IPMN zeigen oft eine invasive Komponente in Form des muzinösen Subtyps des PDAC, welcher eine bessere Prognose als das klassische PDAC aufweist.17
Pankreatobiliäre IPMN
Pankreatobiliäre IPMN sind ebenfalls i.d.R im Hauptgang zu finden, machen jedoch <10% der IPMN aus. Molekulargenetisch kommen Mutationen von KRAS (60–70%) und RNF43 («ring finger protein 43») vor, während GNAS-Mutationen eine eher untergeordnete Rolle spielen.3,20,21 Pankreatobiliäre IPMN sind nahezu immer «High-grade»-Läsionen und zeigen in 50% der Fälle zum Diagnosezeitpunkt eine invasive Komponente mit dem Bild eines klassischen PDAC.2
Gastrale IPMN
Gastrale IPMN kommen am häufigsten vor und sind meist in den Seitengängen im Pankreaskopf lokalisiert.2KRAS- und GNAS-Mutationen sind häufig.20,21 Gastrale IPMN entarten selten in Form eines klassischen PDAC.10 Da gastrale IPMN von PanIN nur aufgrund ihrer Grösse unterschieden werden, kann die Klassifizierung von Läsionen mit gastraler Differenzierung, die zwischen 5mm und 1cm gross sind, herausfordernd sein. Eine Möglichkeit, diese Läsionen zu unterscheiden, ist ihre Molekularanalyse: Während GNAS-Mutationen sehr selten in PanIN zu finden sind, sind sie in IPMN häufig.4
Es konnte gezeigt werden, dass gastrale IPMN und PanIN ein sehr ähnliches Methylierungsmuster und Genexpressionsprofil aufweisen, wohingegen intestinale IPMN sich davon eindeutig unterscheiden. Dies weist auf eine unterschiedliche zelluläre Herkunft bzw. Zellidentität der Läsionen und möglicherweise auf eine unterschiedliche Pathogenese hin.
Unterschiede zwischen gastralen IPMN und PanIN betreffen hingegen Chromosomenaberrationen (häufiger in gastralen IPMN) sowie die Expression des Markers MUCL3, dessen fehlende Expression die Diagnose einer gastralen IPMN praktisch ausschliesst.22
Intraduktale onkozytär-papilläre Neoplasien
Intraduktale onkozytär-papilläre Neoplasien (IOPN) sind seltene intraduktale Neoplasien, die zunächst als onkozytäre IPMN klassifiziert wurden. Heutzutage werden sie wegen molekularer und prognostischer Unterschiede als separate Entität betrachtet.10
KRAS- oder GNAS-Mutationen kommen nicht vor, stattdessen sind Mutationen des ARHGAP26 («Rho GTPase Activating Protein 26»), ASXL1 («ASXL transcriptional regulator 1»), EPHA8 («EPH receptor A8») und ERBB4 («Erb-B2 receptor tyrosine kinase 4») sowie Fusionen von PRKACA («protein kinase CAMP-activated catalytic subunit alpha») und PRKACB («protein kinase CAMP-activated catalytic subunit beta») zu finden.23,24
Auch wenn 30% der IOPN zum Diagnosezeitpunkt eine invasive Komponente mit ebenfalls onkozytischer Morphologie zeigen, beträgt die 5-Jahres-Überlebensrate (5-JÜR) nach Resektion >90%.25
Intraduktale tubulopapilläre Neoplasien
Intraduktale tubulopapilläre Neoplasien (ITPN) sind ebenfalls seltene intraduktale Neoplasien, die durch Amplifikationen von MCL («MCL1 apoptosis regulator, BCL2 family member»), Fusionen von FGFR2 («fibroblast growth factor receptor 2») und Mutationen von CDKN2A und PI3KCA («phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha») charakterisiert sind.26KRAS- und GNAS-Mutationen kommen bei ITPN nicht bzw. nur selten vor. Die meisten ITPN-Fälle haben zum Diagnosezeitpunkt eine invasive Komponente, aber die Prognose nach Resektion ist günstig, mit einer 5-JÜR von 80%.27
Muzinös-zystische Neoplasien
Muzinös-zystische Neoplasien (MCN) sind zystische Tumoren, die sich überwiegend im Pankreasschwanz befinden und nicht mit dem Gangsystem des Pankreas verbunden sind (Abb. 1, M-O). KRAS-Mutationen sind oft zu finden, GNAS-Mutationen kommen im Gegensatz dazu quasi nicht vor.2
MCN kommen nahezu ausschliesslich bei Frauen vor (Durchschnittsalter: 48 Jahre). In 12% der Fälle kann man bereits eine invasive Komponente finden, trotzdem ist die Prognose nach Resektion günstig, mit einer 5-JÜR von 57%.2
Praktischer Nutzen molekularer Marker
Die Identifizierung und Charakterisierung von Vorläuferläsionen des Pankreaskrebses zur Früherkennung und Bestimmung des Progressionsrisikos sind essenziell und in den meisten Fällen mittels Kombination von Histomorphologie, Immunhistochemie und ggf. molekularen Untersuchungsergebnissen gut möglich.
Dennoch besteht aktuell der Bedarf, molekulare Marker zu identifizieren, die eine sichere Erkennung von «High-grade»-Läsionen erlauben. Mutationen von Genen wie PIK3CA, TP53, CDKN2A und SMAD4 weisen auf eine hochgradige Dysplasie hin und sind hochspezifisch, jedoch sind diese Alterationen auch in «High-grade»-Läsionen selten und somit beschränkt sensitiv (Tab. 2). Aufgrund einer negativen NGS-Sequenzierung sollte daher eine «High-grade»-Dysplasie nicht ausgeschlossen werden.15
In Tabelle 2 sind die wichtigsten molekularen Marker zusammengefasst. Diese können bei entsprechend raschem Versand an unfixierter zellfreier Zystenflüssigkeit bestimmt werden, wobei in diesen Fällen eventuell vorhandene Zellen abzentrifugiert und der konventionellen zytologischen Begutachtung zugeführt werden können.
Alternativ kann die molekularpathologische Untersuchung aber auch nachträglich an bereits fixierten Ausstrichpräparaten oder histologischen Präparaten bestimmt werden, um die Klassifikation makroskopischer PDAC-Vorläuferläsionen zu unterstützen. Inkludiert sind in Tabelle 2 auch weitere zystische Tumoren des Pankreas, gegenüber denen die PDAC-Vorläuferläsionen ggf. abgegrenzt werden müssen.
Literatur:
1 Singhi AD et al.: Early detection of pancreatic cancer: opportunities and challenges. Gastroenterology 2019; 156(7): 2024-40 2 Esposito I et al.: Classification and malignant potential of pancreatic cystic tumors. Pathologe 2015; 36(1): 99-112 3 Esposito I et al.: Intraductal neoplasms of the pancreas. Pathologe 2021; 42(5): 472-83 4 Basturk O et al.: A revised classification system and recommendations from the Baltimore Consensus Meeting for Neoplastic Precursor Lesions in the Pancreas. Am J Surg Pathol 2015; 39(12): 1730-41 5 Kanda M et al.: Presence of somatic mutations in most early-stage pancreatic intraepithelial neoplasia. Gastroenterology 2012; 142(4): 730-33 6 Hosoda W et al.: Genetic analyses of isolated high-grade pancreatic intraepithelial neoplasia (HG-PanIN) reveal paucity of alterations in TP53 and SMAD4. JPathol 2017; 242(1): 16-23 7 Andea A et al.: Clinicopathological correlates of pancreatic intraepithelial neoplasia: acomparative analysis of 82 cases with and 152 cases without pancreatic ductal adenocarcinoma. Mod Pathol 2003; 16(10): 996-1006 8 Esposito I et al.: Hypothetical progression model of pancreatic cancer with origin in the centroacinar-acinar compartment. Pancreas 2007; 35(3): 212-7 9 Bartsch DK et al.: Multiple small «imaging» branch-duct type intraductal papillary mucinous neoplasms (IPMNs) in familial pancreatic cancer: indicator for concomitant high grade pancreatic intraepithelial neoplasia? Fam Cancer 2013; 12(1): 89-96 10 WHO: Classification of Tumours. Digestive system tumours. 5. Auflage. Lyon: IARC, 2019 11 Matthaei H et al.: Presence of pancreatic intraepithelial neoplasia in the pancreatic transection margin does not influence outcome in patients with R0 resected pancreatic cancer. Ann Surg Oncol 2011; 18(12): 3493-9 12 De Oliveira PB et al.: Prevalence of incidental pancreatic cysts on 3 tesla magnetic resonance. PLoS One 2015; 10(3): e0121317 13 Lee KS et al.: Prevalence of incidental pancreatic cysts in the adult population on MR imaging. Am J Gastroenterol 2010; 105(9): 2079-84 14 Honselmann KC et al.: Cystic lesions of the pancreas-is radical surgery really warranted? Langenbecks Arch Surg 2016; 401(4): 449-56 15 Haeberle L et al.: Molecular analysis of cyst fluids improves the diagnostic accuracy of pre-operative assessment of pancreatic cystic lesions. Sci Rep 2021; 11(1): 2901 16 Haberle L et al.: Preoperative diagnostics of pancreatic neoplasms. Pathologe 2021; 42(5): 491-500 17 Marchegiani G et al.: IPMN involving the main pancreatic duct: biology, epidemiology, and long-term outcomes following resection. Ann Surg 2015; 261(5): 976-83 18 Oyama H et al.: Long-term risk of malignancy in branch-duct intraductal papillary mucinous neoplasms. Gastroenterology 2020; 158(1): 226-37 19 Marchegiani G et al.: Patterns of recurrence after resection of IPMN: who, when, and how? Ann Surg 2015; 262(6): 1108-14 20 Tan MC et al.: GNAS and KRAS mutations define separate progression pathways in intraductal papillary mucinous neoplasm-associated carcinoma. J Am Coll Surg 2015; 220(5): 845-54 21 Amato E et al.: Targeted next-generation sequencing of cancer genes dissects the molecular profiles of intraductal papillary neoplasms of the pancreas. J Pathol 2014; 233(3): 217-27 22 Liffers ST et al.: Molecular heterogeneity and commonalities in pancreatic cancer precursors with gastric and intestinal phenotype. Gut 2022 23 Wang T et al.: Intraductal oncocytic papillary neoplasms: clinical-pathologic characterization of 24 cases, with an emphasis on associated invasive carcinomas. Am J Surg Pathol 2019; 43(5): 656-61 24 Singhi AD et al.: Recurrent rearrangements in PRKACA and PRKACB in intraductal oncocytic papillary neoplasms of the pancreas and bile duct. Gastroenterology 2020; 158(3): 573-82 25 Marchegiani G et al.: Oncocytic-type intraductal papillary mucinous neoplasms: a unique malignant pancreatic tumor with good long-term prognosis. JAm Coll Surg 2015; 220(5): 839-44 26 Paolino G et al.: Intraductal tubulopapillary neoplasm (ITPN) of the pancreas: a distinct entity among pancreatic tumors. Histopathology 2022; 81(3): 297-309 27 Kuan LL et al.: Intraductal tubulopapillary neoplasm of the pancreas and bile duct: a review. Pancreas 2020; 49(4): 498-502 28 Rosenbaum MW et al.: Next-generation sequencing adds value to the preoperative diagnosis of pancreatic cysts. Cancer Cytopathol 2017; 125(1): 41-7 29 Springer S et al.: A multimodality test to guide the management of patients with a pancreatic cyst. Sci Transl Med 2019; 11(501): eaav4772 30 Singhi AD et al.: Preoperative next-generation sequencing of pancreatic cyst fluid is highly accurate in cyst classification and detection of advanced neoplasia. Gut 2018; 67(12): 2131-41 31 Mattiolo P et al.: CD117 is a specific marker of intraductal papillary mucinous neoplasms (IPMN) of the pancreas, oncocytic subtype. Int J Mol Sci 2020; 21(16): 5794
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...