Gelenk-am-Chip als Alternative zu Arthrose-Tiermodellen?
Autoren:
Dr. Mario Rothbauer, MSc
Assoz- Prof. Dr. Stefan Tögel
Univ.-Prof. Dr. Reinhard Windhager
Universitätsklinik für Orthopädie und Unfallchirurgie
Karl Chiari Lab for Orthopaedic Biology Medizinische Universität Wien
Korrespondierender Autor:
Dr. Mario Rothbauer, MSc
E-Mail: mario.rothbauer@meduniwien.ac.at
Um tiefere Einblicke in die molekularen und zellulären Hintergründe von Arthrosen zu ermöglichen, werden seit Kurzem Gelenke-am-Chip als technologische Neuankömmlinge und potenzielle Alternativmethoden zu Arthrose-Tiermodellen im Repertoire der dreidimensionalen In-vitro-Zellkulturtechniken diskutiert. Wir versprechen uns dadurch bessere und mechanistischere Einsichten in frühe Krankheitsprozesse.
Keypoints
-
Gelenke-am-Chip als humane Krankheitsmodelle sollen die Problematik der Speziesunterschiede im Tiermodell verhindern und bessere translative Ergebnisse zur Erforschung neuer Medikamente ermöglichen.
-
Die Komplexität der Sekundärgewebe als „Mittäter“ in der Arthroseentstehung kann durch Multigewebemodelle simuliert werden.
-
Die Applikation von mechanischen Stimuli wie im echten Gelenk kann dazu beitragen, wichtige Fragen bezüglich molekularer Mechanismen hinter schützender Gewebehomöostase und entzündlicher Überbeanspruchung zu beantworten.
-
Ob Gelenke-am-Chip langfristig Arthrosemodelle im Kleintier als Alternativmethode gänzlich ersetzen werden, wird die Zukunft zeigen. Im Sinne der Ressourcenschonung und Nachhaltigkeit wird diese neue Technologie durch rezente EU-Direktiven jedenfalls einen signifikanten Einfluss auf die Anzahl der in der Grundlagenforschung verwendeten Tierversuche – unter anderem auch in der Orthopädieforschung – haben.
Durch den Verlust der Beweglichkeit und Lebensqualität stellen Gelenkarthrosen für fast eine halbe Milliarde Menschen weltweit ein zunehmendes Problem im Alltag dar, welches sich durch nahezu alle Altersgruppen Erwachsener zieht.1–4 Kniegelenkarthrosen sind eine der häufigsten Formen, die bedingt durch den komplexen Aufbau des Kniegelenks neben Knorpel auch verschiedenste andere Gewebe des Kniegelenks wie zum Beispiel subchondralen Knochen, die Menisken, das Synovium, als auch Muskeln, Bänder, Sehnen und Fettgewebe betreffen können.3, 5, 6 Durch die multifaktorielle Ätiologie bleibt sowohl der genaue Ablauf der Pathogenese als auch der Zeitpunkt der Krankheitsentstehung in vielen Fällen unklar. Um tiefere Einblicke in die molekularen und zellulären Hintergründe von Arthrosen zu ermöglichen, werden seit Kurzem Gelenke-am-Chip als technologische Neuankömmlinge und potenzielle Alternativmethoden zu Arthrose-Tiermodellen im Repertoire der dreidimensionalen In-vitro-Zellkulturtechniken diskutiert, um die komplexen Krankheitsbedingungen von Kniegelenkgeweben mit menschlichen Primärzellen nachzuahmen. Wir versprechen uns dadurch bessere und mechanistischere Einsichten in besonders frühe Krankheitsprozesse zwischen molekularer Entzündungsantwort und mechanischer Überbeanspruchung von Geweben als Startpunkt des offensichtlich progressiven Gelenkverschleißes zu gewinnen.
Arthrose ist mehr als nur eine Erkrankung des Gelenkknorpels
Arthrose ist nach wie vor die häufigste progressive Erkrankung des Bewegungsapparates mit der höchsten Prävalenz bei Kniegelenken (Kniearthrose, kOA).2 Sozioökonomisch betrachten wir Gelenkarthrosen noch kritischer, da die notorisch unterfinanzierten nationalen Gesundheitssysteme jährlich mit Milliardenlasten konfrontiert werden, da Arthrose circa 7% der Weltbevölkerung betrifft und für rund 3% der globalen gelebten Gesamtjahre mit Beeinträchtigung („years lived with disability“, YLDs) verantwortlich ist, was eine der Hauptursachen für Behinderungen bei älteren Erwachsenen darstellt. Durch global zunehmende Fettleibigkeit werden sich diese Trends besonders für Gon- und Coxarthrosen in den kommenden Jahrzehnten weiter verstärken (Normalgewicht: 20% Prävalenz; Adipositas: 40% Prävalenz) und zu noch höherer arthrosebedingter Morbidität und Mortalität führen. Primäre Zielgewebe der molekularen Kniearthroseforschung sind vor allem Knorpel und Knochen, da diese maßgeblich an der mechanischen Beeinträchtigung sowie dem akuten Schmerzentstehen beteiligt sind. Bei fibrösem Gewebe, wie z.B. Bändern, Sehnen, Menisken, Synovium und Fettkörpern, fehlt noch viel Wissen über die Zusammenhänge zwischen früher Pathogenese und Gelenkdegeneration (z.B. Beteiligung und Ursachen). Als Erkrankung des gesamten Kniegelenks betrifft Arthrose trotzdem alle Kniegewebe3, 5 und kann verschiedenste degenerative Gewebeabnormitäten durch biomechanische Anomalien, Gelenkverschiebungen und degenerative Prozesse hervorrufen. In frühen Stadien kann zum Schmerzmanagement vor allem konservativ therapiert werden, die Gelenkendoprothetik ist der Goldstandard für Spätstadien. Das Hauptproblem liegt vor allem darin, dass die wissenschaftlichen Hintergründe zu vielversprechenden neuen Therapieansätzen unklar sind und noch immer zu wenig über die frühen Stadien des Krankheitsverlaufs bekannt ist, welche prädestiniert wären für neue konservative Therapieansätze.
Im Krankheitsverlauf ist der Zusammenhang zwischen progressiver Knorpeldegeneration, Knochenstrukturveränderungen und Entzündung von Synovium und Fett sehr deutlich zu erkennen. Allesamt stellen Krankheitsphänomene dar, die in der Literatur als gut diskutierte, aber wenig angewandte Diagnostikwerkzeuge den Klinikalltag erleichtern könnten. Sobald es zu Gelenkveränderungen kommt, ist die primäre Frage nicht, ob, sondern wann Gelenkarthrose entsteht. Dass der direkte Einfluss der unterschiedlichen Gewebeveränderungen zu erhöhter Arthrosewahrscheinlichkeit führt, ist schwer zu übersehen. Menschen mit asymptomatischen degenerativen Meniskopathien zeigen zum Beispiel ein um 60% höheres Risiko, an einer tibiofemoralen Arthrose zu erkranken. An Adipositas erkrankte Patienten zeigen neben der offensichtlichen mechanischen Mehrbeanspruchung der Gelenke auch signifikant erhöhte Entzündungsmediatoren, die von Fettgewebe und auch vom Synovium als entzündliches Gewebe stetig ausgeschüttet werden.7 Insbesondere der infrapatellare Fettkörper kann auch akut und lokal eine Masse an bioaktiven Stoffen, wie z.B. Zytokinen, Adipokinen und Wachstumsfaktoren, ins Gelenk ausschütten und die in Mitleidenschaft geratene Gewebehomöostase weiter negativ beeinflussen.8 Die Tatsache, dass rund ein Zehntel der Kniegelenkprothesepatienten an fibrotischen Veränderungen des infra-patellaren Fettkörpers (Hoffa’scher Fettkörper) leidet, die mit Implantatrevisionen in Zusammenhang gebracht werden können,9 ist alarmierend. Des Weiteren ist der Fettkörper auch bei Kreuzbandrekonstruktionen als weiteres Problemgewebe zu sehen, da fibrotische Veränderungen bei über 90% der Patienten innerhalb von 15Jahren zu Patellararthrosen führen.10, 11
Diese simplen Zusammenhänge verdeutlichen, wie sekundär der Knorpel in seiner offensichtlichen Opferrolle ist, um die Krankheitspathogenese verstehen zu können. Potenzielle neuartige Therapieansätze werden demnach höchstwahrscheinlich nur über die Beforschung der Arthrosepathogenese als feingetaktetes Orchester aus einer Vielzahl von Gelenkgeweben Erfolg zeigen. Leider sind zurzeit die potentesten und vielversprechendsten regenerativen Therapieansätze (z.B. Knorpelbiomaterialien und Zelltherapien) offensichtlich nicht spezifisch genug oder werden zu spät angewandt, um den komplizierten Hintergrund der Arthroseentstehung zu ändern. Folglich sind sie zumindest bis dato als Symptombehandlung zu betrachten, weil sie aus materialtechnischer Sicht zu instabil sind, um den pathogenen biochemischen und biomechanischen Belastungen widerstehen zu können.
Wie können Gelenke-am-Chip als „game changer“ in der Arthroseforschung fungieren?
Seit Jahrzehnten werden In-vivo- und In-vitro-Gelenkmodelle entwickelt und verwendet, um ein tieferes Verständnis der pathologischen, molekularen und zellulären Prozesse, die das potenzielle Auftreten und Fortschreiten von Gelenkarthrosen begünstigen, zu erzielen. Tiermodelle sind der Goldstandard, um frühe Erkrankungsstadien aus der Sicht eines gesamten Organismus zu modellieren, wobei aber In-vitro-Explantate und dreidimensionale Zellpelletmodelle gut etabliert sind. Um diese Einschränkungen zu überwinden, werden seit über 2Jahrzehnten mithilfe von Mikrofabrikationstechnologien, die aus der Halbleiterindustrie stammen, mikrofluidische Ansätze für die Zellbiologie entwickelt, um Flüssigkeiten in mikrometergroßen Kanälen zu manipulieren. Die eigentlich zur Optimierung und Verbesserung von chemischen Reaktoren entwickelten Mikrokanäle wurden schnell auf zellbasierte Biochips übertragen und zählen zu den höchstentwickelten biomedizinischen Forschungsmodellen für Gewebe und Organe12 mit einer noch nie dagewesenen Kontrolle über das Zellverhalten in vitro.
Zum einen erlauben mikrofluidische Biochips die gewebeähnliche Reproduktion menschlicher physiologischer und pathologischer Prozesse, wie z.B. spezifischer Gewebearchitektur, und die räumliche und zeitliche Kontrolle zellulärer Strukturen und folglich biochemischer Reaktionen und Gradienten einzelner und mehrerer Gewebeanaloge mithilfe von Mikrokanälen. Diese Entwicklungsrichtung hatte vor allem im Orthopädiesektor die Etablierung von dreidimensionalen biomedizinischen Gelenkgewebemodellen von Knorpel,13 Knochen14 und Synovium15–17 zur Folge. Diese Einzelgewebemodelle haben einen signifikanten Beitrag zur Erforschung von direkter und indirekter Zell-Zell-Interaktion geleistet. Hier ist als gutes Beispiel die Studie von Goldman und Barbino18 zu nennen, die mit ihrem bovinen In-vitro-Knorpelmodell den direkten Einfluss der Erhöhung des Organoidvolumens auf eine erhöhte Glykosaminoglykanbiosynthese und Konstruktsteifigkeit feststellten. Weiters zeigten Multigewebemodelle (z.B. Knorpel und Knochen mit Synovium)14, dass Osteoklasten und proinflammatorische Makrophagenaktivität essenziell für die katabolen Gewebeprozesse in der Arthroseentstehung sind und diese weiter ankurbeln können.19 Alternativ zu Primärzellen wurden stammzellbasierte Technologien als gesunde Gewebemodelle entwickelt,20 die vor allem wegen besserer Zelllogistik und Skalierbarkeit vermehrt Anwendung finden.
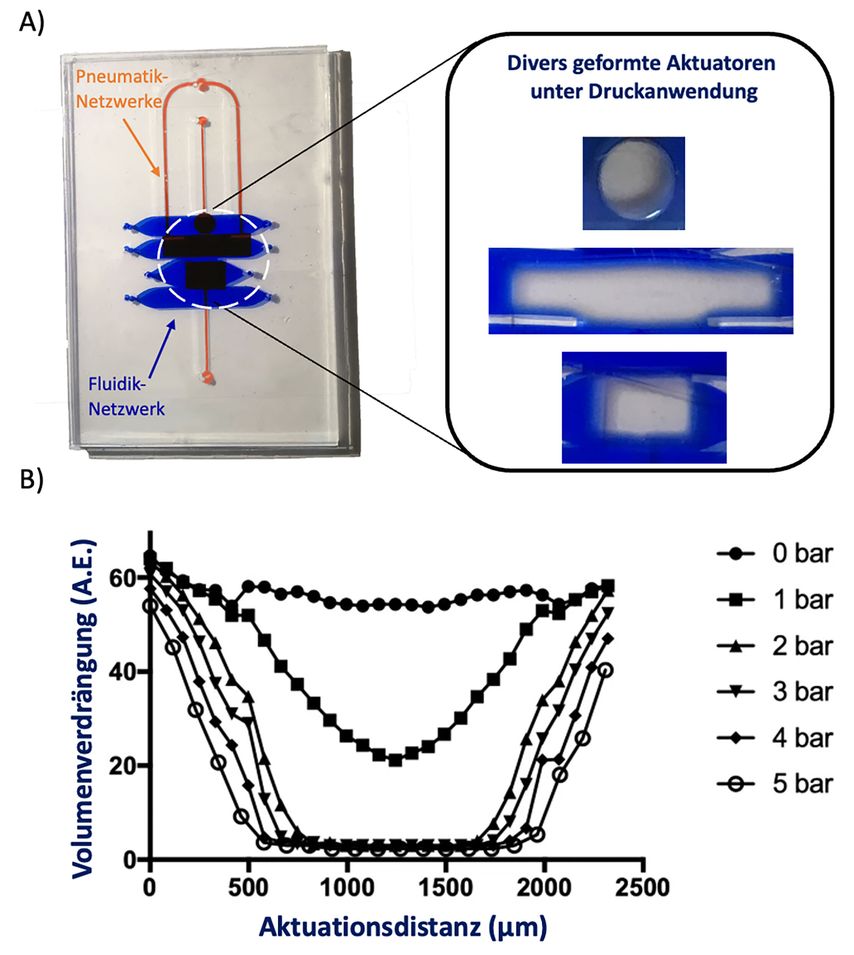
Zum anderen umfassen mikrofluidische Technologien nicht nur Methoden zur Strukturierung einzelner Gewebekompartimente und Flusskontrolle, sondern auch Prinzipien wie z.B. Entgaser und pneumatische Aktuatoren, die vor allem in der Diagnostik und Laborautomatisierung heutzutage Anwendung finden.21–24 Ähnlich wie bei mechanischen Gewebebioreaktoren hat vor allem die pneumatische Verformung von flexiblen Membranen zur zyklischen mechanischen Stimulierung von dreidimensionalen Gewebemodellen mit Zug und Kompression in den letzten 10 Jahren an Bedeutung gewonnen (Abb. 1), um Gelenkgewebe-Biochips noch näher an eine gesunde bzw. kranke mechanische Umgebung anzunähern. Als ersten Schritt haben Lee und Kollegen mit ihrem Mausknorpelbiochip den Einfluss von zunehmenden mechanischen zyklischen und statischen Belastungen auf die Chondrozytenviabilität analysiert.25 Rezentere Biochipstudien haben pneumatische Aktuatorensysteme verwendet, um den Einfluss biomechanischer Kräfte auf Knorpelmodelle weiter auszubauen. Zum Beispiel konnte in einer rezenten Studie eine zelluläre Knorpelüberbelastung von 30% in Zusammenhang mit pathologischem Knorpelkatabolismus und pathologischer Matrixbiosynthese gebracht werden.26 Dass eine biomechanische Knorpelumgebung mehr als nur zyklische Kompression beinhalten kann, haben Paggi und Kollegen mit einem ähnlichen pneumatisch betriebenen Knorpel-Biochip verdeutlicht.27
Abb. 1: A) Beispielchip für pneumatische Stimulierung. B) Druckbasierte Aktuation einer flexiblen integrierten Membran führt zu druckabhängigem Training von chipbasierten Gewebemodellen (adaptiert von Monfared et al., 2020)23
Wie Gelenke-am-Chip an der MedUni Wien einen Beitrag leisten, die Pathogenese von Gelenkkrankheiten besser zu verstehen
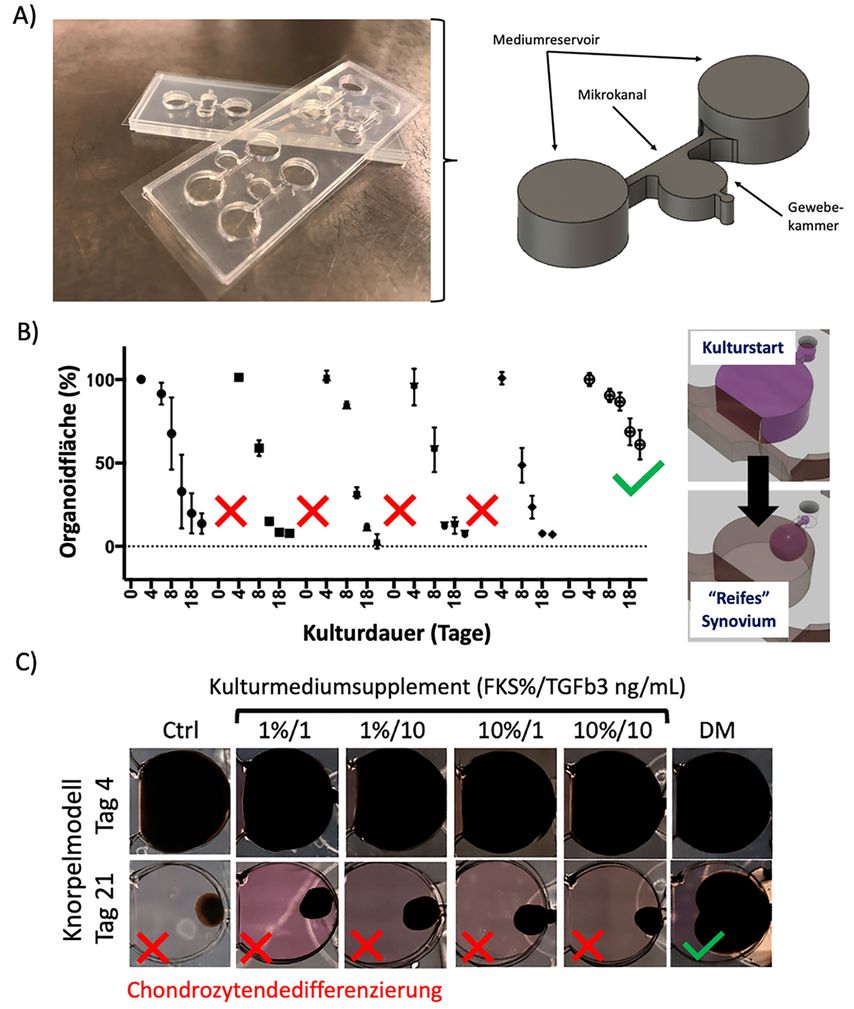
Im „Karl Chiari Lab for Orthopaedic Biology“ (KCLOB) der Universitätsklinik für Orthopädie und Unfallchirurgie der Medizinischen Universität Wien etabliert die Forschungsgruppe „Orthopedic Microsystems“ seit 2019 Biochip-Technologien, um mehr Wissen über die molekularen und strukturellen Dysregulationen verschiedenster Gelenkgewebe mithilfe modernster dreidimensionaler Gewebemodelle zu erforschen. Basierend auf Hydrogel-3D-Kulturen konnten Synoviozyten-Organoide mit mikrofluidischen Biochips (Abb. 2) als Arthritis-Krankheitsmodell weiter verfeinert werden, um zum Beispiel die Präzision und Reproduzierbarkeit der Reifung am Biochip zu erhöhen.28 Die Heranreifung dieser künstlichen Synovialmembranstrukturen konnte durch Integration von optischen Mikrosensoren nichtinvasiv verfolgt werden, um dynamische strukturelle Unterschiede während der Etablierung der Konstrukte zu vermessen. Im Detail konnte durch Mikrosensorik eine stärkere Verdichtung des Gewebemodells durch entzündliche Zell-Zell-Interaktionen und Überproliferation der Synoviozyten (Fibroblasten-artige Zellen der Synovialkapsel)17 demonstriert werden. Beide Phänomene sind Indikatoren für entzündliche Veränderungen von Synovialmembranen, die bei Erkrankungen wie Arthritis und Arthrosen häufig zutreffen. Wegweisende Herausforderung in dieser Studie war, dass der Transfer von bestehenden Gewebemodellen weg von Kulturplatten16, 29 auf den dynamischeren Biochip einiges an Optimierungsschritten benötigt hatte, da ein großer Wert auf die funktionale und strukturelle Vergleichbarkeit in Bezug auf reale Patientengewebe gelegt wurde (z.B. Anschwellen der Synoviozytenintima). Um tiefere Einblicke in die lösliche Zell-Zell-Kommunikation auf Gewebeebene zu gewinnen, wurden diese Grundprinzipien in einer rezenten Folgestudie mit einem gesunden Knorpelmodell kombiniert, um nicht nur die Veränderung der Synovialkapsel, sondern auch potenzielle degenerative Entzündungsprozesse abdecken zu können.30 Einerseits zeigte die Studie, dass Synovialfibroblasten an einer prochondrogenen Umgebung der Chondrozyten beteiligt sind (z.B. Reduktion der Dedifferenzierung von primären Chondrozyten in Absenz von Differenzierungsmedien), andererseits konnte die Studie auch verdeutlichen, dass Multi-Gewebe-Biochips als Screening-Tools einen wichtigen Schritt in der Verbesserung bestehender Krankheitsmodelle, besonders in der Arthritis- und Arthroseforschung darstellen. Im Detail konnte die Studie aufzeigen, dass prochondrogene Zusätze und Differenzierungsmedien für Knorpelkulturen zu fibroseähnlichen katabolen Reaktionen (d.h. Zerfall des synovialen Netzwerks und der ECM-Matrix) in Synoviozytenkonstrukten führen können. Diese potenziellen anabolen und katabolen Wirkungen auf Gewebeebene sind entscheidend, um zukünftig noch komplexere Modelle für Gelenkerkrankungen zu entwickeln. Wenn man die derzeitige wissenschaftliche Übereinkunft, basierend auf molekularen Studien unter Analyse von Patientengeweben, betrachtet,31, 32 ist eindeutig, wie wichtig in der nahen Zukunft komplexere Krankheitsmodelle sein werden, die die fehlgeleitete Gelenkhomöostase aufgrund der Dysregulierung kataboler und anaboler Stoffwechselwege auf Gewebeebene authentisch nachbilden können. Da sich während der entzündlichen Veränderung der Gelenke neben den ausgiebig beforschten Molekülmustern von Interleukinen und Matrixmetalloproteasen auch die strukturelle Gewebefunktion und Zusammensetzung signifikant verändern, sollte und muss in Zukunft auch mehr Nachdruck auf biochemische und mechanobiologische Prozesse gelegt werden (z.B. Molekülinterferenzen, die die Zell-Matrix-Interaktion schädigen, Überempfindlichkeit von Zellpopulationen auf mechanische Überbelastung etc.), die besonders in frühen Krankheitsstadien die Zell- und Gewebestruktur pathologisch beeinflussen und so zum Fortschreiten von Gelenkarthrose beitragen. Ob dieser Technologiesprung schon Tierversuche reduzieren oder ersetzen kann, wird die nahe Zukunft zeigen.
Abb. 2: A) Beispiel für mikrofluidische dreidimensionale Arthrosemodelle, in denen ein Hydrogel-„Gewebe“ mittels Mikrokanal versorgt wird. B, C) Analyse der Organoidfläche als Messparameter der Mikrogewebereifung anhand einer Chondrozytendedifferenzierungsstudie. Chondrozyten-3D-Kulturen wurden am Biochip verschiedensten Zusammensetzungen von Nährlösungen ausgesetzt, um die Chondrozytendedifferenzierung durch Kondensation des Knorpelmodells zu analysieren. FKS = fötales Kälberserum; TGFb3 = Transforming Growth Factor beta 3; DM = kommerzielles Differenzierungsmedium für Chondrozyten (adaptiert und übersetzt von Rothbauer et al., 2021)30
Literatur:
1 Altman R et al.: Arthritis Rheum 1986; 29: 1039-49 2 Vina ER, Kwoh CK: Curr Opin Rheumatol 2018; 30: 160-7 3 Belluzzi E et al.: Biomed Res Int 2019, 2019: 6390182 4 Cui A et al.: EClinicalMedicine 2020; 29-30: 100587 5 Kanbe K et al.: Clin Med Insights Arthritis Musculoskelet Disord 2015; 8: 25-32 6 Sendzik J et al.: Int J Antimicrob Agents 2009: 33: 194-200 7 Berenbaum F et al.: Curr Opin Rheumatol 2013; 25: 114-8 8 Ushiyama T et al.: Ann Rheum Dis 2003; 62: 108-12 9 Abdul N et al.: Sci Rep 2015; 5: 1-13 10 Culvenor AG et al.: Br J Sports Med 2013; 47: 66-70 11Yoon KH et al.: Knee 2017; 24: 310-8 12 Rothbauer M et al.: Micromachines 2021, 12: 470 13 Rosser J et al.: Mater Today Bio 2019; 4: 100023 14 Lin H et al.: Mol Pharm 2014; 11: 2203-12 15 Maracle CX et al.: Rheumatol (Oxford) 2017; 56: 294-302 16 Broeren MGA et al.: ALTEX 2019; 36: 18-28 17 Rothbauer M et al.: Lab Chip 2020; 20: 1461-71 18 Goldman SM, Barabino GA: J Tissue Eng Regen Med 2017; 11: 572-81 19 Ma HP et al.: R Soc Open Sci 2018; 5: 180528 20 O’Donnell BT et al.: Biomolecules 2020; 10: 1070 21 Rothbauer M et al.: Lab Chip 2019; 19: 1916-21 22 Piluso S et al.: Trends Biotechnol 2019; 37: 1063-77 23 Monfared GS et al.: Sci Rep 2020; 10(1): 16192 24 Sticker D et al.: Anal Chem 2017; 89: 2326-33 25 Lee D et al.: Lab Chip 2018; 18: 2077-86 26 Occhetta P et al.: Nat Biomed Eng 2019; 3: 545-57 27 Paggi CA et al.: Sensors Actuators B Chem 2020; 315: 127917 28 Rothbauer M et al.: Lab Chip 2020; 20: 1461-71 29 Kiener HP et al.: Am J Pathol 2006; 168: 1486-99 30 Rothbauer M et al.: Lab Chip 2021; 21: 4128-43 31 Mobasheri A et al.: Nat Rev Rheumatol 2017; 13: 302-11 32 Mobasheri A, Batt M: Ann Phys Rehabil Med 2016; 59: 333-9
Das könnte Sie auch interessieren:
Makrophagen bei rheumatoider Arthritis: Welche Rolle spielen sie?
Makrophagen wurden lange Zeit für die „Schuldigen“ bei der rheumatoiden Arthritis gehalten, da sie die Entzündung vorantreiben. Mithilfe neuerer Analysetechniken wie ...
Auswirkungen von muskuloskelettalen Infektionen auf die psychische Gesundheit
Muskuloskelettale Infektionen sind gefürchtete, schwerwiegende Komplikationen, die zu lebensbedrohlichen Zuständen werden können. Dies bedeutet für die Betroffenen neben den physischen ...
Isthmische Spondylolyse und Spondylo-listhese bei Kindern und Jugendlichen
Die isthmische Spondylolyse beschreibt eine Ermüdungsfraktur imBereich der Pars interarticularis. Neben genetischen Faktoren scheinen repetitive mechanische (Über-)Belastungen ...