Maladies induites par un inhibiteur de point de contrôle immunitaire
Compte-rendu:
Dr Andreas Billich
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le traitement par des inhibiteurs de point de contrôle immunitaire (ICI) peut prolonger la survie des patient·es atteint·es de tumeurs, mais les effets secondaires auto-immuns sont fréquents. Cette problématique, et en particulier la prise en charge des complications gastro-intestinales, a été abordée lors d’une formation continue organisée par la Société autrichienne de gastroentérologie et d’hépatologie.
Les maladies induites par les ICI peuvent affecter n’importe quel système d’organes. Pour les gastroentérologues, ces effets indésirables (EI) à médiation immunitaire de l’ICI sont particulièrement importants, car les complications fréquentes touchent le tractus gastro-intestinal (GI) (indépendamment de la localisation de la tumeur). En outre, les ICI sont également utilisés dans l’immunothérapie (ITx) des tumeurs GI; ils sont autorisés pour le traitement des maladies tumorales du tractus GI luminal et du foie, p.ex. dans des constellations particulières de carcinomes épidermoïdes ou adénocarcinomes de l’œsophage ou de l’estomac, dans le cancer colorectal avec instabilité microsatellitaire élevée ainsi que dans le carcinome hépatocellulaire et cholangiocellulaire.
Mécanismes des effets et des EI
Les ICI activent les défenses antitumorales en bloquant les interactions anti-inflammatoires entre les lymphocytes T et les cellules présentatrices d’antigènes ou les cellules tumorales. Les exemples les plus marquants sont les anticorps monoclonaux de type IgG dirigés contre les récepteurs CTLA-4 et PD-1 sur les lymphocytes T et contre PD-L1, qui est fortement exprimé par les cellules tumorales.
Les mécanismes des effets auto-immuns indésirables des ICI comprennent l’activation des lymphocytes T autoréactifs avec infiltration de l’organe correspondant, la dérégulation des lymphocytes B avec formation d’anticorps à réaction croisée, la toxicité directe et la production accrue de cytokines et de chimiokines pro-inflammatoires.1 Les interactions avec le microbiome et les variantes génétiques jouent également un rôle. En raison de la multiplicité des facteurs d’influence, l’auto-immunité, l’inflammation et les lésions tissulaires varient d’un·e patient·e à l’autre lors du traitement par ICI.
Complications lors du traitement par ICI
Le traitement par ICI peut faire apparaître de nouvelles maladies auto-immunes et démasquer des maladies subcliniques préexistantes. Sur le plan clinique, on observe alors des événements indésirables liés au système immunitaire ainsi que des poussées de maladies auto-immunes existantes et une augmentation de l’apparition de symptômes paranéoplasiques.
Les EI cutanés du traitement par ICI sont les plus fréquents (démangeaisons, éruptions maculopapuleuses, apparition d’un lichen plan ou d’un vitiligo, voire de maladies graves comme la réaction médicamenteuse avec éosinophilie et symptômes systémiques [DRESS] et le syndrome de Stevens-Johnson). Les complications GI (principalement colite et hépatite) et les endocrinopathies (p.ex. thyroïdite, hypophysite) sont fréquentes. On observe également des EI neurologiques (touchant généralement le système nerveux périphérique) ainsi que des EI rhumatologiques (arthrites, touchant généralement les grandes articulations), des microangiopathies thrombotiques, des vascularites et des pneumonies. Les complications cardiaques sont rares.
La fréquence des EI dépend de la dose, surtout avec les inhibiteurs de CTLA-4. Les combinaisons d’inhibiteurs de PD-1 et de CTLA-4 ont des taux d’EI supérieurs. Les EI de grade I/II surviennent dans jusqu’à 70% des cas avec les anticorps anti-CTLA-4 et dans 50 à 60% des cas avec les inhibiteurs de l’axe PD-1; les EI de grade III/IV sont également plus fréquents (20%) avec les inhibiteurs de CTLA-4 qu’avec les inhibiteurs de PD-1/PD-L1 (5–10%). La prévalence des effets indésirables ayant une issue fatale est <1%. Les EI auto-immuns apparaissent typiquement de 6 à 12 semaines après le début du traitement, mais dans certains cas, les EI ne se sont manifestés qu’un an après l’arrêt du traitement.
Traitement des effets indésirables immunologiques des ICI
Le traitement peut s’appuyer sur les directives de l’ESMO correspondantes, mises à jour en 2022.2 Après le diagnostic et la gradation des EI ainsi que l’exclusion des diagnostics différentiels sont suivis, une immunosuppression adéquate est choisie en cas d’EI de grade ≥2. L’efficacité de l’immunosuppression doit être évaluée après trois jours afin d’adapter le traitement si nécessaire.
Il n’existe pas d’études prospectives sur l’efficacité des médicaments en cas d’EI immunitaires des ICI, mais les glucocorticoïdes sont recommandés en première ligne. S’ils ne sont pas suffisamment efficaces, des médicaments biologiques (p.ex. anticorps anti-TNF-α, CD20 et interleukines pro-inflammatoires) peuvent être utilisés en deuxième ligne. Le recours à d’autres immunosuppresseurs (p.ex. mycophénolate-mofétil [MMF], tacrolimus, ciclosporine, cyclophosphamide, méthotrexate, inhibiteurs de JAK) peut également être envisagé.
Les directives de l’ESMO proposent des algorithmes détaillés pour la prise en charge des différents EI liés aux ICI avec ces options thérapeutiques.2
La plupart du temps, les toxicités des ICI sont facilement traitables, comme l’illustrent une série d’exemples de cas (voir encadré).
Diarrhée et colite liées aux ICI
La diarrhée et l’entérocolite sont les complications les plus fréquentes des ICI dans le tractus GI. La fréquence est nettement plus élevée en cas de traitement par inhibiteurs de CTLA-4 (jusqu’à 35%) qu’avec des inhibiteurs de l’axe PD-1 (jusqu’à 10%).
Les symptômes de ces EI sont connus: diarrhée, douleurs abdominales, fièvre, perte de poids, modifications électrolytiques, etc. Du point de vue du diagnostic différentiel, la colite liée aux ICI doit être distinguée des colites infectieuses, des maladies inflammatoires chroniques de l’intestin (MICI), de la colite ischémique, des colites provoquées par des médicaments (p.ex. AINS) et de la diverticulite. Le diagnostic doit inclure des coprocultures (y compris à la recherche de Clostridium difficile) ainsi que la détection du CMV dans le sang et, le cas échéant, dans une biopsie de muqueuse. L’imagerie est très peu sensible et est peu utile dans le diagnostic; elle n’est de mise qu’en cas de colite sévère afin d’exclure les complications comme la perforation du côlon, les abcès et le mégacôlon. Une endoscopie doit être réalisée en présence d’un EI de grade 2 et plus; on peut y observer des rougeurs, des érosions, des ulcérations, des saignements et une granularité de la muqueuse en cas de colite induite par les ICI. L’histologie montre, en cas d’atteinte légère, un épaississement de la lamina propria avec migration de cellules inflammatoires et accumulation de lymphocytes intraépithéliaux. En cas d’inflammation sévère, s’y ajoutent une cryptite et des abcès de la crypte et, finalement, des ulcérations. Par rapport à la MICI, les troubles de l’architecture en cryptes sont rares.
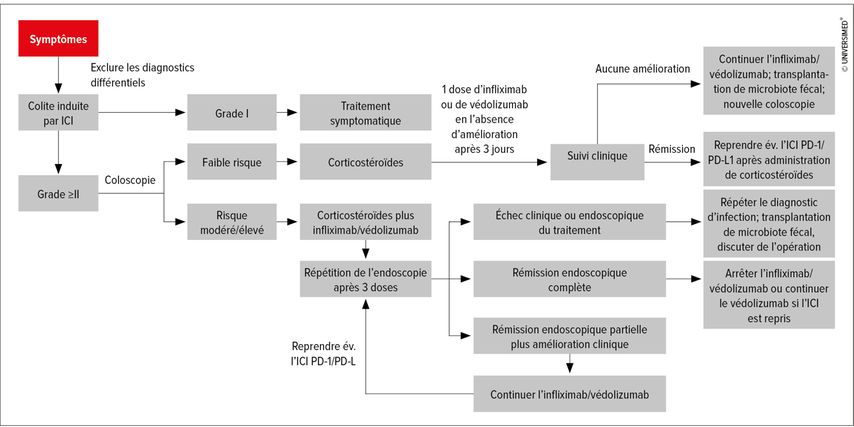
Un algorithme thérapeutique, qui semble particulièrement utile aux gastroentérologues cliniques, a été publié en 2020 (Fig. 1).3 Selon cet algorithme, la colite de grade 1 liée aux ICI est traitée de manière symptomatique (régime pauvre en fibres et év. lopéramide). À partir du grade 2, des immunosuppresseurs doivent être utilisés. Les patient·es à faible risque reçoivent d’abord des corticostéroïdes; en l’absence d’amélioration, il est possible d’augmenter la dose ou de passer à un anticorps anti-TNF (infliximab) ou anti-intégrine α4β7 (védolizumab). En cas d’atteinte sévère (p.ex. ulcérations profondes et de grande taille ou atteinte au-dessus du côlon gauche), il convient de commencer par un traitement associant un corticostéroïde et l’infliximab; après trois jours, il faut évaluer le succès du traitement afin d’adapter la dose si nécessaire ou de passer à une troisième ligne. En troisième ligne, on dispose entre autres de la transplantation de microbiote fécal, des inhibiteurs de JAK, de l’ustékinumab, de la ciclosporine et des inhibiteurs de la calcineurine.
Fig. 1: Algorithme de prise en charge de la diarrhée et de la colite induites par ICI (modifié d’après Gong Z, Wang Y, 2020)3
Environ la moitié des patient·es réagissent très bien aux corticostéroïdes en première ligne. Pour ceux qui ne répondent pas suffisamment, une amélioration est souvent observée avec les anti-TNF. Seuls environ 10% des patient·es ont besoin d’un traitement de troisième ligne.
Une deuxième forme de colite pouvant être déclenchée par les ICI est la colite microscopique avec les sous-formes de colite lymphocytaire et collagène, pour lesquelles l’endoscopie ne montre généralement qu’une atteinte légère avec un gonflement de la muqueuse et une rougeur diffuse. Le principal symptôme des deux formes est la diarrhée aqueuse. Dans la colite lymphocytaire, on observe histologiquement une infiltration de la lamina propria par des lymphocytes intraépithéliaux, et dans la colite collagène, un épaississement discontinu de la bande de collagène. Ici aussi, le traitement repose en premier lieu sur un corticostéroïde (p.ex. budésonide pendant 12 semaines).
Hépatite induite par les ICI
Une hépatite apparaît dans 5 à 10% des cas de traitement par ICI. L’hépatite liée aux ICI est difficile à distinguer histologiquement d’une hépatite auto-immune. La plupart du temps, les patient·es ont peu de plaintes, mais les transaminases sont élevées et doivent donc être contrôlées à chaque cycle de traitement par ICI. Rarement, on observe un ictère, de la fièvre, des nausées ou un manque d’appétit. Les patient·es recevant un traitement par ICI pour un carcinome hépatocellulaire sont plus susceptibles d’avoir une hépatite comme EI.
Si une hépatite induite par l’ICI est diagnostiquée, le traitement par ICI doit être interrompu. Le traitement des hépatites de grade II repose sur les glucocorticoïdes oraux; à partir du grade III, la dose est augmentée et une administration IV est envisagée. En deuxième ligne, on dispose p.ex. du MMF, des inhibiteurs de l’IL-6 et de la calcineurine ainsi que de l’azathioprine.
Reprise de l’ICI après une maladie induite par ICI?
En principe, un nouveau traitement par ICI peut être administré après une maladie induite par ICI précédemment traitée. Cependant, dans 50% des cas, des EI à médiation immunitaire réapparaîtront. On peut essayer de réduire le risque d’EI, par exemple en n’administrant qu’un seul composant au lieu d’un traitement d’association par ICI ou en changeant de classe d’ICI (inhibiteur de PD-1 au lieu de CTLA-4 ou inversement); une immunosuppression à faible dose en plus du traitement par ICI est également discutée dans certains cas.
Cas 1 – Colite associée aux ICI
Un mélanome au sein gauche a été diagnostiqué chez un patient de sexe masculin âgé de 65 ans en avril 2022. Après exérèse primaire de la tumeur, un traitement adjuvant par inhibiteurs de la tyrosine kinase a été initié, mais il a dû être interrompu après deux mois pour des raisons de tolérabilité, après quoi le traitement a été remplacé par le nivolumab. Après l’apparition de métastases cérébrales en octobre 2022, une ITx combinant ipilimumab et nivolumab associée à une radiothérapie stéréotaxique ont été amorcées. Après deux cycles seulement, une colite sévère associée aux ICI est apparue, avec jusqu’à douze selles aqueuses et sanglantes par jour et un état général réduit. La coloscopie a révélé une pancolite marquée avec des ulcérations. L’ITx interrompue. Une corticothérapie associée à l’infliximab à raison d’une dose de fond de 5mg/kg de PC n’a pas entraîné une réponse suffisante; seule une escalade de la dose à 10mg/kg de PC a permis d’atténuer les symptômes.
Cas 2 – Hépatite associée aux ICI
Une patiente de 68 ans a été opérée en avril 2021 d’un carcinome de l’hypopharynx et a reçu une ITx adjuvante composée de quatre cycles de pembrolizumab à partir de juin. Une augmentation des paramètres de la fonction hépatique (PFH) a ensuite été observée. En l’absence d’anomalies à l’anamnèse axée sur les maladies hépatiques, à l’imagerie et aux analyses de laboratoire en lien avec les maladies auto-immunes ou de stockage, une hépatite associée aux ICI a été soupçonnée. L’ITx a été arrêtée et un traitement par prednisolone parentérale a été instauré, à la suite duquel les valeurs hépatiques et l’état général se sont améliorés après 1 à 2 semaines seulement. La corticothérapie progressive a entraîné une normalisation complète et durable des PFH.
Cas 3 – Hypophysite associée aux ICI
Une patiente de 83 ans atteinte d’un cancer de l’endomètre récidivant a été traitée par pembrolizumab à partir de février 2021. En raison d’aphtes oraux et génitaux n’ayant pu être maîtrisés par un traitement local et d’une légère augmentation passagère des PFH, l’ITx a dû être arrêtée peu de temps après. La patiente est passée à l’atézolizumab en juin 2021, lequel a d’abord été bien toléré. Cependant, après six mois, l’état général s’est détérioré, avec une faiblesse croissante, des tremblements et des vomissements; suivi finalement par une syncope. Les paramètres thyroïdiens étaient normaux, mais le cortisol basal et l’ACTH n’étaient pas mesurables et le test au Synacthène était pathologique. On en a conclu à une insuffisance corticosurrénale secondaire dans le cadre d’une hypophysite associée aux ICI. Un traitement substitutif par hydrocortisone a été instauré et une formation d’urgence a été dispensée. Jusqu’à présent, la patiente ne présente aucun symptôme et l’ITx a pu être poursuivie parallèlement au traitement substitutif.
Cas 4 – Gastrite associée aux ICI
Une patiente atteinte d’un cancer bronchique primaire métastatique âgée de 75 ans au moment du diagnostic initial a reçu une ITx par pembrolizumab à partir d’octobre 2015 après trois chimiothérapies. Sous ce traitement par ICI, une régression de la tumeur primaire et des métastases a été observée pendant 3 ans et demi. En mai 2019, après 63 cycles, une rémission complète persistante était présente, mais le traitement par ICI a dû être interrompu en raison d’une mucosite prononcée. En septembre 2019, la patiente a été hospitalisée pour faiblesse, manque d’appétit et baisse de l’hémoglobine. La gastroscopie a révélé de larges défauts de la muqueuse aux contours mal définis, et une gastroduodénite ulcéreuse à médiation immunitaire a été diagnostiquée. Elle a reçu un traitement symptomatique par pantoprazole et sucralfate et un traitement substitutif contre l’anémie. Un traitement causal par corticostéroïdes a été administré, mais sans amélioration notable au bout d’un mois. Un traitement par rituximab a donc été instauré en complément, auquel la patiente a bien répondu. Elle est en rémission complète à ce jour.
Source:
3e cours de formation continue de l’ÖGGH, 15 juin 2023, Graz
Littérature:
1 Heinzerling L et al.: Dtsch Arztebl Int 2019; 116: 119-26 2 Haanen J et al.: Ann Oncol 2022; 33: 1217-38 3 Gong Z, Wang Y: JCO Oncol Pract 2020; 16: 453-61
Das könnte Sie auch interessieren:
Diabète de type 1: recherche de stratégies cardio- et néphroprotectrices
Malgré tous les succès obtenus dans la prise en charge de cette maladie au cours des décennies, les patients souffrant de diabète de type 1 (DT1) continuent d’enregistrer une mortalité ...
Étude GDAC: la personnalisation du taux d’HbA1c se concrétise
Le taux d’HbA1c, mesure de la charge glycémique à long terme, est largement accepté et a été associé au risque de complications du diabète il y a plus de 30 ans déjà.1 Cependant, la ...
Psychologie clinique dans le cadre de la réadaptation cardiovasculaire: approches de mise en pratique
Les patient·es atteint·es de maladies cardiovasculaires souffrent souvent de troubles psychiques. Cela peut avoir un impact considérable sur la qualité de vie et le pronostic. Grâce à un ...