Optionen bei therapierefraktären Keimzelltumoren
Autoren:
Dr. Ramin Madanchi
Prof. Dr. Carsten Bokemeyer
PD Dr. Christoph Seidel
Dr. Winfried Alsdorf
II. Medizinische Klinik
Onkologie, Hämatologie, Knochenmarktransplantation mit Abteilung Pneumologie
Universitäres Cancer Center Hamburg (UCCH)
Universitätsklinikum Hamburg-Eppendorf
Korrespondenz:
E-Mail: w.alsdorf@uke.de
Keimzelltumoren sind auch im fortgeschrittenen Stadium und bei Metastasierung in der Mehrzahl der Fälle kurativ behandelbar.1 Allerdings kommt es abhängig von der Risikosituation der Patient:innen in etwa 10–40% der Fälle trotz adäquater Erstlinientherapie zu Rezidiven. Im Folgenden werden Therapieoptionen für diese Patient:innen aufgezeigt.
Keypoints
-
Die Kombinationstherapie mit Gemcitabin, Oxaliplatin und Paclitaxel ist als Standardtherapie für mehrfach rezidivierte Keimzelltumoren etabliert.
-
Sie kann in ausgewählten Situationen in Kombination mit einer sekundären Resektion noch Heilungen erzielen.
-
Claudin-6 ist eine vielversprechende neue Zielstruktur für Immuntherapien bei Keimzelltumoren.
-
Die gegen Claudin-6 gerichtete CAR-T-Zell-Therapie ist auch bei refraktären, intensiv vorbehandelten Keimzelltumoren wirksam. Der Start einer Phase-II-Studie in dieser Indikation ist noch für das laufende Jahr geplant.
Standard in der Erstlinientherapie bei metastasierten Keimzelltumoren ist eine Cisplatin-basierte Kombinationschemotherapie gefolgt von einer chirurgischen Resektion von Tumorresiduen. Abhängig von der Risikosituation rezidivieren aber etwa 10–40% der Fälle trotz adäquater Erstlinientherapie. Die Therapie im ersten Rezidiv kann mit einer konventionell dosierten Kombinationschemotherapie (Cisplatin/Ifosfamid/Paclitaxel) oder einer sequenziellen Hochdosischemotherapie mit Carboplatin und Etoposid, gefolgt von einer autologen Stammzelltransplantation, erfolgen.
Die TIGER-Studie (NCT02375204), eine randomisierte und multizentrische Phase-III-Studie, untersucht gegenwärtig die Wirksamkeit einer konventionellen Salvage-Therapie im Vergleich zu Hochdosischemotherapie und anschließender autologer Stammzelltransplantation. Erste Ergebnisse werden für Mitte 2025 erwartet.
Bei rezidivierten Keimzelltumoren Hochdosischemotherapie
Retrospektive Daten deuten auf eine Überlegenheit der Hochdosischemotherapie bei rezidivierten Keimzelltumoren gegenüber der konventionellen Chemotherapie hin. Bei mehreren Rezidiven nach Standardchemotherapien kann die Hochdosistherapie in einigen Fällen immer noch Langzeitremissionen erzielen.2 Versagt die Hochdosistherapie, so ist die Prognose jedoch sehr ungünstig. Die deutsche S3-Leitlinie empfiehlt in diesem Fall eine Kombinationstherapie aus Gemcitabin, Oxaliplatin und Paclitaxel (GOP-Protokoll). Für eine lang anhaltende Remission ist bei Therapieansprechen auf diese Chemotherapie eine nachfolgende Resektion der Tumorresiduen essenziell.3 Eine Phase-II-Studie aus dem Jahr 2011 mit insgesamt 76 platinrefraktären Patient:innen zeigte, dass bei 10–15% der Patient:innen mit diesem Vorgehen eine langfristige Remission erreicht werden kann. Zum Zeitpunkt der Veröffentlichung waren 29 Proband:innen noch am Leben, krankheitsfrei waren in der Gemcitabin-Oxaliplatin-Gruppe 3 von 35 (9%) und bei Hinzunahme von Paclitaxel 6 von 41 (15%). Eine konsequente chirurgische Therapie von Residualbefunden war ein wesentlicher Bestandteil der Salvage-Therapie.4 Bestätigt wurde diese Phase-II-Studie 2016 durch eine retrospektive Auswertung. Diese zeigte bei 63 behandelten Patient:innen eine Ansprechrate von 44% sowie ein Langzeitüberleben bei 21%.4 Somit hat die Anwendung des GOP-Protokolls auch bei refraktären Keimzelltumoren mit multiplen Rezidiven noch ein kuratives Potenzial.
Wirksamkeit von Monotherapien und neuen Ansätzen bislang gering
Monotherapien bei mehrfach rezidivierten Keimzelltumoren zeigten bislang durchgehend nur geringe Wirksamkeit. Substanzen wie Etoposid, Paclitaxel oder Gemcitabin erzielen in dieser Situation Ansprechraten von 10–25% und sind daher einer Kombinationstherapie eindeutig unterlegen. Auch die Anwendung neuerer Zytostatika wie Cabazitaxel zeigte keine Verbesserung im Vergleich zu anderen Monochemotherapien.
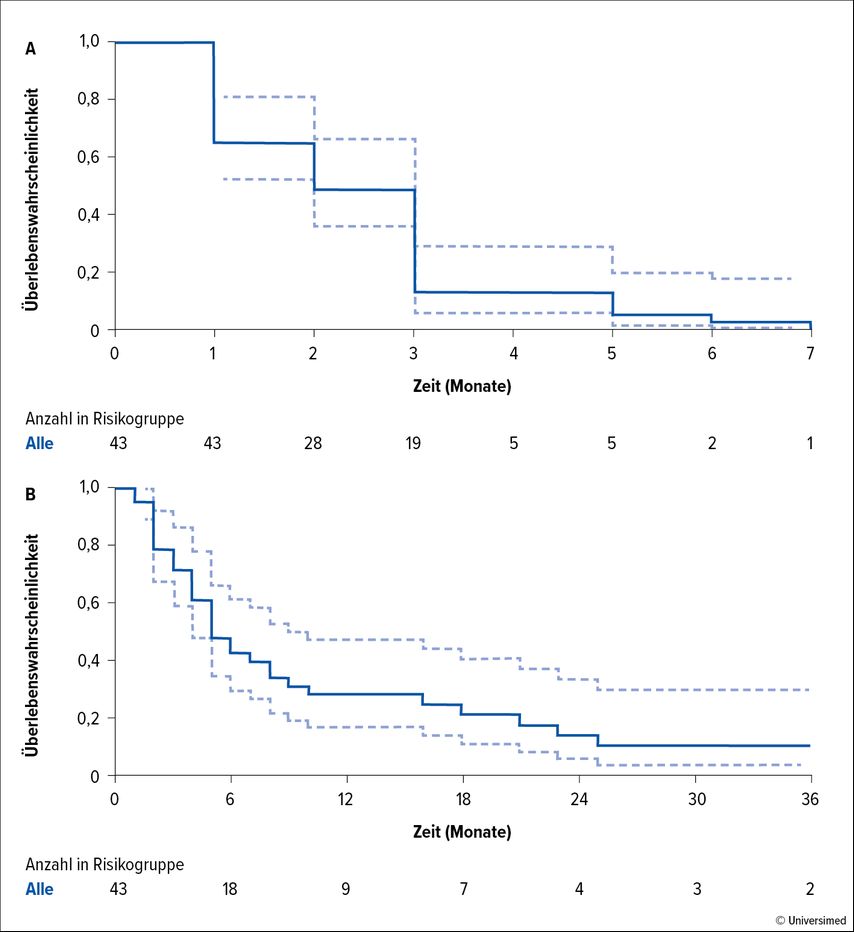
Leider konnten molekular zielgerichtete Therapien und Tyrosinkinase-Inhibitoren bei intensiv vorbehandelten Keimzelltumoren keinerlei relevante Resultate erzielen. Mehrere klinische Studien prüften diesen Ansatz mit Substanzen wie Everolimus, Thalidomid, Lenalidomid, Pazopanib (Abb. 1), Sunitinib und Sorafenib. Die Ansprechrate lag bei 0–13%.5–9
Abb. 1: Progressionsfreies Überleben (A) und Gesamtüberleben (B) der 43 Patient:innen, die mit Pazopanib behandelt wurden; gestrichelte Linien = 95%-Konfidenzintervall (modifiziert nach Necchi A et al.)5
Immuncheckpoint-Inhibitoren haben bei anderen urogenitalen Tumoren und verschiedenen soliden Tumoren beachtliche Therapieerfolge gezeigt. In zwei Phase-II-Studien bei mehrfach rezidivierten Keimzelltumoren konnte jedoch mit dem PD-1-Antikörper Pembrolizumab als Monotherapie keinerlei Antitumoraktivität erzielt werden.10,11
Die Kombination aus Durvalumab und Tremelimumab wurde in einer weiteren Phase-II-Studie untersucht. Von 22 Patient:innen wurde lediglich eine einzige partielle Remission beschrieben. Bei allen anderen Patient:innen wurde ein primärer Progress der Erkrankung beobachtet.12 Als Ursache für die Wirkungslosigkeit von Immuncheckpoint-Inhibitoren bei Keimzelltumoren ist anzunehmen, dass die sehr geringe Mutationslast dieser Erkrankung keinerlei intrinsische Immunreaktion auslösen kann. Diese Therapiemodalität sollte daher nur bei Keimzelltumoren mit dem seltenen Befund einer Mikrosatelliteninstabilität und hoher Tumormutationslast in Erwägung gezogen werden.
Einsatz von Antikörper-Chemotherapie-Konjugaten und CAR-T-Zellen
Embryonale Karzinome sowie Seminome können eine Expression von CD30 aufweisen. Dieses Oberflächenantigen kann als Zielstruktur für eine Therapie mit dem Antikörper-Chemotherapie-Konjugat Brentuximab-Vedotin verwendet werden.13 In einer Phase-II-Studie mit 24 Patient:innen konnte bei 78% ein Rückgang der Tumormarker beobachtet werden und ein radiologisches Ansprechen bei 22%. Das progressionsfreie Überleben betrug jedoch nach drei Monaten nur 11%, was auf eine schnelle Resistenzentwicklung zurückzuführen war.14
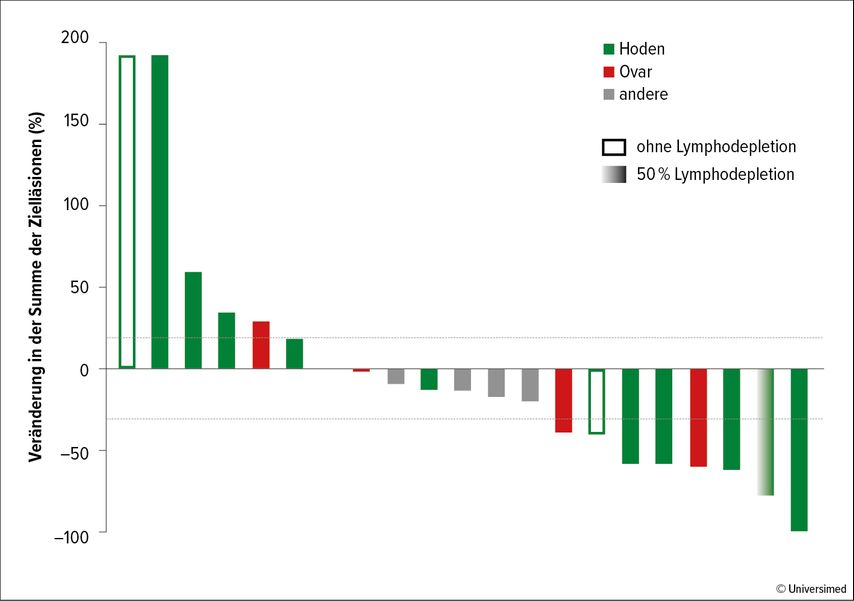
Der aktuell vielversprechendste Therapieansatz bei refraktären Keimzelltumoren ist eine gegen das onkofetale Antigen Claudin-6 gerichtete CAR-T-Zell-Therapie. Diese wird derzeit in der Phase-I-Studie BNT211 untersucht. Erste Zwischenauswertungen zeigen Ansprechraten von >50% bei höheren Dosisstufen und mehrfach Remissionen auch bei intensiv vorbehandelten Keimzelltumoren (Abb. 2).15 Da fast alle Keimzelltumoren Claudin-6 exprimieren, scheint die Anti-Claudin-6-CAR-T-Zell-Therapie die erste klinisch relevante zielgerichtete Therapieoption für diese seltene Erkrankung zu sein.
Abb. 2: Klinisches Ansprechen auf CLDN6-CAR-T-Zell-Behandlung±CARVac. Die Grafik zeigt die größte prozentuale Veränderung seit Beginn (Screening ca. 6 Wochen vor adoptivem Zelltransfer [ACT]) in der Summe der Durchmesser der Zielläsionen (modifiziert nach Mackensen A et al.)15
Generell sollten Patient:innen mit refraktären Keimzelltumoren in dieser seltenen Erkrankungssituation immer in einem spezialisierten Zentrum vorgestellt werden, um die Option einer Studienteilnahme zu prüfen und eine optimale Versorgung dieser seltenen Erkrankung sicherzustellen.
Literatur:
1 Oing C et al.: Platinum-refractory germ cell tumors: an update on current treatment options and developments. World J Urol 2017; 35(8): 1167-75 2 Einhorn LH et al.: High-dose chemotherapy and stem-cell rescue for metastatic germ-cell tumors. N Engl J Med 2007; 357(4): 340-8 3 Krege S et al.: Testicular tumors. Dt Arztebl int 2023; 120(49): 843-54 4 Seidel C et al.: Efficacy and safety of gemcitabine, oxaliplatin, and paclitaxel in cisplatin-refractory germ cell cancer in routine care – registry data from an outcomes research project of the German Testicular Cancer Study Group. Urol Oncol 2016; 34(4): 168.e21-8 5 Necchi A et al.: Pazopanib in advanced germ cell tumors after chemotherapy failure: results of the open-label, single-arm, phase 2 Pazotest trial. Ann Oncol 2017; 28(6): 1346-51 6 Oechsle K et al.: Lenalidomide in patients with cisplatin-refractory and multiply relapsed germ cell tumors. J Cancer Res Clin Oncol 2010; 136(1): 165-7 7 Oechsle K et al.: Preclinical and clinical activity of sunitinib in patients with cisplatin-refractory or multiply relapsed germ cell tumors: a Canadian Urologic Oncology Group/German Testicular Cancer Study Group cooperative study. Ann Oncol 2011a; 22(12): 2654-60 8 Oechsle K et al.: Preclinical and clinical activity of sunitinib in patients with cisplatin-refractory or multiply relapsed germ cell tumors: a Canadian Urologic Oncology Group/German Testicular Cancer Study Group cooperative study. Ann Oncol 2011b; 22(12): 2654-60 9 Rick O et al.: Activity of thalidomide in patients with platinum-refractory germ-cell tumours. Eur J Cancer 2006; 42(12): 1775-9 10 Adra N et al.: Phase II trial of pembrolizumab in patients with platinum refractory germ-cell tumors: a Hoosier Cancer Research Network Study GU14-206. Ann Oncol 2018; 29(1): 209-14 11 Tsimberidou AM et al.: Pembrolizumab in patients with advanced metastatic germ cell tumors. Oncologist 2021; 26(7): 558-e1098 12 Necchi A et al.: An open-label randomized phase 2 study of durvalumab alone or in combination with tremelimumab in patients with advanced germ cell tumors (APACHE): results from the first planned interim analysis. Eur Urol 2019; 75(1): 201-3 13 Giannatempo P et al.: Persistent CD30 expression by embryonal carcinoma in the treatment time course: prognostic significance of a worthwhile target for personalized treatment. J Urol 2013; 190(5): 1919-24 14 Ashkar R et al.: Phase II trial of brentuximab vedotin in relapsed/refractory germ cell tumors. Invest New Drugs 2021; 39(6): 1656-63 15 Mackensen A et al.: CLDN6-specific CAR-T cells plus amplifying RNA vaccine in relapsed or refractory solid tumors: the phase 1 BNT211-01 trial. Nat Med 2023; 29(11): 2844-53
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...