Nephrologische Basisdiagnostik
Autor:
Dr. med. Cédric Jäger EMBA (UniL)
Abteilung für Nephrologie
Medizinische Universitätsklinik
Kantonsspital Baselland, Standort Bruderholz
E-Mail: cedric.jaeger@ksbl.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Obwohl die chronische Niereninsuffizienz (CKD) eine der häufigsten Erkrankungen überhaupt ist,1 hat ihre Mortalität in den letzten Jahren im Vergleich zu Tumorerkrankungen oder der COPD zugenommen.2 Das Aufkommen neuerer nephroprotektiver Therapien wie SGLT2-Inhibitoren und GLP-1-Analoga machen die Früherkennung der CKD wichtiger denn je. In diesem Artikel geht es um die Möglichkeiten der nephrologischen Basisdiagnostik in der Grundversorgung.
Keypoints
-
Ein Screening auf das Vorliegen einer chronischen Niereninsuffizienz (CKD) wird bei allen Patienten mit kardiovaskulären Erkrankungen, Diabetes mellitus oder sonst erhöhtem Risiko für eine CKD empfohlen.
-
Zum Screening gehört die Bestimmung der Nierenfunktion mittels Kreatinin und eGFR (CKD-EPI) sowie der Albuminurie mittels Urin-Albumin-Kreatinin-Quotient (UACR).
-
Die erweitere Basisdiagnostik beinhaltet je nach Fragestellung das Urinsediment, eine vollständige Proteinurieabklärung, die Bestimmung der Urinindizes sowie die Sonografie.
Wann soll auf Nierenerkrankungen gescreent werden?
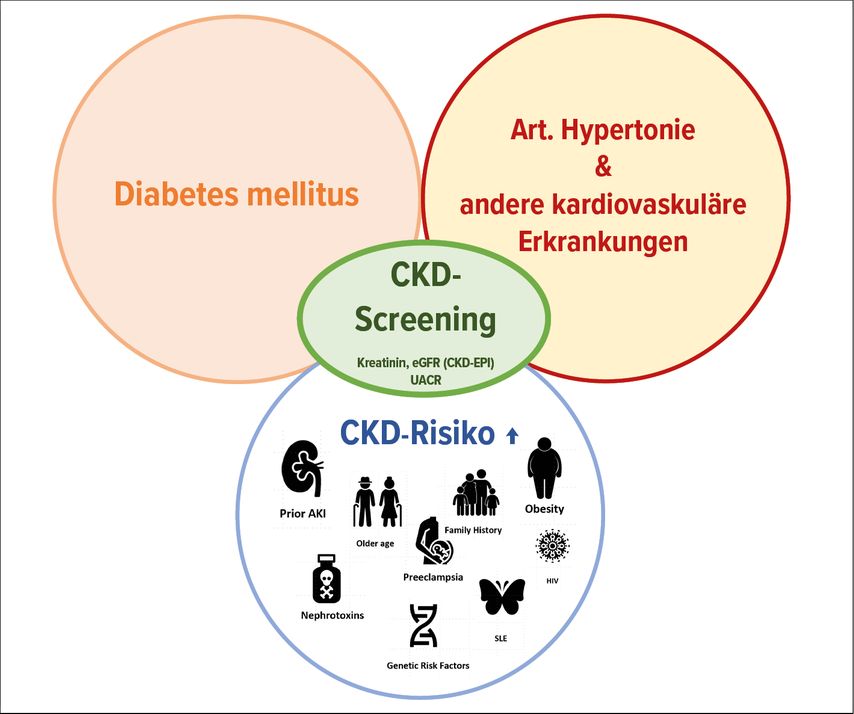
Ein generelles Screening auf Nierenerkrankungen in der Gesamtbevölkerung wird nicht routinemässig empfohlen. Das Vorhandensein gewisser Komorbiditäten steigert jedoch die Vortestwahrscheinlichkeit einer CKD deutlich, sodass Patienten gescreent werden sollen, die mindestens eines der folgenden drei Kriterien erfüllen: Vorhandensein einer arteriellen Hypertonie oder anderer kardiovaskulärer Erkrankungen, eines Diabetes mellitus oder von Komorbiditäten, die mit einer Nierenerkrankung einhergehen (Abb.1).3
Abb. 1: Ein Screening auf eine chronische Niereninsuffizienz (CKD) sollte erfolgen bei Vorliegen eines Diabetes mellitus oder von kardiovaskulären Erkrankungen sowie bei definierten Komorbiditäten mit erhöhtem CKD-Risiko (adaptiert nach Shlipak et al.)3
Die Nierenfunktion
Die Niere ist der wichtigste Regulator der körpereigenen Homöostase. Trotz substanzieller Variationen von Zufuhr und Umgebungsfaktoren hält die Niere die Körperkomposition in einem eng kontrollierten Gleichgewicht. Wenn wir die Nierenfunktion im klinischen Alltag bestimmen, messen wir ihre exkretorische Funktion. Diese umfasst die glomeruläre Filtration von Plasma sowie die selektive tubuläre Reabsorption oder Sekretion von Wasser oder Elektrolyten. Im klinischen Alltag hat sich die glomeruläre Filtrationsrate (GFR) als Surrogat der exkretorischen Funktion durchgesetzt. Die GFR ist definiert als das Produkt der Filtrationsrate jedes einzelnen Nephrons multipliziert mit deren Anzahl. Um die Nierenfunktion auf Variationen wie zum Beispiel die Nierengrösse zu standardisieren, wird die GFR pro 1,73m2 Körperoberfläche normiert, was der mittleren Körperoberfläche von jungen Männern und Frauen entspricht. Die normale GFR beträgt etwa 120–130ml/min/1,73m2 bei jungen gesunden Erwachsenen und nimmt mit zunehmendem Alter stetig ab.4 Trotz vieler Limitationen ist das Kreatinin – ein Endprodukt des Muskelkatabolismus – nach wie vor der beste Surrogatmarker zur Abschätzung der GFR. Es wird frei filtriert und nur wenig tubulär resorbiert oder sezerniert. Limitierend sind extrarenale Variationen wie Alter, Geschlecht oder Körperkomposition. Zudem reagiert das Kreatinin träge auf akute Veränderungen der GFR und hinkt immer einige Tage hinterher. Verschiedene Formeln (Cockcroft-Gault, MDRD, CKD-EPI) benutzen unterschiedliche Parameter, um aus dem Serumkreatinin die GFR abzuschätzen. Am genausten ist dabei die CKD-EPI-Formel, die Kreatinin, Alter, Geschlecht und Rasse mit einschliesst und an einer grossen Kohorte validiert wurde.5 Sie gilt heute als Standard. Letztes Jahr wurde eine Neuerung der CKD-EPI-Formel publiziert, welche die Rasse nicht mehr berücksichtigt.6 Ob sie sich durchsetzen wird, ist aktuell noch offen.
Das Cystatin C ist eine Alternative zum Kreatinin und kommt in den meisten Körperzellen vor. Obwohl es theoretisch weniger von extrarenalen Faktoren abhängig sein sollte, fehlt bislang der Nachweis dafür, dass die eGFR mittels Cystatin C viel besser abgeschätzt werden kann als mit dem Kreatinin. Es ist mittlerweile allerdings als Nierenfunktionsmarker akzeptiert und wurde in die Guidelines aufgenommen.3,6 Die meisten Nephrologen bestimmen es jedoch nur bei bestimmten Fragestellungen. Dabei gilt es auch zu berücksichtigen, dass die Bestimmung in der Schweiz gut fünfmal teurer ist als die günstige Kreatininbestimmung.
Proteinurie
Die Prävalenz der Proteinurie in der Gesamtbevölkerung beträgt rund 8% und nimmt mit dem Alter zu.7 Die Proteinurie ist ein wichtiger Marker vieler Nierenerkrankungen und spielt eine Rolle in deren Screening, Diagnostik und Monitoring. Sie ist oft das erste Anzeichen einer glomerulären Erkrankung und kann vor einem eGFR-Abfall auftreten. Nebst ihrer Bedeutung in der Diagnostik ist die Proteinurie auch ein Risikoprädiktor für die Progression von Nierenerkrankungen und Zeichen einer erhöhten kardiovaskulären Mortalität. Es wird zwischen glomerulärer, tubulärer und Overflow-Proteinurie unterschieden.
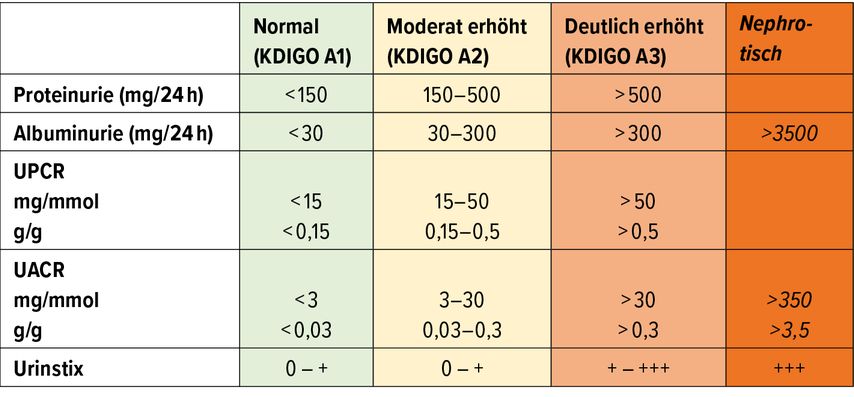
Die normale Proteinexkretion beträgt etwa 150mg pro Tag. Den grössten Anteil machen dabei unspezifische Proteine wie das Tamm-Horsfall-Protein aus. In der Proteinuriediagnostik wird zwischen grossmolekularen (Albumin) und kleinmolekularen Proteinen (α1-Mikroglobulin, retinolbindendes Protein) unterschieden. Albumin ist der wichtigste Marker der sogenannten glomerulären Proteinurie. Es wird in der gesunden Niere kaum durch die glomeruläre Basalmembran filtriert und sein Nachweis im Urin ist somit immer ein Hinweis auf einen strukturellen glomerulären Schaden. Früher wurde bei einer Albuminurie von 30–300mg/d von einer Mikroalbuminurie gesprochen, während >300mg/d als Makroalbuminurie bezeichnet wurde. Diese verwirrenden Bezeichnungen sollten nicht mehr verwendet werden, da es sich stets um eine Albuminurie handelt.
Von einer tubulären Proteinurie spricht man beim Nachweis kleinmolekularer Proteine (α1-Mikroglobulin, retinolbindendes Protein) im Urin. Diese Proteine werden frei filtriert, in der Regel aber vom Tubulussystem rückresorbiert und sind bei einer gesunden Niere praktisch nicht mehr messbar. Sie weisen auf eine gestörte tubuläre Rückresorption hin, wie sie bei akuter prärenaler Niereninsuffizienz mit Tubulusnekrose oder bei einer tubulo-interstitiellen Nephritis vorkommen kann.
Eine Overflow-Proteinurie als dritte Art der Proteinurie tritt auf, wenn grosse Mengen an Plasmaproteinen (z.B. Leichtketten beim multiplen Myelom oder Myoglobin bei der Rhabdomyolyse) die resorptive Kapazität des Tubulussystems übersteigen.
Quantitative Bestimmung der Proteinurie
Die 24-h-Urinsammlung ist der Goldstandard der quantitativen Bestimmung der Proteinurie. Aufgrund der Aufwendigkeit und der häufigen Sammelfehler wird sie jedoch nur noch selten angewendet.
Der Urinstix misst semiquantiativ Albumin. Er ist aber nur wenig sensitiv und kann geringe Mengen Albumin verpassen, wodurch er sich als Screening-Tool nur bedingt eignet. Weiter werden tubuläre oder Overflow-Proteinurie mit dem Stix nicht erfasst.
Das beste Tool zur einfachen Quantifizierung der Proteinurie ist die Verwendung der Urinquotienten. Dabei wird die Proteinkonzentration im Spoturin gemessen und im Verhältnis zur Kreatininkonzentration angegeben. Idealerweise erfolgt die Bestimmung im ersten oder zweiten Morgenurin. In der klinischen Praxis ist jedoch jeglicher Spoturin akzeptabel. Als Einheiten werden mg/mmol oder g/g verwendet. Aufgrund der konstanten Kreatininausscheidung von 100–200μmol/kgKG lässt sich die tägliche Proteinurie gut abschätzen. So scheidet eine 70kg schwere Person rund 10mmol Kreatinin pro Tag (150μmol x 70kg) aus. Wird ein Quotient in der Einheit mg/mmol verwendet, kann also einfach mit 10 multipliziert werden, um die geschätzte Proteinurie pro Tag zu erhalten. Bei mg/g entspricht das Resultat direkt der täglichen Proteinurie, weil 1g Kreatinin rund 10mmol Kreatinin (8,8mmol) entsprechen (Tab.1). Mehrere Studien haben gezeigt, dass die geschätzte tägliche Proteinurie anhand der Quotienten gut mit der 24-h-Urinsammlung korreliert und die aufwendige Sammlung obsolet macht.8
In der klinischen Praxis empfiehlt es sich, in der Screening-Untersuchung den Urin-Albumin-Kreatinin-Quotienten (UACR) zu bestimmen. Dieser Test ist bei den meisten Laboratorien standardisiert und sowohl ein Marker eines glomerulären Schadens als auch ein relevanter kardiovaskulärer Risikofaktor. Es konnte mehrfach gezeigt werden, dass bereits kleinste Mengen an Albumin im Urin (< 300mg/d) mit einer deutlich höheren kardiovaskulären Mortalität assoziiert sind.9 Allerdings ist die Albuminurie eher als Surrogatmarker eines erhöhten kardiovaskulären Risikos zu verstehen, als dass sich daraus eine Kausalität ergeben würde.
Ist eine Niereninsuffizienz bereits bekannt und geht es um die Abklärung der Ätiologie, ist die Aussagekraft des UACR insofern limitiert, als dass dieser weder kleinmolekulare (tubuläre) Proteine noch eine Overflow-Proteinurie nachweist. In diesen Fällen empfiehlt es sich, ein gesamtes Proteinprofil (Gesamtprotein, Albumin, α1-Mikroglobulin, retinolbindendes Protein) zu bestimmen. Ist dies nicht möglich, können der Urin-Protein-Kreatinin-Quotient (UPCR) und der UACR zusammen bestimmt werden. Besteht eine grössere Lücke zwischen diesen beiden, weist dies auf das Vorhandensein anderer Proteine als Albumin hin (z.B. tubuläre Proteinurie). Beträgt die Lücke aber mehr als geschätzt 1g/d, so muss differenzialdiagnostisch an eine Overflow-Proteinurie gedacht werden.
Hämaturie
Die Hämaturie bezeichnet den Nachweis von Erythrozyten im Urin. Der Urinstix ist zum Nachweis nicht geeignet, da er nicht die Erythrozyten, sondern das Hämoglobin misst. Falsch positive Resultate ergeben sich beispielsweise bei Vorhandensein von Myoglobin. Aber auch oxidierende Substanzen wie Desinfektionsmittel oder auch Sperma können zu falsch positiven Resultaten führen. Es wird daher die Durchführung eines Urinsediments empfohlen. Dabei werden 10ml Urin zentrifugiert, der Überstand wird dekantiert und das Zentrifugat unter dem Mikroskop untersucht. Die Mikrohämaturie ist definiert als der Nachweis von mehr als 2(–5) Erythrozyten pro Gesichtsfeld bei einer 400-fachen Vergrösserung. Wichtig ist dabei die Unterscheidung zwischen sogenannten glomerulären Erythroyzten (Ringformen, Akanthoyzten) und nichtglomerulären Erythrozyten. Die deformierten glomerulären Erythrozyten sind immer renalen Ursprungs und Ausdruck einer Glomerulopathie. Wird eine glomeruläre Mikrohämaturie nachgewiesen, so empfiehlt sich insbesondere bei gleichzeitigem Auftreten einer Niereninsuffizienz und/oder einer Proteinurie eine nephrologische Zuweisung für weitere Abklärungen und gegebenfalls die Durchführung einer Nierenbiopsie.
Abb. 2: Eine beginnende chronische Niereninsuffizienz sollte möglichst früh entdeckt werden, damit rechtzeitig eine nephroprotektive Behandlung begonnen werden kann
Urinindizes
Durch die Bestimmung von U-Natrium, U-Harnstoff und U-Kreatinin sowie von Serum-Natrium, S-Harnstoff und S-Kreatinin lassen sich die Urinindizes FeNa (fraktionelle Natrium-Exkretion) und FeHst (fraktionelle Harnstoff-Exkretion) berechnen. Einige Labors rechnen diese direkt aus, ansonsten finden sich die Formeln in vielen medizinischen Apps. Sie sind fester Bestandteil der Abklärung einer akuten Niereninsuffizienz. Ein FeNa von <1% oder ein FeHst von <35% weisen auf eine prärenale Niereninsuffizienz hin. FeHst wird dabei im Gegensatz zum FeNa nicht durch die Einnahme von Diuretika verfälscht. Die Indizes sind sehr spezifisch für prärenale Ursachen, normale Indizes schliessen diese aber nicht aus.
Sonografie
Die Sonografie hat ihren Stellenwert bei der Fragestellung nach strukturellen Veränderungen (z.B. Nierenzysten, Nierengrösse) oder postrenalen Veränderungen. Eine gesunde Niere misst 8,5–13cm. Grössenunterschiede können beispielsweise auf chronische Perfusionsprobleme hinweisen. Ein gestautes Nierenbecken weist auf eine Abflussbehinderung hin und sollte insbesondere bei Vorhandensein einer Niereninsuffizienz dringend eine urologische Abklärung nach sich ziehen.
Wann braucht es den Nephrologen?
Nicht jeder Nachweis einer Niereninsuffizienz, Proteinurie oder glomerulären Hämaturie macht eine nephrologische Zuweisung notwendig.
In folgenden Situationen ist sie aber empfehlenswert:
-
Zur Klärung der Ätiologie bei
- rascher Verschlechterung der eGFR >5ml/min/1,73m2 in einem Jahr
- (Zunahme der) Proteinurie (UACR >50–100mg/mmol)
- glomerulärer Mikrohämaturie mit gleichzeitigem Nachweis von Albuminurie und/oder Niereninsuffizienz -
Bei eGFR 30–45ml/min/1,73m2 bei progredienter chronischer Niereninsuffizienz
- zur Abklärung und Therapie der sekundären Komplikationen
- zur Planung der weiteren gemeinsamen Betreuung -
Bei eGFR 15–25ml/min/1,73m2 zur Planung und Vorbereitung einer Nierenersatztherapie
Zusammenfassung
Die chronische Niereninsuffizienz ist eine häufige Erkrankung mit hoher Morbidität und Mortalität. Neuere Möglichkeiten der renoprotektiven Therapie machen die Früherkennung essenziell. Zur Screening-Untersuchung gehört die Bestimmung der Nierenfunktion und der Albuminurie. Für die Bestimmung der Nierenfunktion eignet sich trotz einiger Limitationen nach wie vor das Serum-Kreatinin am besten, womit die eGFR anhand der CKD-EPI-Formel geschätzt werden kann. Die quantitative Albuminurie lässt sich am besten mittels UACR aus dem Spoturin bestimmen, der gut mit der täglichen Albuminurie korreliert. Zur erweiterten Diagnostik gehören die Bestimmung der Hämaturie mittels Urinsediment, die Bestimmung eines Urinproteinprofils bei Nierenfunktionsstörungen und der Urinindizes bei akuter Niereninsuffizienz sowie die Sonografie vor allem zum Beweis morphologischer Auffälligkeiten oder zum Nachweis postrenaler Ursachen.
Literatur:
1 Tomonaga Y et al.: The prevalence of chronic kidney disease in a primary care setting: a Swiss cross-sectional study. PLoS One 2013; 8: e67848 2 Institute for Health Metrics and Evaluation: Findings from the global burden of disease study 2017. 2018. www.healthdata.org 3 Shlipak MG et al.: The case for early identification and intervention of chronic kidney disease: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int 2021; 99: 34-47 4 Wetzels JFM et al.: Age- and gender-specific reference values of estimated GFR in Caucasians: the Nijmegen Biomedical Study. Kidney Int 2007; 72: 632-7 5 Inker LA et al.: Estimating glomerular filtration rate from serum creatinine and cystatin C. N Engl J Med 2012; 367: 20-9 6 Inker LA et al.: New Creatinine- and cystatin C-based equations to estimate GFR without race. N Engl J Med 2021; 385: 1737-49 7 Garg AX et al.: Albuminuria and renal insufficiency prevalence guides population screening: results from the NHANES III. Kidney Int 2002; 61: 2165-75 8 Price CP et al.: Use of protein:creatinine ratio measurements on random urine samples for prediction of significant proteinuria: a systematic review. Clin Chem 2005; 51: 1577-86 9 Chronic Kidney Disease Prognosis Consortium; Matsushita K et al.: Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010; 375: 2073-81 10 Skorecki K et al. (eds.): Brenner and Rector‘s The Kidney. 10th ed. Philadelphia: Elsevier; 2016
Das könnte Sie auch interessieren:
Neue Klassifikation soll für mehr Klarheit sorgen
Die Glomerulonephritis ist eine komplizierte Angelegenheit. Das liegt auch daran, dass die immunvermittelten Erkrankungen anhand von histopathologischen Mustern beschrieben werden, die ...
Einblicke in die aktuelle Forschung
Schweizer Nephrologinnen und Nephrologen gaben an ihrem Jahreskongress 2024 in Basel spannende Einblicke in ihre aktuelle Forschung. Wir stellen Ihnen hier einige dieser Arbeiten vor.
Spannende Fälle
Neben ihren Forschungsergebnissen stellten Schweizer Nephrologinnen und Nephrologen am Jahreskongress 2024 in Basel auch einige spannende und lehrreiche Fälle vor. Wir präsentieren Ihnen ...