Ein „Chamäleon“ unter den rheumatischen Erkrankungen
Bericht:
Mag. Dr. Anita Schreiberhuber
Aufgrund ihrer Vielfältigkeit ist die Sarkoidose schwer diagnostizierbar. Im Rahmen einer von „Rheuma Schweiz“ organisierten Fortbildungsveranstaltung gab Prof. Dr. Ludwig Erlacher (Klinik Favoriten und Karl-Landsteiner-Institut für Autoimmunerkrankungen und Rheumatologie, Wien) ein Update zum aktuellen Wissensstand und präsentierte einen Patientenfall.
Sarkoidose ist eine Erkrankung unbekannter Ursache, die durch Granulombildung in den betroffenen Organen charakterisiert ist. „Sarkoidose ist ein Chamäleon, das prinzipiell überall auftreten kann“, brachte es Erlacher auf den Punkt. Dementsprechend schwierig kann sich die Diagnose gestalten.
Pathophysiologisch weisen die T-Zell-Akkumulation, die lokale T-Zell-Antwort und die Granulombildung darauf hin, dass eine inflammatorische Response auf spezifische Antigene induziert wird. Welche Antigene das sind, ist jedoch unbekannt.1
Eine beim ACR-Kongress 2019 präsentierte Untersuchung von 1521 Patienten bestätigt, dass mit 92% die Lunge das Organ ist, in dem sich die Sarkoidose am häufigsten manifestiert, gefolgt von der Haut (37%), den extrathorakalen Lymphknoten (20%) und den Augen (10%).2
Umweltfaktoren und Medikamente als Trigger?
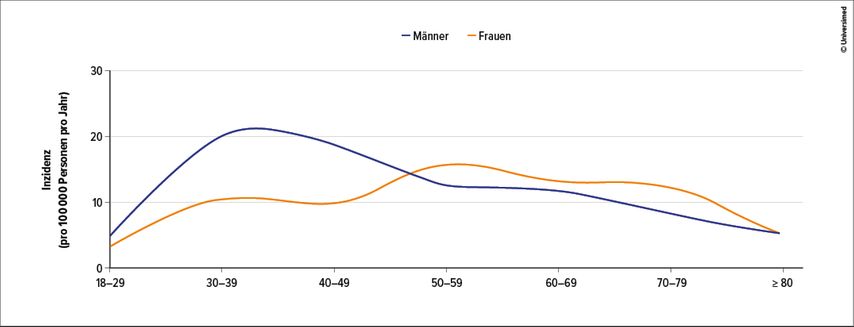
Die höchsten Inzidenzzahlen finden sich bei Afroamerikanern (18–71/100000 Einwohner) und in Nordeuropa (11–24/100000 Einwohner). Frauen sind etwas häufiger betroffen als Männer. Dabei wird bei Männern eine Häufung an Diagnosen zwischen dem 25. und 45. Lebensjahr (70%) und bei Frauen nach dem 50. Lebensjahr verzeichnet. Grundsätzlich sind aber keine klassischen Altersgipfel zu beobachten (Abb.1).3
Erlacher berichtete jedoch auch über eine zeitliche und räumliche Häufung – dies ist auch der Grund, weshalb Umweltfaktoren als Auslöser diskutiert werden. Als Beispiel erwähnte er, dass nach den Anschlägen auf das World Trade Center bei den Feuerwehrleuten, die den Schutt beseitigt haben, die Rate an Sarkoidose-Diagnosen in den darauffolgenden Jahren viel höher war als in den Jahren davor.
Interessant ist auch, dass Medikamente imstande sind, eine Sarkoidose zu induzieren. Paradoxerweise zählen TNF-α-Blocker dazu – also Substanzen, die für die Behandlung von schweren Sarkoidosen eingesetzt werden.1
Histologie unabdingbar, ausgenommen bei Löfgren-Syndrom
Für die Diagnose wegweisend sind die Klinik, der radiologische Nachweis und – bis auf eine Ausnahme – unabdingbar die Histologie.
Klinisch entwickeln die Patienten bei Lungenbeteiligung einen anhaltenden Husten, bei fortgeschrittener Erkrankung auch Dyspnoe. 30–50% der Patienten weisen eine extrapulmonale Beteiligung auf. Diese kann sich z.B. bei kardialer Lokalisation als AV-Block, Kardiomyopathie und/oder ventrikuläre Arrhythmie manifestieren. 70% der Patienten klagen über Müdigkeit, die sich in der Regel unter Therapie verbessert.4
Für die Diagnose der Sarkoidose gibt es keine spezifischen Laborparameter. Lediglich der Nachweis einer Hyperkalziämie als Ausdruck einer ektopen Vitamin-D-Bildung in den Granulomen ist aufschlussreich.4
Histologisch charakteristisch sind nicht verkäsende Granulome und ggf. Riesenzellen. Nur bei Vorliegen eines Löfgren-Syndroms kann auf eine histologische Diagnosesicherung verzichtet werden. Das Löfgren-Syndrom weist eine typische Kombination der folgenden Symptome auf: akutes Auftreten von Fieber, Erythema nodosum und Arthritis zusammen mit bilateraler hilärer Lymphadenopathie in der Bildgebung.4
Das Lungenröntgen hat zwar immer noch einen Stellenwert, wird jedoch zunehmend von der HRCT-Bildgebung verdrängt. Zunehmend zum Einsatz kommt auch das PET-CT, mit dem sich betroffene Areale durch Glukoseanreicherung nachweisen lassen.4
Radiografische Stadien und Prognose
In der Stadieneinteilung nach Siltzbach werden fünf radiologische Stadien für die Beschreibung von Veränderungen in der Lunge unterschieden:5
-
0 = keine pulmonale Sarkoidose
-
I = bilaterale hiläre Lymphadenopathie
-
II = bilaterale hiläre Lymphadenopathie plus parenchymale Infiltration
-
III = parenchymale Infiltration ohne hiläre Adenopathie
-
IV = fortgeschrittene Fibrose mit Nachweis von Bronchiektasien mit Honigwabenmuster
Eine chronische Sarkoidose (≥3 Jahre) ist mit einem höheren Risiko für eine Organfibrose assoziiert.4 20% der Patienten mit einer chronischen Sarkoidose entwickeln eine pulmonale Fibrose,4 was die Überlebenschancen verschlechtert.1
Therapiemöglichkeiten
Die Vorhersage des Krankheitsverlaufs ist faktisch unmöglich. „Die Tatsache, dass Spontanremissionen prinzipiell auch bei fortgeschrittener Erkrankung möglich sind, spricht eher für das Monitoring, es gibt aber absolute Behandlungsindikationen“, erläuterte Erlacher. Zu diesen zählen: Verschlechterung der Lungenfunktion, radiologischer Nachweis einer Fibrose, kardiale Beteiligung, Augen- oder neurologische Beteiligung, Lupus pernio (chronische Hautmanifestation) und Hyperkalziämie (Letztere wird mit Bisphosphonaten behandelt). 20–70% der Patienten benötigen eine systemische Therapie.3
Für die Therapie von Sarkoidose gibt es keine spezifischen, in prospektiven kontrollierten Studien untersuchten Substanzen. Jedoch gilt die Gabe von systemischen Glukokortikoiden für 6–12Monate als First-Line-Therapie.4 Bei GC-refraktären Patienten oder bei Relaps können sämtliche in der Rheumatologie verwendeten Immunsuppressiva (Methotrexat, Azathioprin, Leflunomid, Mycophenolat mofetil) oder Hydroxychloroquin (ggf. in Kombination mit GC) eingesetzt werden.3,4,6 Die TNF-α-Blocker Infliximab und Adalimumab werden als Therapie der dritten Wahl bzw. bei schweren Sarkoidosen empfohlen.4,6
Kasuistik
Eine 54-jährige Patientin wurde aufgrund einer multifokalen Lymphadenopathie im Jänner 2022 zur Abklärung des Vorliegens eines Lymphoms an der onkologischen Ambulanz der Klinik Favoriten vorstellig. Sie klagte über Fatigue, Gelenksschmerzen, leichte Belastungsdyspnoe und Gewichtsverlust seit mehreren Monaten. Als Komorbidität wies sie einen schlecht eingestellten Diabetes mellitus auf. Das histologische Bild der Lymphknoten zeigte eine epitheloidzellige granulomatöse Reaktion, die auf eine Sarkoidose hinwies. Somit wurde die Patientin an die rheumatologische Ambulanz verwiesen.
Im Juli 2022 hatte die Patientin erhöhte Serumkalziumspiegel (bis zu 3,2mmol/l) sowie eine deutlich eingeschränkte Nierenfunktion (GFR 27ml/min/1,7m2), sodass am 23. August eine stationäre Aufnahme erforderlich war. Die 25-Hydroxy-Vitamin-D-Spiegel waren mit 25nmol/l ebenso wie die Parathormonspiegel (77pg/nl) – passend zur Hyperkalziämie – massiv erniedrigt. Aufgrund der Sarkoidose hatte die Patientin also eine ektope Vitamin-D-Produktion entwickelt.
Therapeutisch waren eine forcierte Diurese wegen der akuten Niereninsuffizienz und aus demselben Grund Bisphosphonate kontraindiziert. Ebenso konnten Glukokortikoide aufgrund des schlecht eingestellten Diabetes mellitus (HbA1c: 7,5–8%) nicht zum Einsatz kommen. Deshalb wurde entschieden, die Patientin mit dem an sich kaum mehr verwendeten Calcitonin (initial 100mg/d, in weiterer Folge 300mg/d) und im Verlauf mit Furosemid zu behandeln. Unter Therapie kam es bereits nach einer Woche zu einer Normalisierung des Serumkalziums und einer Verbesserung der GFR. Zusätzlich wurde eine Therapie mit 2 Dosen Infliximab (5mg/kg KG) initiiert, woraufhin weiterhin eine Stabilisierung der Kalziumwerte im Normbereich sowie eine rasche Verbesserung der Fatigue erzielt werden konnten. Vor Therapiestart mit Infliximab zeichnete sich im MRT des Herzens eine vermutliche Myokardbeteiligung ab: Die diffuse, teils transmurale Kontrastmittelanreicherung mit erhöhtem Extrazellulärvolumen sprach für einen infiltrativen Prozess im Rahmen der bekannten Sarkoidose. Klinisch war die Patientin jedoch unauffällig. Das PET-CT nach der Infliximabtherapie zeigte zwar noch eine Aktivität, aber eine Verringerung der Glukoseanreicherung in den thorakalen und abdominellen Lymphknoten.
Quelle:
„Sarkoidose: Ein Update“ (hybrid), St. Gallen, 19. Dezember 2022
Literatur:
1 Grunewald J et al.: Sarcoidosis. Nat Rev Dis Primers 2019; 5: 45 2 Retamozo R et al.: Sarcoidosis as a systemic disease. Clinical and epidemiological characterization of systemic phenotype in 1521 patients. Abstract #906, ACR 2019 3 Valeyre D et al.: Sarcoidosis. Lancet 2014; 383: 1155-67 4 Polverino F et al.: Clinical presentations, pathogenesis, and therapy of sarcoidosis: state of the art. J Clin Med 2020; 9(8): 2363 5 https://sarcoidosisnews.com/stages-of-sarcoidosis/ 6 Baughman RP et al.: ERS clinical practice guidelines on treatment of sarcoidosis. Eur Resp J 2021; 58(6): 2004079
Das könnte Sie auch interessieren:
Gezielte Therapien bei axSpA – und wie aus ihnen zu wählen ist
Nachdem 2003 der erste TNF-Blocker zugelassen wurde, existiert heute für die röntgenologische (r-axSpA) und die nichtröntgenologische axiale Spondyloarthritis (nr-axSpA) eine ganze Reihe ...
Neue, zielgerichtete Therapien bei kutanem Lupus erythematodes
Etwa 70–85% der Betroffenen mit systemischem Lupus erythematodes (SLE) entwickeln im Krankheitsverlauf auch kutane Symptome (CLE), bei etwa 10–15% sind sie die Erstmanifestation eines ...
Was gibt es Neues in der Osteoporosebehandlung?
Es ist davon auszugehen, dass sich die Anzahl der von Osteoporose Betroffenen in der Schweiz durch die Altersentwicklung der Bevölkerung in den nächsten Jahrzehnten stark erhöhen wird. ...